13.11.2023
Совсем недавно на сайте мы публиковали данные метаанализа 9 исследований по применению TTF (Tumor Treating Fields) при глиобластоме с комментарием Н.В. Жукова. И снова аббревиатура прозвучала громко, да еще в журнале Lancet Oncology, где в конце сентября 2023 года были представлены результаты крупного проспективного рандомизированного исследования 3 фазы LUNAR, охватившего 130 центров из 19 стран [1].
До сих пор клиническое применение TTF при раке легкого оставалось своеобразной tabula rasa: авторы отмечают, что поиск в PubMed по запросу «TTFields AND non-small cell lung cancer» с 1 января 2003 г. по 30 апреля 2023 г. без языковых ограничений выявил всего лишь одно (!) пилотное исследование фазы 1/2 (EF-15; NCT00749346) по применению переменных электрических полей, создаваемых портативным медицинским устройством (NovoTTF-100L, Novocure, Хайфа, Израиль), в сочетании с пеметрекседом [2]. Пациенты, включенные в швейцарское исследование в 2008 и 2009 годах, имели НМРЛ, прогрессирующий на фоне предыдущей терапии; 90% больных получали лечение на основе платины. Исследование показало, что добавление Tumor Treating Fields (TTF) к пеметрекседу (рекомендованной терапии второй линии при включении пациентов) продемонстрировало предварительные данные по эффективности, включая медиану выживаемости без прогрессирования (ВБП) 22 недели, медиану общей выживаемости (ОВ) 13,8 месяца и 1-летнюю выживаемость 57%. Воспалительные изменения кожи были единственным частым нежелательным явлением, связанным с устройством, от легкой (24% пациентов) до умеренной (2%) степени дерматита под пластинами, который в целом купировался при применении местных стероидов; при этом серьезных нежелательных явлений, связанных с терапией TTF, отмечено не было. Доклинические исследования также показали эффективность TTF при НМРЛ; лечение снижало жизнеспособность клеточных линий немелкоклеточного рака легких с максимальным эффектом при частоте 150 кГц, и этот эффект суммировался при применении различных системных агентов. Кроме того, клеточная гибель, индуцированная TTF, стимулировала противоопухолевый иммунный ответ и увеличивала эффективность ингибиторов контрольных точек у мышей. Исследование LUNAR является первым и пока единственным рандомизированным исследованием 3 фазы по применению у больных НМРЛ.
Напомним: TTF – это переменные электрические поля, которые при воздействии на опухоль нарушают множество внутриклеточных процессов, имеющих решающее значение для выживания и пролиферации опухолевых клеток. Терапия TTF сугубо локорегиональна и неинвазивна, проводится с помощью портативного медицинского устройства, в котором используются две пары аппликаторов, помещаемых на кожу грудной клетки пациента, и связанных с основным генератором полей (рис.1). Ряд исследователей отмечают, что ношение устройства более 75% единицы времени (сутки) достоверно улучшает результаты, чем если это делать реже.
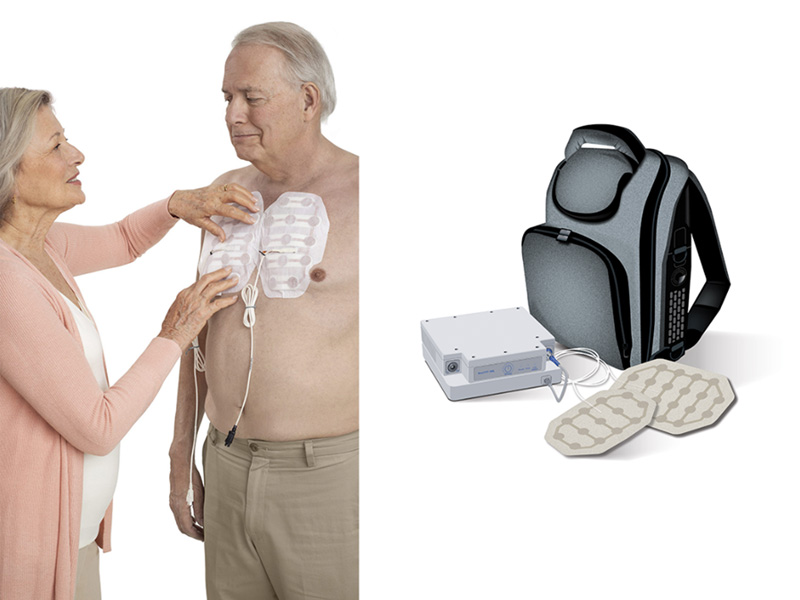
Рисунок 1. Расположение пластин-аппликаторов на грудной клетке пациента; генератор магнитных полей.
Пациенты, включенные в исследование, были в возрасте 22 лет и старше, с метастатическим немелкоклеточным раком легких, прогрессирующим во время или после терапии на основе платины, с плоскоклеточным или неплоскоклеточным раком и статусом по ECOG 2 или меньше. Предыдущая терапия препаратами платины была одним из условий, но не было ограничений на количество или тип предыдущих линий системной терапии. Участники были случайным образом распределены (1:1) на терапию TTF и стандартную системную терапию (ингибиторы иммунных контрольных точек (ниволумаб, пембролизумаб или атезолизумаб) или доцетаксел по выбору исследователя) или только стандартную терапию. Рандомизация проводилась централизованно и была стратифицирована по гистологии опухоли, лечению и локализации. Системную терапию проводили в соответствии с местными практическими рекомендациями. Терапия TTF (частотой 150 кГц) проводилась непрерывно на область грудной клетки (ориентировочно на опухоль и вовлеченные зоны) с рекомендацией достичь применения устройства в среднем не менее 18 часов в день. Первичной конечной точкой была общая выживаемость. В группу оценки безопасности вошли все пациенты, получавшие какую-либо терапию и прошедшие анализ в соответствии с фактически полученным лечением.
В итоге в период с 13 февраля 2017 г. по 19 ноября 2021 г. было зарегистрировано 276 пациентов, которые случайным образом были распределены на лечение TTF в сочетании со стандартной терапией (n=137) или только стандартной терапией (n=139). Средний возраст составил 64 года (59-70), 178 (64%) мужчин и 98 (36%) женщин, 156 (57%) имели неплоскоклеточный немелкоклеточный рак легкого и 87 (32%) ранее получали ингибиторы иммунных контрольных точек. Медиана периода наблюдения составила 10,6 мес. (6,1-33,7) для пациентов, получавших терапию TTF в сочетании со стандартной терапией, и 9,5 мес. (0,1-32,1) для пациентов, получавших стандартную терапию. Осмотры проводились каждые 6 недель.
Общая выживаемость оказалась значительно выше при комбинации TTF и стандартной терапии, чем только при стандартной терапии (медиана 13,2 мес. [95% ДИ 10,3-15,5] против 9,9 мес. [8,1-11,5]; отношение рисков [ОР] 0,74 [95% ДИ 0,56-0,98]; p=0,035) (рис.2). Общая одногодичная выживаемость составила 53% (95% ДИ 44-61) с TTF и стандартной терапией и 42% (33-50) в группе только стандартной терапии.
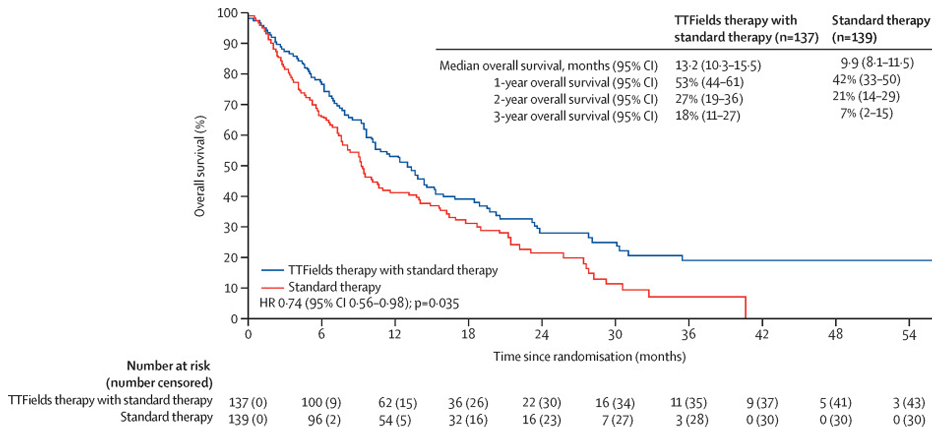
Рисунок 2. Общая выживаемость пациентов 2 групп, пролеченных по протоколу.
В подгруппе, получавшей ингибиторы иммунных контрольных точек, отмечено 38 случаев смерти из 66 пациентов, получавших терапию TTFields, и 52 случая смерти из 68 пациентов, получавших только ингибиторы иммунных контрольных точек. Добавление терапии TTF значительно улучшило общую выживаемость по сравнению с применением только ингибиторов иммунных контрольных точек, с медианой общей выживаемости 18,5 мес. (95% ДИ 10,6-30,3) и 10,8 мес. (8,2-18). соответственно и ОР 0,63 (95% ДИ 0,41-0,96; р=0,030) (рис.3А). Общая выживаемость в течение 1 года составила 60% (95% ДИ 47-71) с TTF и ингибитором иммунных контрольных точек и 46% (33-57) при использовании только ингибиторов иммунных контрольных точек.
В подгруппе, получавшей доцетаксел, медиана общей выживаемости составила 11,1 мес. (95% ДИ 8,2-14,1) с TTF и доцетакселом и 8,7 мес. (6,3-11,3) при использовании только доцетаксела, с ОР 0,81 (95% ДИ 0,55-1,19; p=0,28) (рис.3B). Общая одногодичная выживаемость составила 46% (95% ДИ 33-57) с TTF и доцетакселом и 38% (27-49) при использовании только доцетаксела.
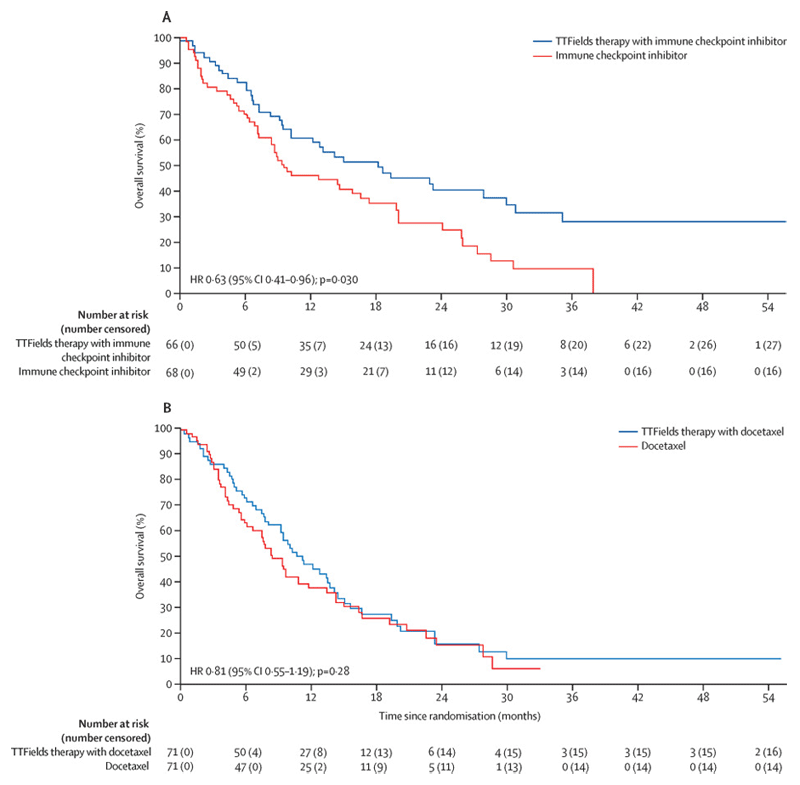
Рисунок 3. Общая выживаемость в группе TTF+ ИКТ (А) и TTF и доцетаксела (В).
Многофакторный анализ с использованием модели регрессии пропорциональных рисков Кокса выявил значительные преимущества терапии TTF со стандартным лечением по сравнению со стандартной терапией, а также для ингибиторов иммунных контрольных точек по сравнению с доцетакселом в качестве стандартной терапии, тогда как другие факторы, включая возраст, пол, статус ECOG, PD-L1 статус, история курения и гистология, существенно не повлияли на общую выживаемость.
В группе оценки безопасности лечения (n=267) любые серьезные нежелательные явления были зарегистрированы у 70 (53%) из 133 пациентов, получавших TTF в сочетании со стандартной терапией, и у 51 (38%) из 134 пациентов, получавших только стандартную терапию. Наиболее частыми нежелательными явлениями 3-4 степени были лейкопения (37 [14%] из 267), пневмония (28 [10%]) и анемия (21 [8%]). Нежелательные явления, связанные с TTF, были зарегистрированы у 95 (71%) из 133 пациентов; в основном это были (81 [85%)] осложнения со стороны кожи и подкожной клетчатки 1-2 степени. Было зарегистрировано три случая смерти, связанных со стандартной терапией (два из-за инфекций и один из-за легочного кровотечения), и ни одного случая смерти, связанного с терапией TTF.
Рандомизированное базовое исследование 3 фазы LUNAR явило собой доказательство 1-го уровня о том, что терапия TTF, инновационный локорегиональный метод лечения, применяемый одновременно со стандартной системной терапией, значительно улучшает общую выживаемость у пациентов с метастатическим немелкоклеточным раком легких после прогрессирования на терапии платиной или после нее по сравнению со стандартной системной терапией. Общий выигрыш в выживаемости при терапии TTF отмечен без усугубления токсичности, связанной с системной терапией; его профиль токсичности в основном ограничивался минимальными дерматологическими осложнениями. Возможно, в будущем подобная комбинация будет рассматриваться как стандартное лечение для этой категории пациентов.
Источники: