27.12.2023
Калпинский А.С.2, Мыслевцев И.В.1, Андрианов А.Н.1, Маилян О.А.2, Бурмистров Д.С.1, Головащенко М.П.2
1 АНО ЦКБ Святителя Алексия г. Москва
2 МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Цель: оценка эффективности и переносимости иммунотерапии во 2-й и последующих линиях метастатического рака почки (мПКР) в реальной клинической практике.
Материалы и методы: В анализ включили 40 пациентов мПКР, получивших иммунотерапию ниволумабом во 2-й и последующих линиях. Средний возраст 62 (42-82) года. Неблагоприятный прогноз мПКР зарегистрировали у 2 (5%), промежуточный – у 20 (50%) и благоприятный – у 18 (45%); Нефрэктомию выполнили 35 (87,5%) пациентам; Метастазы в легких диагностировали у 24 (60%), в л/у – 17 (42,5%), в костях – 13 (32,5%), в печени – 13 (32,5%); Метастазы в 3 и более органах диагностировали у 20 (50%); Светлоклеточный мПКР диагностировали у 35 (87,5%) пациентов, папиллярный – 4 (10%), хромофобный – 1 (2,5%); Саркоматоидный компонент в опухоли определили у 6 (15%). В 1-й линии лечения ингибиторы тирозинкиназ получили – 33 (82,5%); ИНФ + бевацизумаб – 5 (12,5%); комбинацию ингибитора тирозинкиназ + ингибитор mTOR – 1 (2,5%). Иммунотерапию ниволумабом во 2-й линии получили – 25 пациентов; в 3-й – 11; в 4-й – 4. Статус ECOG >2 на момент начала иммунотерапии выявили у 15 (37,5%) пациентов.
Результаты: Медиана длительности терапии 1-й линии составила 12 мес. Выживаемость без прогрессирования (ВБП) на иммунотерапии 2-й линии ниволумабом составила – 12,5 мес. (2-43); медиана общей выживаемости (ОВ) составила 17 мес. (2-43). Медианы ВБП и ОВ на иммунотерапии 3-й линии ниволумабом составили 20 мес. и 20 мес. (4-45) соответственно. Медианы ВБП и ОВ на иммунотерапии 4-й линии – 2,5 и 2,5 мес. (1-10) соответственно. При оценке частоты объективных ответов в наибольшей группе пациентов, получивших 2 линию, полный ответ (ПО) зарегистрирован у 1 (2,5%); частичный ответ (ЧО) – у 4 (10%), стабилизацию (СЗ) – у 20 (50%); прогрессирование (ПЗ) - у 13 (32,5%) больных; нет данных – 2 (5%). Контроль над заболеванием был достигнут у 25 (62,5%) пациентов. Достоверное влияние на риски прогрессирования и смерти оказывало наличие и степень объективного ответа. За медиану времени наблюдения в 16 мес. (1-45) в группе больных с ПО и ЧО не зарегистрировано ни одного больного с прогрессированием. В то время как в группе со СЗ через 3 года живы без прогрессии 38% больных, а в группе с ПЗ все пациенты умерли в течение первых 6 мес. Также выявлено влияние продолжительности ВБП во 2 линии (ВБП2) на ОВ. К 42 мес. лечения ОВ больных с ВБП2<12 мес. составила 7,5%, а с ВБП >12 мес. – 33,6%. Нежелательные явления 3-4ст. зарегистрировали у 1 (2,5%), отмена терапии. За время наблюдения умерло – 30 (75%) пациентов; от прогрессирования мПКР – 28 (70); Covid – 2 (5%).
Выводы: Практический опыт иммунотерапии (ниволумаб) во 2-й и 3-й линии мПКР демонстрирует сопоставимые результаты по эффективности и переносимости с проведенными клиническими исследованиями. Низкая эффективность иммунотерапии в 4 линии подтверждает необходимость использования данной терапии в более ранней линии. Достижение объективных ответов улучшает показатели выживаемости больных мПКР.
Введение
Согласно данным ВОЗ, в 2020 году в Мире зарегистрировали 431 288 новых случаев почечноклеточного рака (ПКР), что составило 2,2% в общей структуре онкологических заболеваний и 179 368 пациентов погибло от прогрессирования метастатического почечноклеточного рака (мПКР). В России в 2022 году зарегистрировали 24 172 новых случаев заболевания ПКР. Стандартизованный показатель заболеваемости населения России злокачественными опухолями почки составил 9,67 на 100 000 населения. Однако, несмотря на высокую частоту выявления локализованного ПКР I (55,4%) и II (11,3%) стадии, у 14,03% больных выявили местнораспространенные опухоли почки и у 18,68% больных мПКР. В 2021 году в России от ПКР умерло 8186 человек, однако в последние 5 лет регистрируют продолжающийся уверенный спад смертности, который за последние 10 лет уже составил 17,51% и, вероятно, обусловлен не только ранней диагностикой, но и улучшением результатов лечения мПКР [1-2].
За последние 3 года рекомендации ведущих онкологических сообществ поменялись не только в отношении второй и последующих линий, но и первой линии мПКР. В настоящее время основное место в лечении мПКР промежуточного и неблагоприятного прогноза по шкале International Metastatic Renal Cell Carcinoma Database Consortium (IMDC) согласно рекомендациям NCCN, ESMO, АОР и Минздрава России занимают иммунные и иммуннотаргетные комбинации (ниволумаб с ипилимумабом, пембролизумаб с акситинибом, пембролизумаб с ленватинибом или ниволумаб с кабозантинибом, а в качестве альтернативного режима авелумаб с акситинибом). Все вышеуказанные комбинации продемонстрировали достоверное преимущество в отношении общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП), частоты объективного ответа (ЧОО) и контроля над заболеванием при удовлетворительной переносимости [3-16].
Во второй линии лечения в большинстве рекомендации после тирозинкиназных ингибиторов (ТКИ) в качестве препаратов выбора присутствуют ниволумаб и кабозантиниб, в качестве альтернативных вариантов ленватиниб в комбинации с эверолимусом, а после современных иммунотаргетных комбинаций основной рекомендацией является включение в клинические исследования, если это возможно, или, в качестве альтернативного варианта, назначение ТКИ, который отсутствовал в иммунотаргетных комбинации. Ниволумаб является человеческим моноклональным антителом, которое блокирует взаимодействие между рецептором программируемой смерти (PD-1), экспрессируемого на Т-клетках, и его лигандами (PD-L1 и PD-L2), присутствующими на антигенпрезентирующих клетках и опухолевых клетках [17].
В исследовании 3 фазы CheckMate-025 продемонстрировано преимущество ниволумаба по сравнению со стандартной терапией ингибитором mTOR эверолимусом у больных с прогрессией на ТКИ в первой линии терапии. Медиана ОВ при терапии ниволумабом составила 25,0 мес. по сравнению с 19,6 мес. при лечении эверолимусом, частота объективных ответов при применении ниволумаба была выше (25%), чем при применении эверолимуса (5%) (p<0,001), при более благоприятном профиле безопасности [18]. По данным расширенного анализа результатов длительного наблюдения за пациентами, получавшим лечение в рамках протокола CheckMate-025, при минимальном наблюдении в течение 64 месяцев (медиана 72 месяца) ниволумаб сохранял преимущество в отношении ОВ по сравнению с эверолимусом: медиана 25,8 месяца [95% ДИ 22,2-29,8 месяца] против 19,7 месяца [95% ДИ 17,6-22,1 месяца]; отношение рисков [ОР], 0,73; 95% ДИ 0,62-0,85) с вероятностью 5-летней ОВ 26% и 18% соответственно [19].
В России ниволумаб зарегистрировали в декабре 2016 года в качестве монотерапии распространенного ПКР у взрослых пациентов после предшествующей системной терапии. Несмотря на то, что иммунотерапия уже зарекомендовала себя в качестве эффективного подходя для лечения ПКР, по-прежнему возникают вопросы в рациональном отбора пациентов.
Материалы и методы
В наше исследование включено 40 пациентов с мПКР, получающих лекарственную терапию препаратом ниволумабом в монорежиме во второй и последующих линиях терапии. Для стратификации пациентов мы применяли следующие данные: возраст, пол, морфологическая структура опухоли, хирургическое лечение рака почки, наличие саркоматоидного компонента в опухолевой узле, статус ECOG, прогноз заболевания по шкале IMDC, локализация метастатических очагов. Основными целями нашего исследования являлись общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП). ОВ рассчитывали от начала терапии ниволумабом до летального исхода от всех причин, ВБП рассчитывали с момента начала приема ниволумаба до прогрессирования заболевания или летального исхода. Прогрессирование заболевания оценивали с помощью контрольных методов обследования (КТ/МРТ органов грудной клетки, брюшной полости и малого таза). Вторичными целями исследования являлась оценка частоты объективных ответов (ЧОО) и нежелательные явления (НЯ), которые привели к отмене лекарственной терапии. ЧОО оценивали в соответствии с критериями оценки ответа при солидных опухолях (RECIST версии 1.1) [20]. НЯ, которые привели к отмене лекарственной терапии, оценивали с помощью критериев CTCAE версии 5.0 [21]. При статистической обработке применялась программа StatSoft Statistica v.12. Достоверность данных рассчитывалась с вероятностью ошибки менее 5% (p<0,05). Для обобщения данных использовали медиану, интерквартильный размах (ИР) и процентное соотношение для непрерывных и категориальных переменных соответственно. Для анализа ВБП и ОВ использовали метод Каплана-Мейера, для сравнительного подгруппового анализа показателей ОВ и ВБП применяли регрессионный анализ по Коксу и Лог-ранговый тест.
Результаты
Медиана времени наблюдения составила 16 (1-45) мес. Средний возраст пациентов на момент начала приема ниволумаба составил 62 (42-82) года. В нашей выборке преобладали пациенты со светлоклеточным почечноклеточным раком – 35 (87,5%) пациентов, с несветлоклеточными опухолями включено 5 (12,5%) пациентов. Низкодифференцированные опухоли G3 и G4 выявлены у 5 (12,5%) и 6 (15%) пациентов соответственно. Саркоматоидный компонент выявили у 6 (15%) пациентов. Хирургическое лечение в анамнезе в объеме нефрэктомии выполнили 35 (87,5%) пациентам. Количество пациентов в группах благоприятного, промежуточного и неблагоприятного риска по критериям IMDC составили 18 (45%), 20 (50%) и 2 (5%) соответственно. Наиболее распространенным лекарственным препаратом 1-й линии до начала системного лечения ниволумабом были ТКИ – 33 (82,5%), ИНФ + бевацизумаб – 6 (15%) и комбинация ленватиниба с эверолимусом – 1 (2,5%). Чаще всего диагностировали отдаленные метастазы в легких – 24 (60%), в л/у – 17 (42,5%), в костях – 13 (32,5%) и в печени – 13 (32,5%). Метастазы в 3 и более органах выявлены у 20 (50%) пациентов. Статус ECOG >2 на момент начала иммунотерапии зарегистрирован у 15 (37,5%) пациентов. Все исходные характеристики пациентов представлены в таблице 1.
Медиана длительности терапии 1-й линии составила 12 (5-27) мес. За время наблюдения умерло 30 (75%) пациентов; от прогрессирования заболевания – 28 (70%); Covid – 2 (5%). Ниволумаб в качестве терапии 2 линии получили 24 (62,5%) пациента, в качестве терапии 3 линии – 11 (27,5%) пациентов, в качестве терапии 4 линии получили 4 (10%) пациента. Медиана ВБП и ОВ на иммунотерапии 2-й линии ниволумабом составила 12,5 (3,5-22) мес. (см. рисунок 1) и 17 (5-27) мес. Медианы ВБП и ОВ на иммунотерапии 3-й линии ниволумабом составили 20 (4-41) мес. и 20 (4-45) мес. соответственно. Медианы ВБП и ОВ на иммунотерапии 4-й линии – 2,5 (2-10) и 2,5 (1-10) мес. соответственно (см. таблицу 4). При оценке ЧОО в наибольшей группе пациентов, получивших 2 линию, полный ответ (ПО) зарегистрировали у 1 (2,5%) пациента; частичный ответ (ЧО) – у 4 (10%) пациентов, стабилизацию (СЗ) – у 20 (50%) пациентов; прогрессирование (ПЗ) – у 13 (32,5%) больных; нет данных – 2 (5%) (см. таблицу 2). Контроль над заболеванием достигли у 25 (62,5%) пациентов. В связи с небольшим количеством законченных наблюдений наибольшему статистическому анализу подвергнута группа пациентов, получающих ниволумаб во второй линии (см. рисунок 4). При проведении корреляционного анализа по Спирману оценивали различные факторы, в том числе включавшие степень дифференцировки G, наличие саркоматоидного компонента, группу прогноза по критериям IMDC, наличие мтс в головном мозге, эффективность, достигнутая на 1 линии терапии, и влияние ЧОО. Статистически достоверную корреляцию с рисками прогрессирования и смерти выявили только со степенью объективного ответа (R= -0,52, p=0,009). За медиану времени наблюдения в 16 (1-45) мес. в группе больных с ПО и ЧО не зарегистрировано ни одного больного с прогрессированием (см. рис. 5). В то время как в группе со СЗ через 3 года живы без прогрессии 38% больных, а в группе с ПЗ все пациенты умерли в течение первых 6 мес. При проведении сравнения групп с применением Лог-рангового теста также выявлено влияние продолжительности ВБП на ОВ (р=0,01). К моменту 42 месяца лечения ОВ больных с ВБП2 <12 мес. составила 7,5%, а с ВБП >12 мес. – 33,6% (рис.3, табл.3). Нежелательные явления 3-4 ст. зарегистрировали у 1 (2,5%) пациента, в связи с чем отменили терапию.
Обсуждение полученных результатов
По данным проведенного анализа ниволумаб оказался эффективным и безопасным препаратом в реальной клинической практике. По сравнению с группой пациентов, получавших ниволумаб в исследовании Checkmate 025, в популяции российских пациентов отмечается меньшая частота возникновения нежелательных явлений как любой, так и тяжелой степени. Кроме того, в нашем исследовании было отличие в том, что преобладали пациенты с благоприятным и промежуточным прогнозом, неблагоприятного прогноза было на 11% меньше – всего 5%. Отмечаются приблизительно сопоставимые данные по ВБП, ОВ, ЧОО в группе ниволумаба по сравнению с исследованием Checkmate 025, что говорит о сопоставимой эффективности препарата в российской популяции с учетом поправки на линию применения ниволумаба и группу прогноза IMDC.
Медиана ВБП и ОВ на иммунотерапии 2-й линии ниволумабом составила 12,5 и 17 мес., а ЧОО составила 12,5% соответственно. НЯ, приведшие к прекращению лечения, диагностировали у 2,5%; пневмонит – наиболее распространенное НЯ, приводящее к прекращению лечения. В нашем исследовании ЧОО в наибольшей группе пациентов, получивших 2 линию, была чуть ниже, чем в регистрационном исследовании (12,5% vs 23%), но контроль над заболеванием удалось достичь 25 (62,5%) пациентам. Вероятнее всего низкая ЧОО связана с некорректной оценкой согласно критериям RECIST в рутинной практике, но частота контроля над заболеванием была сопоставима с исследованием CheckMate 025, что говорит о более частой регистрации стабилизации заболевания в нашей популяции больных. Несмотря на схожую чуть меньшую ОВ (17 против 25 мес.) и ЧОО, медиана ВБП в нашем исследовании была выше, чем в исследовании CheckMate 025 – 12,5 и 4,6 мес. соответственно. Вероятнее всего ретроспективный характер настоящего исследования был основной причиной такого результата. В связи с этим отсутствие режима график визуализации и различия между центрами могли привести к более длительной ВБП в этом исследовании.
Выводы
Практический опыт иммунотерапии ниволумабом во 2-й и последующих линиях мПКР демонстрирует сопоставимые результаты по эффективности и переносимости с проведенными клиническими исследованиями. Низкая эффективность иммунотерапии в 4 линии подтверждает необходимость использования данной терапии в более ранней линии. Достижение объективных ответов улучшает показатели выживаемости больных мПКР.
Таблица 1. Характеристики пациентов.
| Показатель | N=40 | % |
|---|---|---|
| Средний возраст (min – max), лет | 62 (42-82) | |
| Мужской пол, % | 22 | 55 |
| Вариант ПКР | ||
| Светлоклеточный | 35 | 87,5 |
| Папиллярный | 4 | 10 |
| Хромофобный | 1 | 2,5 |
| Нефрэктомия в анамнезе | 35 | 87,5 |
| Степень дифференцировки | ||
| 1 | 2 | 5 |
| 2 | 10 | 25 |
| 3 | 5 | 12,5 |
| 4 | 6 | 15 |
| Н/д | 17 | 42,5 |
| Саркоматоидный компонент | 6 | 15 |
| ECOG статус | ||
| 0 | 13 | 32,5 |
| 1 | 22 | 55 |
| 2 | 5 | 12,5 |
| Прогноз по IMSC | ||
| Благоприятный | 18 | 45 |
| Промежуточный | 20 | 50 |
| Неблагоприятный | 2 | 5 |
| Локализация мтс | ||
| Легкие | 24 | 60 |
| Л/у | 17 | 42,5 |
| Кости | 13 | 32,5 |
| Печень | 13 | 32,5 |
Таблица 2. Частота ответов на терапии ниволумабом во 2-й и 3-й линии.
| 2 линия | 3 линия | |||
|---|---|---|---|---|
| n | % | n | % | |
| ПО | 1 | 2,5 | – | – |
| ЧО | 4 | 10 | 3 | 27,3 |
| СЗ | 20 | 50 | 2 | 18,2 |
| ПЗ | 13 | 32,5 | 4 | 36,4 |
| ЧОО (ПО + ЧО) | 5 | 12,5 | 3 | 27,3 |
| КЗ (СЗ+ЧО+ПО) | 25 | 62,5 | 5 | 45,5 |
Таблица 3. ВБП и ОВ в различных группах.
| Выживаемость | Медиана, мес. | ИКР | Р |
|---|---|---|---|
| ВБП2 в зависимости от ответа | 0,001 | ||
| ПО | н/д | ||
| ЧО | н/д | ||
| СЗ | 19,5 | ||
| ПЗ | 3,5 | ||
| ОВ в зависимости от ВБП | 0,01 | ||
| ВБП <6 мес. | 3,5 | 2-6 | |
| ВБП 6-12 мес. | 11 | 10-12 | |
| ВБП >12 мес. | 29 | 20,41 | |
| ВБП на ниволумабе | 0,0001 | ||
| ВБП 2 | 12,5 | 2-43 | |
| ВБП 3 | 20 | 4-41 | |
| ВБП 4 | 2,5 | 2-10 |
Таблица 4. ОВ на ниволумабе в разных линиях.
| ОВ на ниволумабе | n | Медиана, мес. | Мин., мес. | Макс., мес. | ИКР, мес. |
|---|---|---|---|---|---|
| ОВ на всех линиях | 40 | 16 | 1 | 45 | 4-31 |
| ОВ 2 линия | 25 | 17 | 2 | 43 | 5-27 |
| ОВ 3 линия | 11 | 20 | 4 | 45 | 6-42 |
| ОВ 4 линия | 4 | 2,5 | 1 | 10 | 1,5-6,5 |
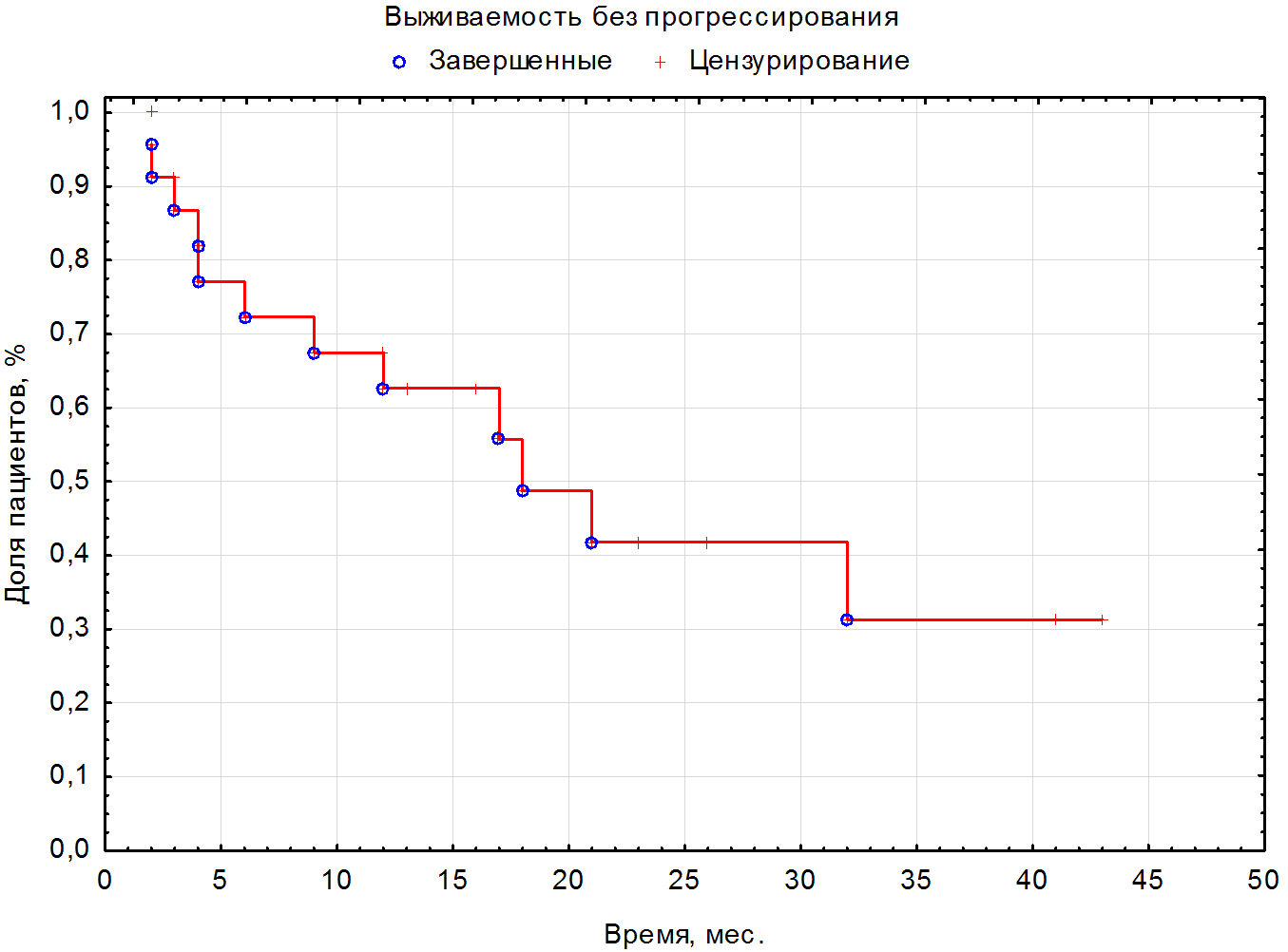
Рисунок 1. Выживаемость без прогрессирования на терапии ниволумабом во 2 линии.
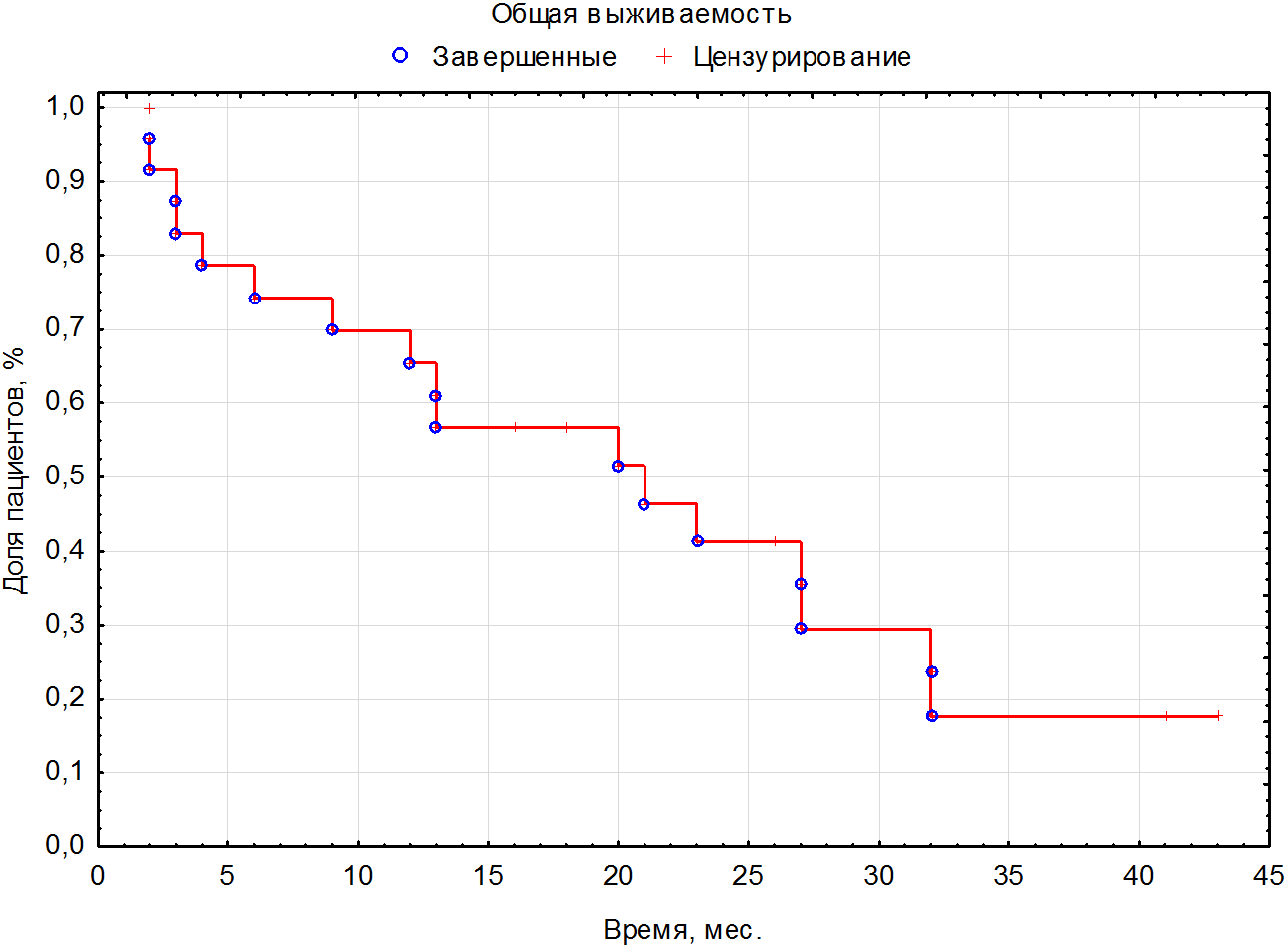
Рисунок 2. Общая выживаемость на терапии ниволумабом на всех линиях.
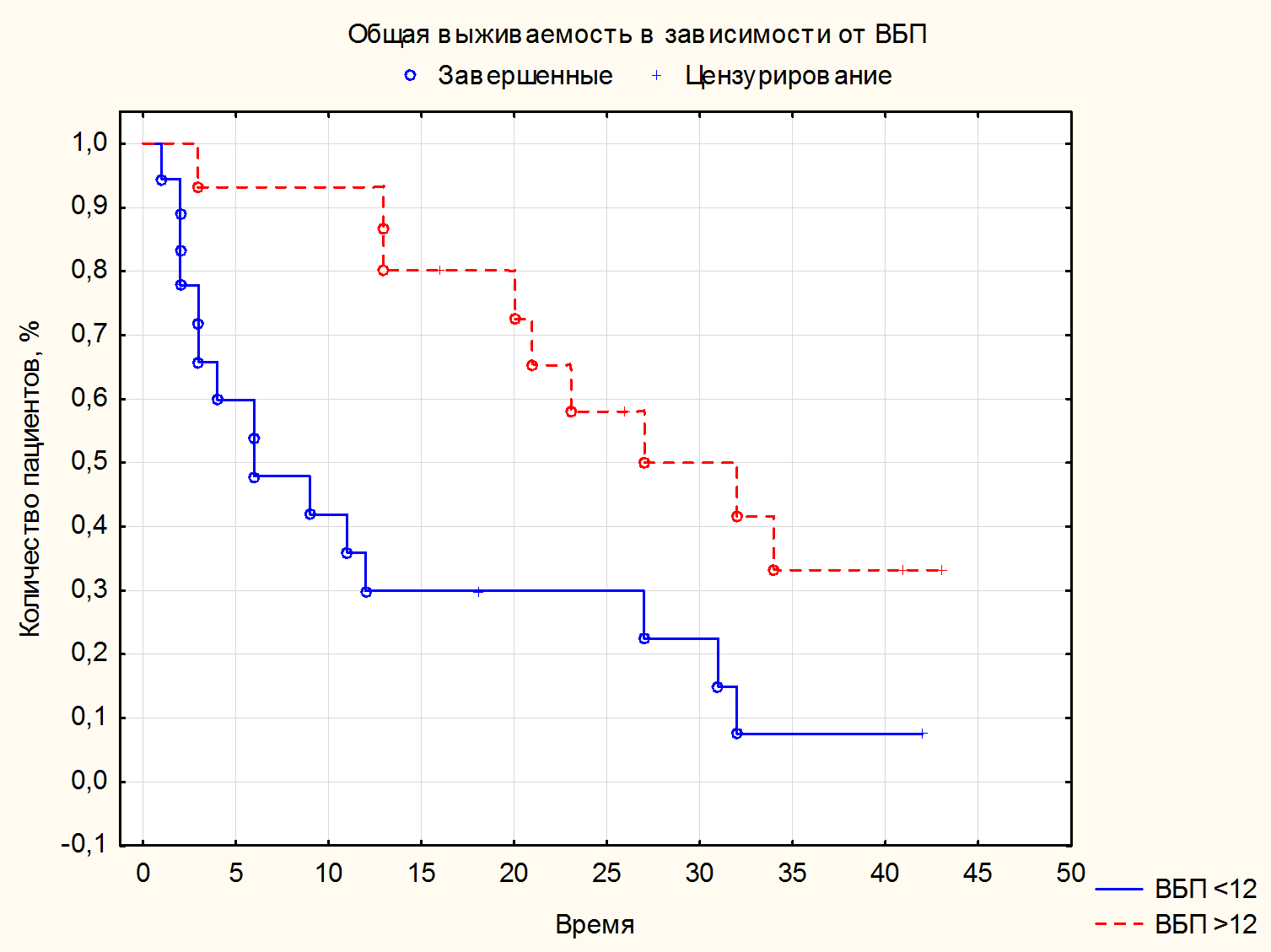
Рисунок 3. Общая выживаемость в зависимости от ВБП.
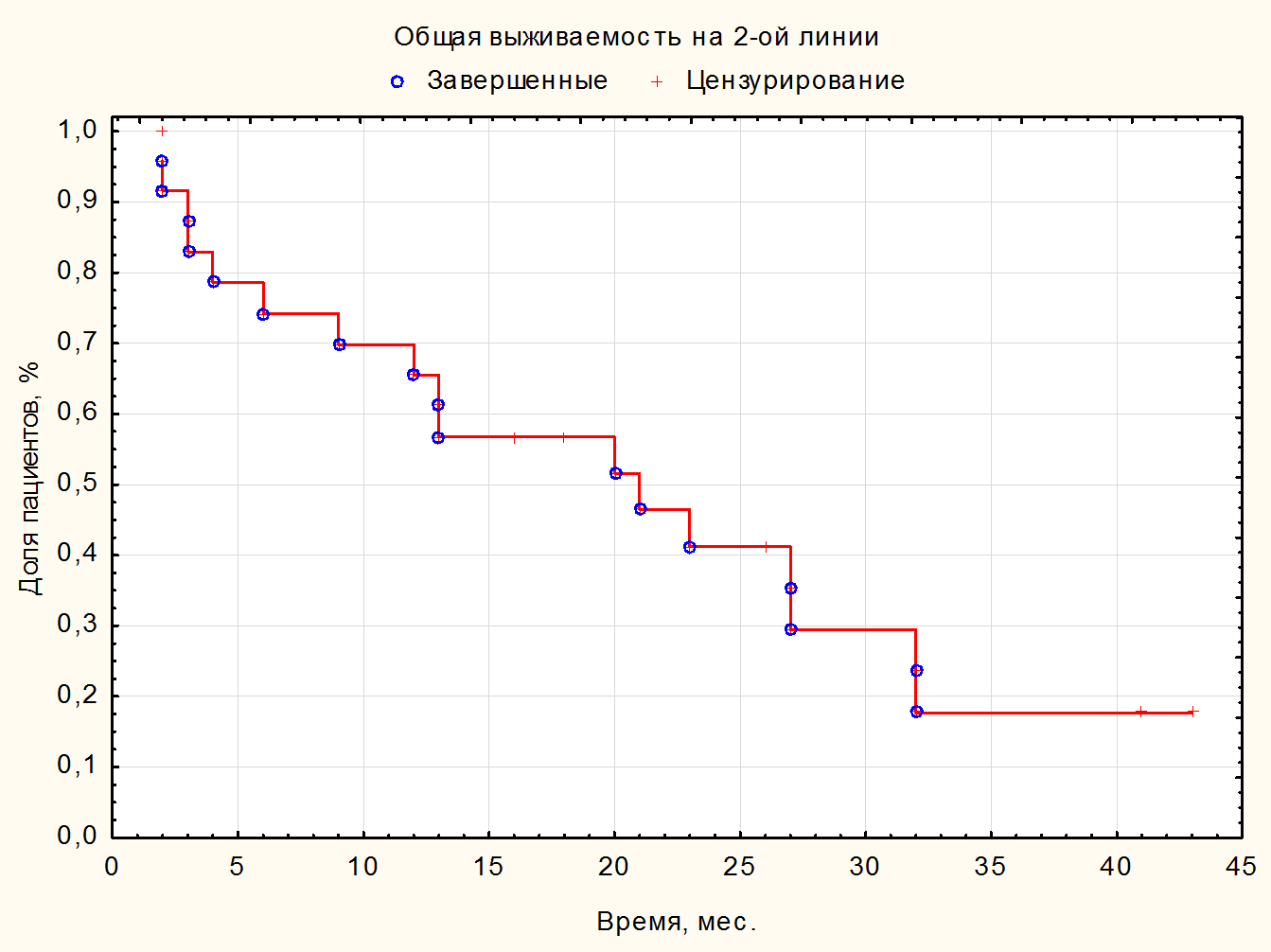
Рисунок 4. Общая выживаемость на терапии ниволумабом во 2 линии.
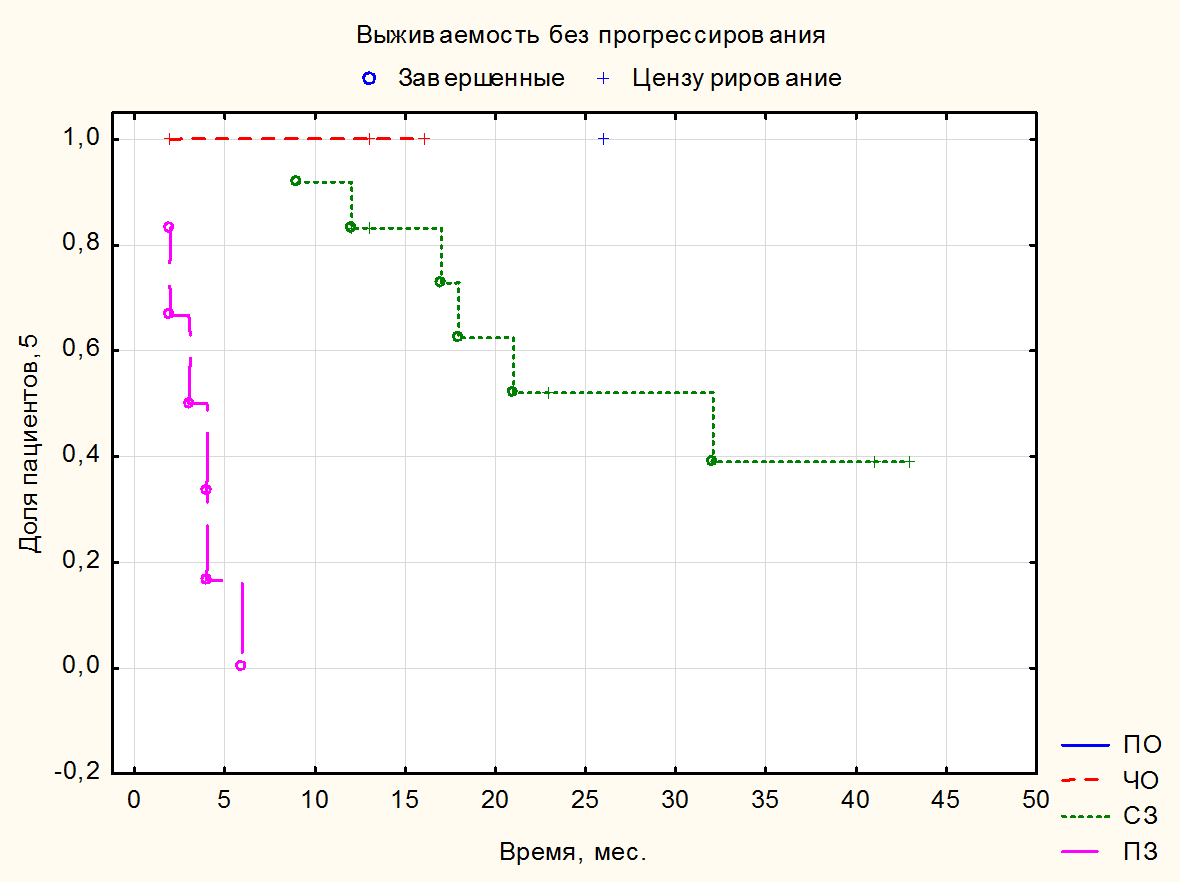
Рисунок 5. Выживаемость без прогрессирования на терапии ниволумабом во 2 линии в зависимости от ответа по критериям RECIST 1.1.
Список литературы: