08.12.2023
7 ноября 2023 г. Food and Drug Administration (FDA) на основании результатов исследования KEYNOTE-811 (NCT03615326) одобрило комбинацию пембролизумаба с трастузумабом и химиотерапией на основе платины в первой линии лекарственного лечения диссеминированного HER2+ рака желудка при CPS≥1.
KEYNOTE-811 – рандомизированное мультицентровое исследование 3 фазы, посвященное изучению эффективности пембролизумаба в комбинации с трастузумабом и стандартной химиотерапией на основе препаратов платины в первой линии лечения больных метастатическим HER2-позитивным раком желудка (РЖ).
Всего 698 больных было рандомизировано (1:1) в две лечебные группы:
Лечение проводилось до прогрессирования заболевания или неприемлемой токсичности, максимальная длительность терапии составила 24 месяца. Большинство пациентов в исследовании (85%) получали в качестве химиотерапии комбинацию оксалиплатина и капецитабина.
Добавление иммунотерапии позволило увеличить ЧОО с 59,8% до 72,6%, при медиане длительности ответа в 9,5 и 11,3 мес. в группах с и без анти-PD-1 терапии соответственно.
Медина ВБП в группе с пембролизумабом достигла 10,0 мес. против 8,0 мес. в группе плацебо (ОР=0,72; 95% ДИ 0,60-0,87; p=0,0002) при 24-месячной ВБП в 25,1% и 14,2% соответственно.
При подгрупповом анализе при CPS>1 добавление пембролизумаба к лечению позволило увеличить ВБП с 7,3 до 10,9 мес. (ОР=0,71; 95% ДИ 0,59-0,86).
Медина ОВ составила 20,0 мес. в группе пембролизумаба и 16,8 мес. в группе плацебо (ОР=0,84; 95% ДИ 0,70-1,01), при CPS>1 комбинация с пембролизумабом позволила увеличить ОВ с 15,7 до 20,0 мес. (ОР=0,81; 95% ДИ 0,67-0,98) (рис.1).
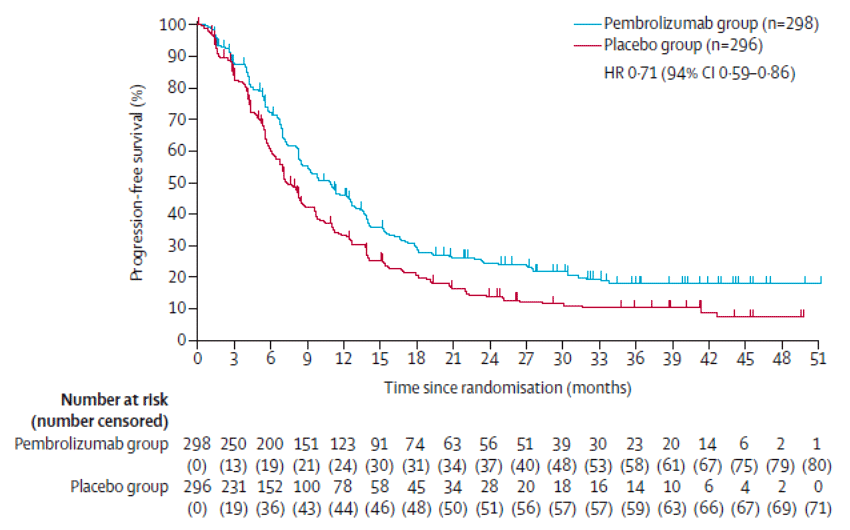
Рисунок 1. Кривые ОВ при CPS>1.
НЯ любой степени были зарегистрированы у 99% больных в группе с пембролизумабом и у 100% в группе контроля. НЯ 3 степени и выше были преимущественно представлены диареей (9% и 8%), тошнотой (4% и 4%), анемией (6% и 6%), нейтропенией (8% и 9%), тромбоцитопенией (6% и 7%), периферической сенсорной полинейропатией (4% и 2%).
Инфузионные реакции были отмечены у 16% в группе иммунотерапии и у 13% в группе плацебо, 3 степени и более – у 3% и 1% больных. Иммуноопосредованные НЯ любой степени в когортах были преимущественно представлены гипотиреозом (11% и 4%), пневмонитом (6% и 1%), колитом (5% и 3%) и гипертиреозом (4% и 3%).
Источники: