21.10.2023
Различные конъюгаты моноклональных антител с цитостатиками активно внедряются в рутинную клиническую практику в мире. Множество новых молекул появляется на фарма-цевтическом рынке ежегодно, что позволяет расширять опции лекарственной терапии боль-ным со злокачественными новообразованиями.
NCT05263479
Интересное исследование 1b фазы NCT05263479 из Китая, посвященное изучению эф-фективности нового коньюгата АТ с цитостатиком HS-20089. В работу были включены больные раком молочной железы, яичников и тела матки, ранее получавшие терапию.
HS-20089 представляет собой конъюгат, состоящий из моноклонального антитела (IgG1) к рецептору B7-H4 и ингибитора топоизомеразы I.
Основной целью исследования NCT05263479 являлось определение профиля ток-сичности и дозы исследуемого препарата. Опубликованы результаты терапии 28 больных диссеминированным тройным негативным РМЖ. При медиане времени наблюдения в 5,7 мес. и уровне дозы в 4,8 мг/кг (n=12) ЧОО достигла 33,3% при КРО в 66,7%, а при дозе 5,8 мг/кг (n=11) – 27,3% и 81,8% соответственно (рис. 1). Эффективность лечения не зави-села от терапии PARPi и иммунотерапии в анамнезе.
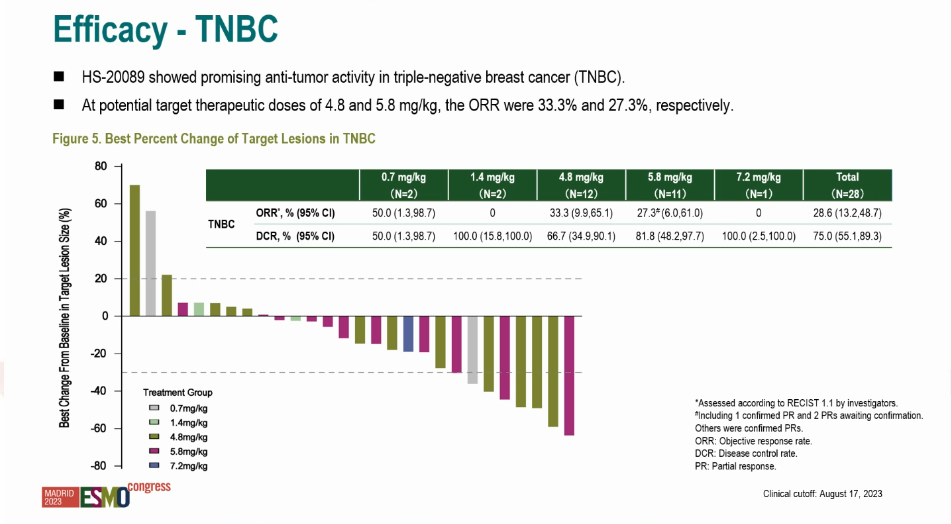
Рисунок 1. Эффективность HS-20089 при ТНРМЖ. Исследование NCT05263479
НЯ 3 степени и выше были преимущественно представлены гематологической и гастроинтестинальной токсичностью, ни одного случая пневмонита зарегистрировано не было.
Обновленные результаты DESTINY-Breast 04
DESTINY-Breast 04 – исследование 3 фазы отражающие эффективность трастузумаба де-рукстекана (T-DXd) в сравнении с химиотерапией у пациентов HER2-low (HER2 1+ или HER2 2+/FISH отрицательный) диссеминированным РМЖ в поздних линиях лечения.
557 пациентов были рандомизированы в 2 лечебные группы (2:1):
При медиане времени наблюдения в 32,0 мес. медиана ВБП в группе T-DXd достигла 8,8 мес. против 4,2 мес. в группе химиотерапии (ОР=0,36; 95% ДИ 0,29-0,45), что позволило снизить риск прогрессирования на 64%. В когорте пациентов с гормонозависимым РМЖ медиана ВБП в группе T-DXd составила 9,6 мес. против 4,2 мес. в группе химиотерапии (ОР =0,37; 95% ДИ 0,30-0,46).
Медиана ОВ в группе T-DXd достигла 22,9 мес. и 16,8 мес. в группе химиотерапии (ОР=0,69; 95% ДИ 0,55-0,86), при 36 мес. ОВ в 26,2% и 16,3% в когортах соответственно.
У пациентов с гормонозависимым РМЖ медиана ОВ в группе T-DXd достигла 23,9 мес. против 17,6 мес. в группе химиотерапии (ОР=0,69; 95% ДИ 0,55-0,87), при 36 мес. ОВ в 26,5% и 16,9% в лечебных группах соответственно (рис. 2).
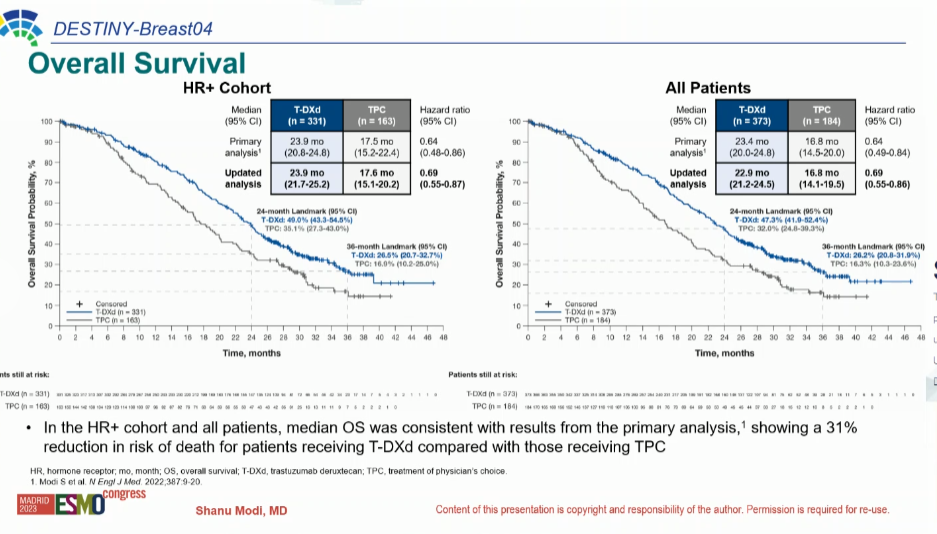
Рисунок 2. Обновленные результаты DESTINY-Breast 04
В когорте пациентов с гормонорезистентным РМЖ медиана ВБП в группе T-DXd до-стигла 8,5 мес. против 2,9 мес. в группе химиотерапии (ОР=0,29; 95% ДИ 0,15–0,57), что позволило снизить риск прогрессирования на 71% при медианах ОВ в 17,1 мес. и 8,3 мес. (ОР=0,58; 95% ДИ 0,31-1,08) соответственно.
Интересен анализ ВПБ2 (время до прогрессирования на последующей линии терапии): в группе с T-DXd ВПБ2 составила 15,4 мес., против 9,7 мес. в когорте химиотерапии (ОР=0,51; 95% ДИ 0,41-0,64).
Профиль токсичности был ожидаем и приемлем.
Эффективность трастузумаба дерукстекана при метастазах в головном мозге у паци-ентов с HER2 позитивным раком молочной железы. Объединенный анализ DESTINY-Breast 01, 02, 03.
В ретроспективное исследование включено 1350 больных с метастатическим поражением ЦНС, 851 пациент получали T-DXd и 465 пациентов – другую терапию (трастузумаб+ капецитабин, лапатиниб + капецитабин, T-DM1).
В работе показано, что назначение T-DXd позволяет достигнуть ЧОО в 45,2% (17,3% – полный ответ, 28,8% – частичный ответ) при бессимптомных метастазах в головном мозге и 45,5% (15,9% – полный ответ, 29,5% – частичный ответ) при клинически явном пораже-нии ЦНС. Эти результаты значимо выше, чем в группе сравнения, где КРО даже у паци-ентов с неактивными метастазами составил 27,6% (рис. 3).
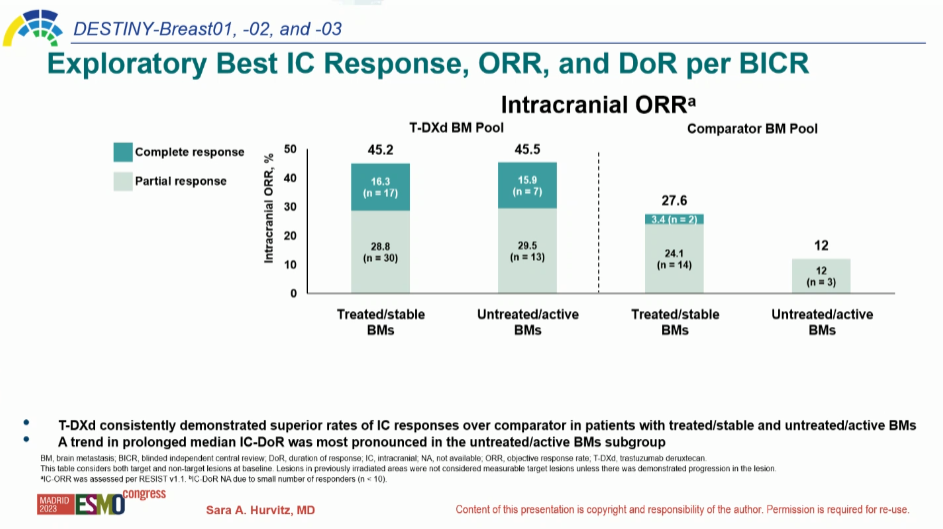
Рисунок 3. Объеденный анализ DESTINY-Breast 01, 02, 03. Эффективность T-DXd при метастазах в ЦНС.
Назначение T-DXd в этой крайне неблагоприятной группе пациентов также позволило увеличить и мВБП, как в группе с бессимптомными метастазами в ЦНС с 8,7 мес. до 12,2 мес. (ОР=0,59; 95% ДИ 0,4-0,9), так и при клинически значимом поражении с 4,0 мес. до 18,5 мес. (ОР=0,20; 95% ДИ 0,11-0,35).
На основании представленных данных исследователи делают вывод о высокой активно-сти T-DXd при метастатическим поражении головного мозга у больных HER2 позитив-ным РМЖ.
Источники: