02.10.2023

На подобную комбинацию – таргетной терапии, в частности, ингибиторов тирозинкиназы (ТКИ), и лучевой терапии – уже давно возлагались немалые надежды исследователей, практикующих врачей и самих пациентов, практически с тех пор, как таргетная терапия получила широкое распространение в лечении опухолей различных локализаций. До тех пор, да и поныне, одновременная химиолучевая терапия на протяжении многих лет была и остается краеугольным камнем лечения злокачественных опухолей многих локализаций, поскольку сочетание химиотерапии и дистанционной лучевой терапии отличается хорошим синергизмом. Однако преимущества химиолучевой терапии в плане выживаемости чаще всего идут рука об руку с повышенной токсичностью, ведь ХЛТ не обладает селективностью в отношении только опухолевых клеток. По этой причине комбинация лучевой терапии с ингибиторами тирозинкиназы опухолеспецифических рецепторов (например, с лапатинибом, эрлотинибом, цетуксимабом, бевацизумабом, панитумумабом) казалась многообещающей альтернативой ХЛТ, подразумевая более «сфокусированный» противоопухолевый эффект и, таким образом, уменьшая токсичность.
Ответ на комбинированную терапию может быть усилен при сочетании ионизирующего излучения с ТКИ по ряду причин: поскольку ионизирующее излучение способствует активности тирозинкиназ, радиационно-индуцированные противоопухолевые эффекты ТКИ в сочетании с облучением могут быть более выражены; репарация ДНК, которой способствуют тирозинкиназы, будет ингибироваться TKИ, тем самым еще более препятствуя восстановлению повреждений, вызванных ионизирующим излучением, и т.д.; по этим причинам на комбинацию ТКИ и ЛТ действительно возлагались немалые надежды.
Сотни работ – ретро-анализов, клинических наблюдений, исследований 1, 2 и, наконец, 3 фазы – были посвящены этой проблеме. Авторы метаанализа ROCKIT 2021 года [1] из общего количества работ выбирали только проспективные рандомизированные исследования с четкими критериями, и их набралось 13 с общим числом пациентов 5678. Исследования включали пациентов со злокачественными опухолями головы и шеи (6 исследований, 3295 пациентов), пищевода (3 исследования, 762 пациента), легких (2 исследования, 550 пациентов) и головного мозга (2 исследования, 1542 пациента). Препараты, примененные в исследованиях, – лапатиниб, эрлотиниб, бевацизумаб, цетуксимаб, панитумумаб. В трех исследованиях оценивалась комбинация малых молекул и лучевой терапии (949 больных), а в 10 исследованиях – антитела и ЛТ (4729 больных).
Увы, никаких преимуществ в общей выживаемости в целом по данным анализа не наблюдалось (HR=1,02; 95% CI 0,90-1,15; P=0,76) (рис.1).
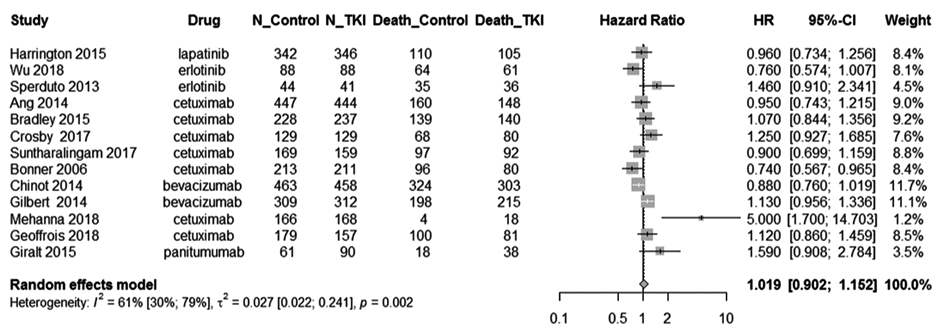
Рисунок 1. Метаанализ проспективных исследований по комбинации любых ТКИ и ХЛТ/ЛТ: общая выживаемость в сравнении с только ХЛТ/ЛТ.
Однако при этом комбинация привела к значительному повышению риска выраженной клинически значимой токсичности. Так, комбинация любых ТКИ с ХЛТ в сравнении с только ХЛТ демонстрирует, что относительный риск составил 1,18 (95% CI 1,09-1,28; P=0,003) (рис.2), и в целом частота клинически явных осложнений колебалась между 10% и 40%.
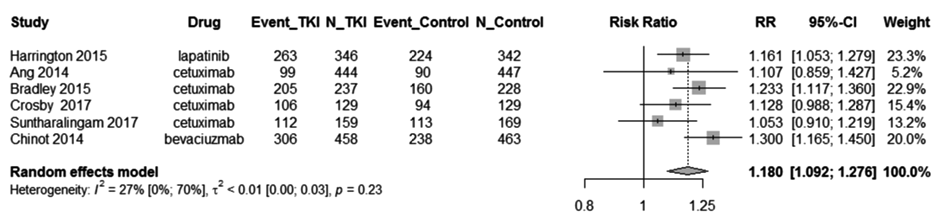
Рисунок 2. Риск развития осложнений 3+ степени при комбинации ХЛТ+ТКИ в сравнении с только ХЛТ.
Авторы метаанализа сделали вывод, что подобная комбинация не приводит к улучшению общей выживаемости, но чревата более высокой частотой грозной токсичности 3+ степени, а следовательно – не рекомендована к рутинному применению.
Тем не менее, идея по-прежнему казалась привлекательной, и исследования продолжались. В июле и сентябре 2023 года опубликованы результаты еще 2 проспективных исследований 2 фазы.
В июле 2023 года в Красном журнале ASTRO представлены данные мультицентрического проспективного рандомизированного исследования 2 фазы NRG Oncology-KROG/RTOG 1119 по применению лапатиниба в комбинации с облучением всего объема головного мозга или стереотаксической радиохирургией (СРХ) у больных HER2-позитивным раком молочной железы с метастазами в головной мозг [2]. Коллектив авторов из Южной Кореи, США и Канады сравнил результаты комбинации с только лучевой терапией в плане частоты развития полного клинического интракраниального ответа на 12 неделях, включив в исследование 143 пациента, из которых 116 оказались доступны для анализа. Все больные получали лучевую терапию (37,5 Гр за 3 недели на весь объем мозга либо СРХ в соответствии с размером очагов) с одновременным добавлением лапатиниба (1000 мг ежедневно на протяжении 6 недель) либо без него. Вторичные конечные точки включали общую частоту объективных ответов (ЧОО), частоту ответов в зависимости от характеристик очагов, выживаемость без прогрессирования по ЦНС и общую выживаемость.
И вновь разочарование: комбинация не улучшила ни частоту полных клинических ответов (0% против 6% для только ЛТ, P=0,97), ни частоту общих ответов за 12 недель, хотя на отрезке 4 недель ЧОО оказалась выше в группе комбинации (55% против 42%), то есть кратковременный эффект был отмечен – но ценой клинически выраженных осложнений 3 и 4 степени, которые встречались значительно чаще в случае комбинированного лечения: 8% и 0% только для ЛТ, 28% и 6% для комбинации соответственно. Исследование оказалось вновь негативным – но не единственным.
В сентябрьском номере журнала JAMA Oncology опубликованы результаты рандомизированного исследования 2 фазы по применению ХЛТ с цисплатином с добавлением лапатиниба или без него у больных местнораспространенным ВПЧ-негативным раком головы и шеи, проведенного в 20 американских центрах [3]. Выживаемость без прогрессирования (ВБП) явилась первичной конечной точкой, общая выживаемость (ОВ) – вторичной. Сто сорок два пациента с III-IV стадией были включены в исследование с 2012 по 2017 годы. Средний период наблюдения составил 4,1 года.
Рандомизация – 1:1 в группы ХЛТ (70 Гр за 6 недель + 2 введения цисплатина 1 раз в 3 недели) в комбинации с лапатинибом 1500 мг ежедневно на фоне всего лечения или плацебо. Результаты были оценены у 127 больных (63 в группе ХЛТ+Л и 64 – ХЛТ+П). В итоге не было отмечено улучшений ни в ВБП (HR 0,91; 95% CI 0,56-1,46; P=0,34), ни в ОВ (HR 1,06; 95% CI 0,61-1,86; P=0,58) при добавлении лапатиниба (рис.3). Клинически выраженная токсичность 3 и 4 степени встречалась у подавляющего большинства больных, хотя значимой разницы между группами не отмечено ни в отношении ранней (83,3% [95% CI 73,9-92,8%] при ХЛТ+Л против 79,7% [95% CI 69,4-89,9%] при ХЛТ+П; P=0,64), ни поздней токсичности (44,4% [95% CI 30,2-57,8%] ХЛТ+Л против 40,8% [95% CI 27,1-54,6%] ХЛТ+П; P=0,84).
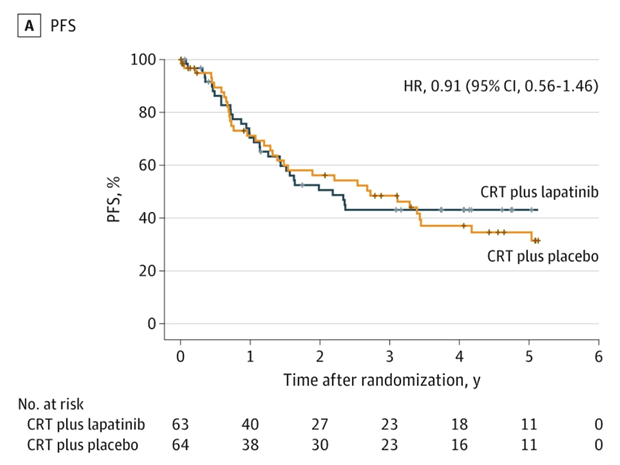
Рисунок 3. Выживаемость без прогрессирования как первичная конечная точка исследования.
В очередной раз продемонстрировано, что стандартная ХЛТ с цисплатином на данный момент является адекватным методом лечения.
Имеющиеся объективные данные по применению комбинации ТКИ и ЛТ (результаты проспективных рандомизированных исследований), также как и публикации отдельных (порой пугающих) клинических случаев и их совокупных анализов пока не позволяют нам широко использовать комбинацию ТКИ и лучевой терапии. Однако теоретические возможности ее применения и возможные преимущества при соблюдении ряда условий (дозы ЛТ, дозы препаратов, режимы и т.д.) стимулируют научное сообщество к продолжению подобных исследований. Поживем – увидим.
Источники: