21.09.2023

В период с 26 по 28 июля 2023 года в г. Лилль состоялась 16-я Международная конференция международной группы по изучению мезотелиом (International Mesothelioma Interest Group – iMig) совместно с Французской объединенной торакальной группой (French Cooperative Thoracic Intergroup – IFCT). Эта междисциплинарная конференция собрала делегатов со всего мира, чтобы представить современные представления по различным интересующим вопросам в отношении мезотелиом различных локализаций. Впервые Россия принимала участие в этой конференции.
Международная группа по изучению мезотелиомы (iMig) представляет собой сообщество врачей, фундаментальных исследователей, ученых, включая сестринские, пациентские фармацевтические, общественные и юридические сообщества. Это единственная общественная организация, посвященная исключительно изучению мезотелиомы, занимающаяся вопросами генетики, иммунных и молекулярных механизмов и эпидемиологических факторов, лежащих в основе развития мезотелиомы, с целью установления наилучших возможностей диагностики и лечения этого заболевания.
Основываясь на опыте и успехе предыдущих конференций с момента основания iMig в Париже в 1991 году (далее каждые 2 года конференция проходила в Бостоне, Кейптауне, Бирмингеме, Оттаве, не говоря уже об успешной виртуальной конференции iMig, проведенной в 2021 году австралийскими коллегами), 16-я конференция, благодаря семинарам, пленарным заседаниям, устным и стендовым докладам, предоставила множество возможностей для общения с ведущими учеными и исследователями, а также с пациентами и их ассоциациями, в первую очередь, для налаживания международного сотрудничества.
Мы представляем материалы по наиболее интересным и спорным вопросам в отношении злокачественной мезотелиомы.
Эпидемиология
К сожалению, истинная распространенность мезотелиомы неизвестна, поскольку есть страны, которые не репортируют о случаях выявления мезотелиомы. Заболеваемость очень сильно вариабельна от 0 до 10 случаев на миллион населения каждый год. Статистические данные по распространенности мезотелиомы хорошо представлены из Австралии, Великобритании, Нидерландов, Италии, Голландии и США. К сожалению, мало подобной информации из Индии, Африки и России. По-прежнему основной причиной развития мезотелиомы считается асбест, причем все его волокна, особенно амфиболовые варианты, а также вермикулит, цеолит, ставший причиной массовой семейной наследственной мезотелиомы в Турции, как и флюорит на Сицилии. Однако тип, размер и синергизм асбестовых волокон, а также длительность контакта с ними остаются предметом изучения. Не стихают противоречивые данные о вреде хризотил-асбеста и его роли в развитии мезотелиомы. Другими причинами возникновения мезотелиомы считаются радиация, хроническое воспаление, генетическая предрасположенность. Несмотря на все имеющиеся знания, в нашей практике появляется новый термин «идиопатическая» мезотелиома, причины возникновения которой неясны.
По мнению Vahan Kepenekian, (Франция) заболеваемость мезотелиомой в различных странах приняла масштабы эпидемии. Тенденция эпидемии остается неопределенной. Отсутствие данных по подавляющему большинству стран мира не позволяет достичь осознания рисков, связанных с воздействием асбеста. На рисунке 1 представлены стандартизованные по возрасту (мировые) показатели заболеваемости на 100 000 населения среди мужчин [1].
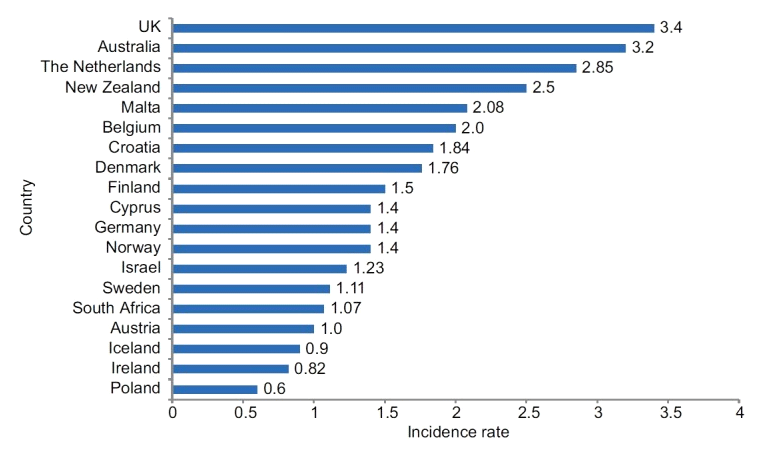
Рисунок 1. Мезотелиома в некоторых странах. Стандартизированные по возрасту (мировые) показатели заболеваемости на 100 000 населения, мужчины.
Молекулярно-генетические основы развития мезотелиом. Плевральная и перитонеальная мезотелиома – родственники, но не сестры
О том, что мезотелиома плевры и мезотелиома брюшины являются абсолютно самостоятельными нозологиями, становится все очевиднее. Геномный ландшафт мезотелиом в основном характеризуется потерей генов-супрессоров опухолей и мутациями в генах репарации ДНК. В настоящее время данные молекулярно-генетического анализа методом секвенирования нового поколения (NGS) мезотелиомы ограничены малым числом наблюдений. Согласно результатам обследования 198 пациентов, у 23 (12%) пациентов с мезотелиомой плевры, брюшины и вагинальной оболочки яичка выявлено 24 герминальные (зародышевые) мутаций в 13 генах (рис.2). Мутации BAP1 встречались чаще (n=6; 25%). Плевральная локализация, воздействие асбеста и пожилой возраст связаны с низкой вероятностью наличия зародышевой мутации [2].
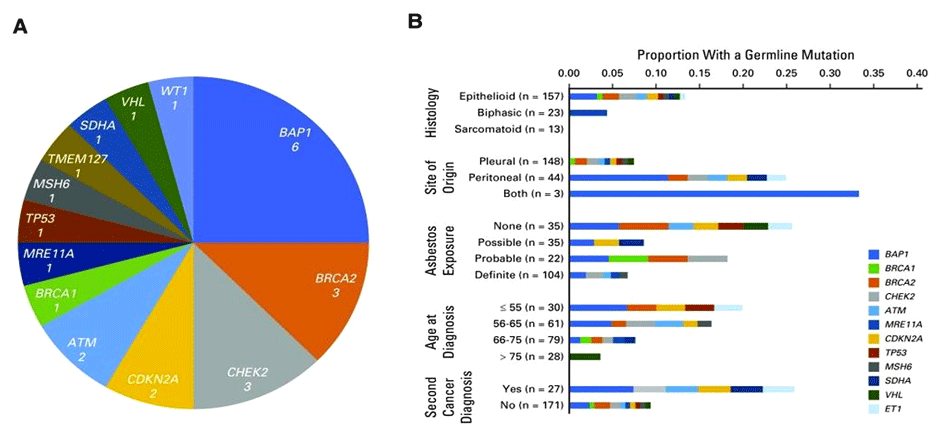
Рисунок 2.
А) Гены предрасположенности к развитию мезотелиомы.
В) Клиническая характеристика пациентов с герминальной мутацией.
Герминальные мутации встречаются в 25% случаев при перитоненальной мезотелиоме и лишь в 7% случаев при плевральной локализации (p<0,01).
Hiltbrunner S., ссылаясь на работы Raphael Bueno (2016 г.) и Hmeljak J. (2018 г.), лидеров по морфологической диагностике мезотелиом, представил данные о распространенности геномных нарушений при мезотелиоме плевры (n-1113) и мезотелиоме брюшины (n-355) [3]. Анализ выявил изменения в 19 генах с общей распространенностью не менее 2%. BAP1, CDKN2A, CDKN2B, NF2, MTAP, TP53 и SETD2 встречались с распространенностью не менее 10%. Изменения CDKN2A, CDKN2B и MTAP представляли собой преимущественно делеции числа копий. Мезотелиома брюшины, по сравнению с мезотелиомой плевры, характеризовалась меньшей распространенностью мутаций CDKN2A, CDKN2B и MTAP. Более того, авторы смогли определить четыре отдельные подгруппы в соответствии с наличием BAP1 и CDKN2A/B (рис.3). Группа 1 характеризуется изменениями BAP1, CDKN2A и CDKN2B. Для группы 2 характерны только CDKN2A и CDKN2B. Группа 3 характеризуется мутацией BAP1, а группа 4 не имеет генетических поломок вовсе.
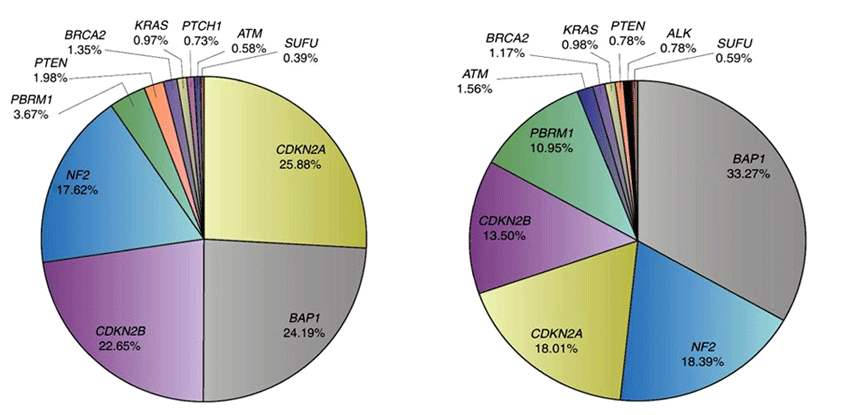
Рисунок 3. Геномные изменения в опухолях мезотелиомы плевры (слева) и при мезотелиоме брюшины (справа).
Подгруппы только с нарушением CDKN2A и подгруппы с изменением CDKN2A/BAP1 имеют наихудшую выживаемость. Интересно, что подгруппа без изменений CDKN2A или BAP1 имеет наиболее благоприятный прогноз (рис.4).
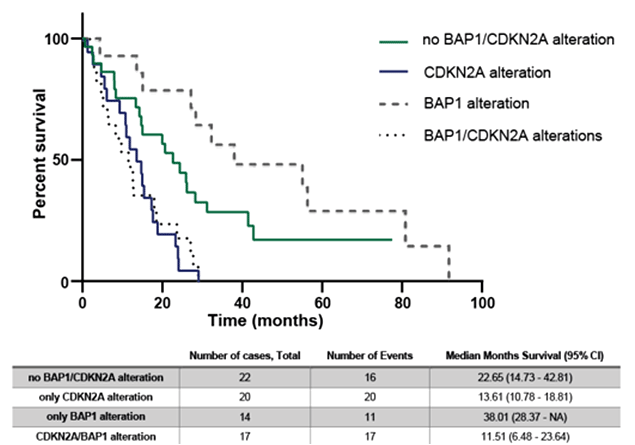
Рисунок 4. Общая выживаемость пациентов с различными вариантами генетических нарушений.
Мезотелиомы содержат меньше соматических мутаций по сравнению с другими опухолями, при этом менее 5% опухолей мезотелиомы имеют высокий показатель мутационной нагрузки (TMB) (определяемой как ≥10 мутаций/Mb): в среднем 1,7 мутации на Мб [4]. Авторы не обнаружили различий в TMB между плевральным и перитонеальным поражением. Так, встречаемость высокой TMB была у 15 (1,35%) пациентов с мезотелиомой плевры и у 5 (1,41%) пациентов с мезотелиомой брюшины.
Морфологическая классификация
В международной гистологической классификации ВОЗ 2021 года (5-е издание) появились новые термины и подходы к морфологической диагностике мезотелиом. В первую очередь, принципиальным отличием от классификации 2015 года стало понимание, что все мезотелиомы злокачественные. Плевральная мезотелиома и мезотелиома перикарда были объединены в одну главу, тогда как в классификации ВОЗ за 2015 г. мезотелиома перикарда была классифицирована как опухоли сердца. Во-вторых, абсолютным открытием стала неинвазивная мезотелиома in situ (MIS), характеризуемая как преинвазивные одиночно расположенные участки пролиферации неопластических мезотелиальных клеток с потерей BAP1 и/или CDKN2A/MTAP.
BAP1, CDKN2A, MTAP и р16 стали практически обязательными диагностическими маркерами. Однако потеря BAP1 по данным ИГХ не является эквивалентом герминальной мутации, а р16 не определяет степень злокачественности. MTAP методом ИГХ будет суррогатом потери CDKN2A.
Клиническая картина MIS включает в себя отсутствие опухолевых масс по плевре как по данным рентгенологических методов обследования, так и при торакоскопической визуализации. Рецидивирующий плеврит, семейный анамнез, длительный контакт с асбестом или воздействие радиации дают основание заподозрить эту формы мезотелиомы. В этом случае очевидной становится необходимость множественной биопсии плевры, перикарда, брюшины, исследование смывов с плевральных поверхностей и внесения диагностических изменений в существующие клинические рекомендации. Основные изменения в новой классификации представлены в таблице 1.
Таблица 1. Сравнительная характеристика международной гистологической классификации мезотелиом (WHO) 2015-2021 гг.
| 2015 | 2021 |
|---|---|
| Злокачественная мезотелиома | Мезотелиома |
| Мезотелиома in situ | |
| Хорошо дифференцированная папиллярная мезотелиома | Хорошо дифференцированная папиллярная мезотелиальная опухоль |
| Локализованная мезотелиома | Локализованная мезотелиома |
| Нет разделения на дифференцировку | Дифференцировка эпителиоидного типа, включая ядерную атипию, митозы, наличие или отсутствие некроза |
| Архитектура/гистотип только для научного интереса | Архитектура /гистотип обязательны |
| Не имеет значения минимальный % компонентов для бифазного типа | |
| Эпителиоидный, бифазный, саркоматоидный (включая десмоплатический) | Переходный тип относится к саркоматоидному |
Таким образом, выделение MIS диктует необходимость пересмотра TNM классификации и внесения изменений в диагностические и лечебные подходы, а хорошо дифференцированная папиллярная мезотелиальная опухоль (WDPMT) рассматривается как предрак (рис.5).
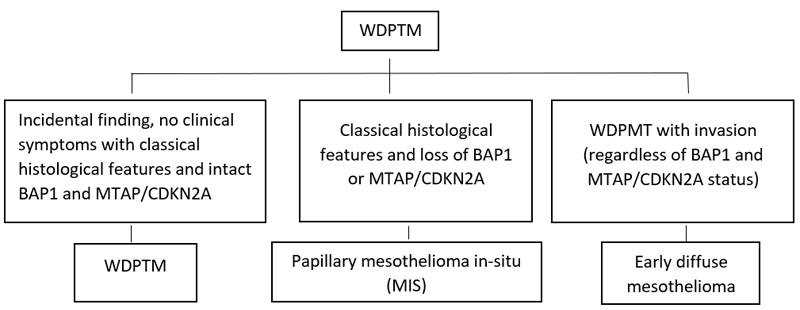
Рисунок 5. Алгоритм морфологической диагностики хорошо дифференцированной папиллярной мезотелиальной опухоли.
Для эпителиоидной диффузной мезотелиомы становится обязательным определение степени дифференцировки (high или low grade) и других цитологических и/или стромальных особенностей (рис.6).
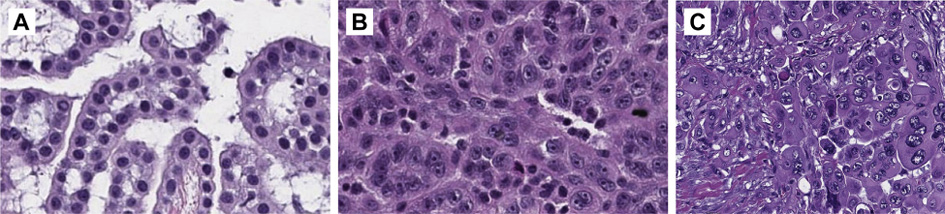
Рисунок 6. Примеры диффузной мезотелиомы плевры с ядерной атипией:
Таким образом, обобщив данные о молекулярном ландшафте мезотелиомы за последние 6 лет, была создана молекулярная классификация мезотелиомы (рис.7).
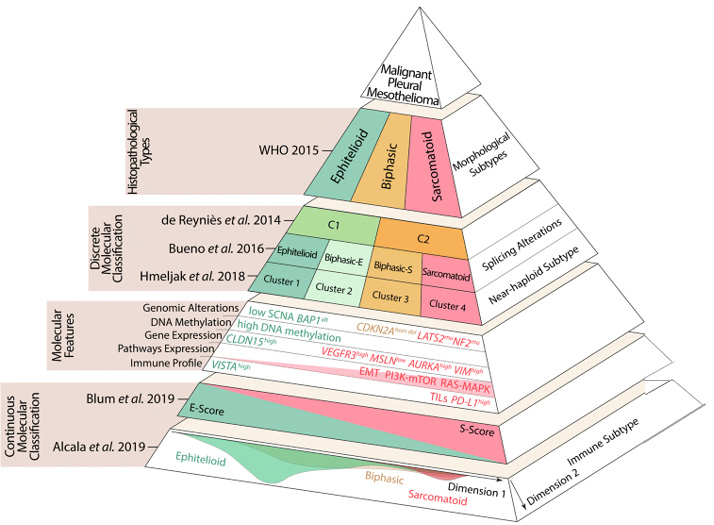
Рисунок 7. Дизайн молекулярной классификации мезотелиом в современном представлении.
Новая терминология в хирургии
Существующая в настоящий момент терминология в описании объемов хирургического лечения мезотелиомы плевры не позволяет сформировать единый стандартизованный хирургический подход. Японские коллеги настаивают на необходимости единых правил описания операционного протокола, что позволит объединять международный опыт, учитывая редкость заболевания и резектабельных форм особенно. Как известно, в настоящее время используется два вида операции: плевропульмонэктомия (ЕРР) и плеврэктомия (или декортикация легкого) (PD). Какая из вышеперечисленных хирургических процедур предпочтительнее, до сих пор не установлено, поскольку нет рандомизированных клинических исследований, сравнивающих обе процедуры, и решение о том, какую хирургическую процедуру выполнить, больше зависит от предпочтений и опыта хирурга. Нерандомизированные сравнения и объединенные данные из крупных регистров позволяют предположить, что PD может быть более осуществимой процедурой из-за более низкой периоперационной смертности и лучшего качества жизни, в том числе у пожилых пациентов, из-за его щадящей техники.
Действующая терминология не позволяет описать все проведенные хирургические манипуляции, а полнота редукции и эксплоративная торакотомия вовсе не учитываются.
Для более стандартизованного подхода для применения в ежедневной клинической практике предлагается более удобная и понятная хирургическая номенклатура, которая поможет хирургу описать все детали:
1) Название операции:
2) Радикальность операции:
Термин макроскопически полная резекция (MCR) должен включать удаление всех визуально и пальпаторно определяемых очагов опухоли. В зависимости от объема (%) остаточной резидуальной опухоли выделены 4 типа макроскопически определяемой полноты редукции:
3) Объем резекции:
Декортикация – PD, часть легкого – L:
При расширенной плеврэкомии к вышеуказанным аббревиатурам добавляется приставка «ext».
Таким образом, объем проведенной операции может быть указан как extPD-L2 CW-0 R2, что будет означать, что проведена расширенная плеврэктомия с резекцией диафрагмы, перикарда, сегментэктомией легкого, без резекции грудной клетки, с остаточной опухолью менее 10%.
Будут ли внесены изменения в действующую терминологию, пока неизвестно, но то, что существующая не удовлетворяет потребностей хирургов, занимающихся лечением мезотелиом, очевидно.
Неоадъювантная терапия и комплексный подход
Подходы к лечению мезотелиом различных локализаций различаются, однако при любом типе оптимальным является комплексный подход. Роль хирургического метода лечения за последние годы возросла в большей степени при мезотелиоме брюшины (рис.8), а использование системной химиотерапии увеличилось с 2003 года для мезотелиомы плевры (с 9,3% до 39,4% на основании анализа 12168 пациентов из Голландского ракового регистра) [6].
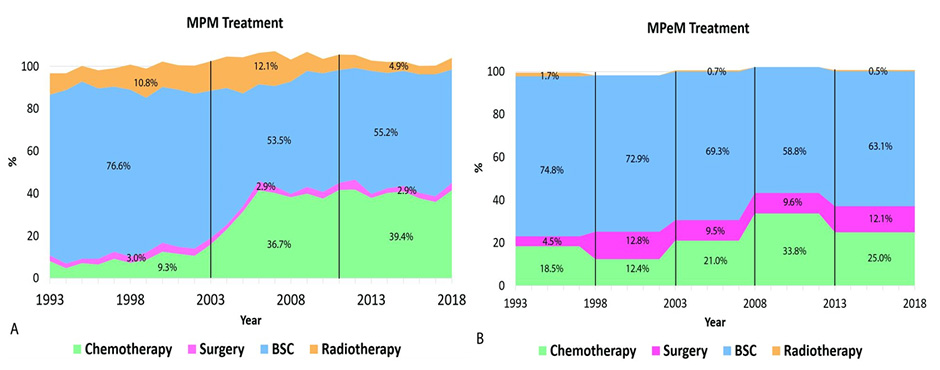
Рисунок 8. Роль различных методов лечения мезотелиомы с 1993 по 2018 год: А) мезотелиома плевры, В) мезотелиома брюшины. Суммированные области не составляют в сумме 100% из-за пациентов, получающих мультимодальное лечение, или пациентов, получающих другое лечение. MPM – злокачественная мезотелиома плевры. MPeM – злокачественная мезотелиома брюшины. BSC – лучшая поддерживающая терапия.
Несмотря на то, что число пациентов, получивших лечение, увеличивается с 2003 года, большинство пациентов по данным на 2018 год не получают никакой противоопухолевой терапии.
Надо отметить, что хирургический метод по-прежнему является основным в лечении мезотелиомы как плевры, так и брюшины. Выживаемость несколько улучшилась за последние годы, однако прогноз этого заболевания по-прежнему остается неблагоприятным (рис.9).
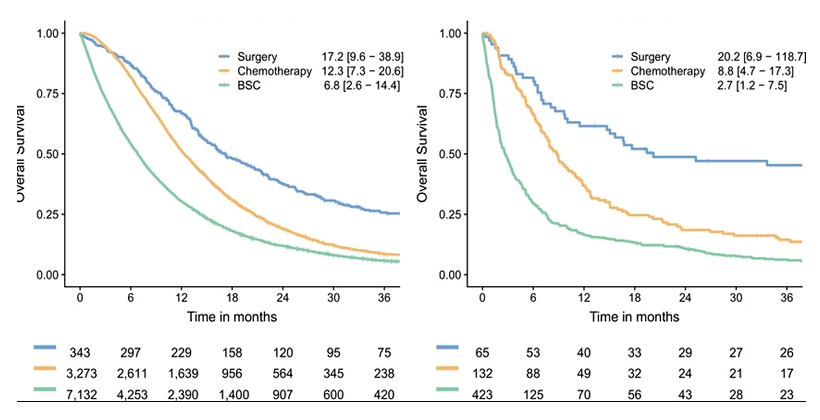
Рисунок 9. Кривые общей выживаемости пациентов (1993-2018 гг.) с мезотелиомой плевры (слева) и брюшины (справа) в зависимости от проводимого лечения.
Поскольку ни EPP, ни PD не гарантируют радикального удаления опухоли при мезотелиоме плевры, в настоящее время весьма актуальным является комплексный подход с включением неоадъювантной или адъювантной химиотерапии, послеоперационной лучевой терапии (PORT) или других вмешательств, таких как фотодинамическая терапия (ФДТ) или гипертермическая интраоперационная внутриплевральная химиотерапия (HITOX), или их комбинации.
Мультимодальный подход в лечении мезотелиомы плевры является наиболее эффективным, при котором мОВ достигла 17-25 мес., но последовательность хирургического, лучевого и лекарственных методов все еще обсуждается. В ретроспективном анализе Sharkey et al. разницы в ОВ между адъювантной и неоадъювантной химиотерапией не получено [7], а по данным Cao et al. мОВ составила 23,1 мес. в группе адъювантной химиотерапии по сравнению с 27,8 мес. в группе неоадъювантной химиотерапии [8]. Следует также понимать, что сроки и схемы адъювантной химиотерапии различаются между исследованиями, и несмотря на то, что неоадъювантный этап удается провести большинству пациентов, хирургическое лечение с последующей лучевой терапией получают не более 52-65% пациентов по данным различных авторов.
Окончательным, по-видимому, ответом в этом вопросе станут результаты рандомизированного исследования II фазы EORTC1205, предварительно показавшие отсутствие различий между группами с индукционной химиотерапией и хирургией up-front. В исследование включались пациенты с cT1-3N0-2M0 (7-я классификация), ранее не получавшие противоопухолевого лечения (химический плевродез тальком допускался).
Группа А получала хирургическое лечение и адъювантную ХТ (3-6 циклов пеметрексед/цис- или карбоплатин). Группа В начинала лечение с неоХТ с последующей операцией не позднее 4 недель после завершения лекарственной терапии. Запланированный объем операции – PD или extPD.
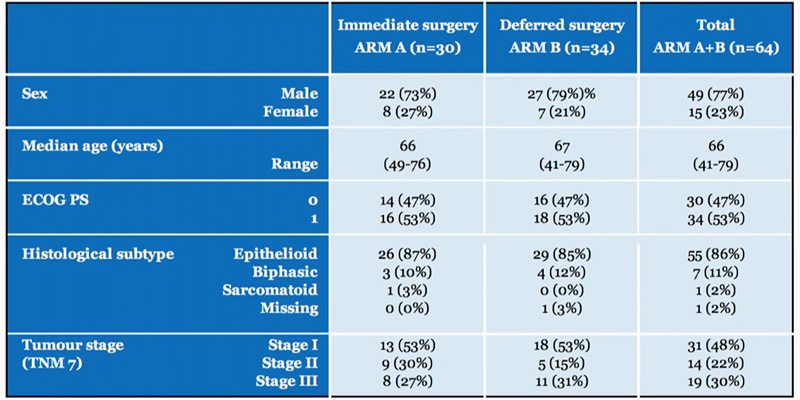
Включено 64 пациента, по 32 в каждую группу. Характеристика пациентов представлена в таблице 2.
Таблица 2. Характеристика пациентов, включенных в исследование EORTC1205.
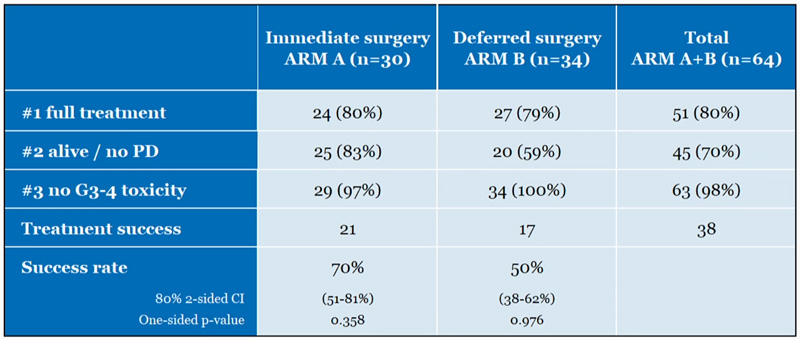
Официальные результаты исследования еще не опубликованы. Предварительные данные представлены в таблице 3, согласно которым авторы видят некоторое преимущество в адъювантном лечении в показателях выживаемости без прогрессирования.
Таблица 3. Предварительные результаты эффективности и токсичности неоадъювантной и адъювантной химиотерапии в исследовании EORTC1205.
В ходе дискуссии на конференции iMig2023 ведущими экспертами было подтверждено, что определяющую роль в выборе последовательности операции и химиотерапии играет опыт хирурга. Поскольку неоадъювантная химиотерапия не приводит к увеличению резектабельности и уменьшению объема операции, а отдаленные результаты доказательно не улучшены, то хирургическое лечение при условии абсолютной резектабельности опухоли должно быть в приоритете, и именно с этого лечения нужно начитать, добавляя системную ХТ в адъювантном режиме.
Иммунотерапия
Иммунотерапия все больше проникает в сферу лечения злокачественных новообразований. Представлены результаты небольшого мультицентрового исследования I фазы S1619 по изучению неоадъювантной терапии атезолизумабом в сочетании с пеметрекседом и цисплатином с поддерживающей адъювантной терапией атезолизумабом при резектабельной I-III ст. мезотелиоме плевры. В исследование включены 28 пациентов. Неоадъювантная терапия включала четыре цикла цисплатина (75 мг/м2), пеметрекседа (500 мг/м2) и атезолизумаба (1200 мг в/в) каждые 3 недели. При отсутствии прогрессирования болезни был проведен хирургический этап. Далее проводилась адъювантная иммунотерапия атезолизумабом 1200 мг внутривенно каждые 3 недели в течение 1 года. Объем операции выбирался на усмотрение хирурга: ЕРР или PD. Пациенты, перенесшие пневмонэктомию, также получили послеоперационную лучевую терапию.
В итоге 25 пациентов получили как минимум 2 курса неоадъювантной терапии, и 21 пациент получил весь запланированный объем неоадъювантного лечения, однако только 18 из них были прооперированы (1 – EPP, 17 – PD), а 15 получили поддерживающую терапию атезолизумабом. К сожалению, 7 пациентов не завершили первый этап лечения: несмотря на раннюю стадию болезни, у 4 пациентов при нео-терапии отмечено прогрессирование, у 2 пациентов развилась непереносимая токсичность, 1 пациент скончался из-за сепсиса, не связанного с проводимым лечением. Через 20 месяцев наблюдения медиана общей выживаемости не была достигнута, а медиана выживаемости без прогрессирования составила 18,6 мес. (рис.10).
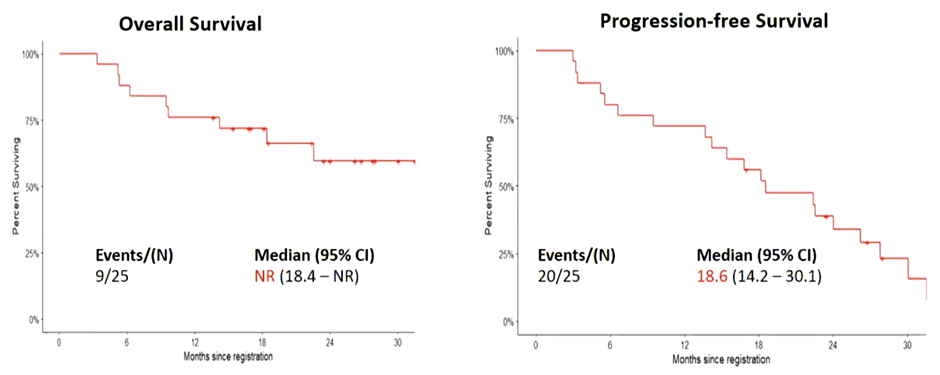
Рисунок 10. Кривые общей и безрецидивной выживаемости при неоадъювантной химиоиммунотерапии в исследовании S1619.
Предвзятость отбора была проблемой для этого исследования. Пока не будет проведен окончательный анализ, авторы хотели бы воздержаться от рассуждений о пользе добавления атезолизумаба в схему неоадъювантного лечения.
Иммунотерапия неоперабельной мезотелиомы плевры
Иммунотерапия активно включается в схемы лечения мезотелиомы плевры. Мы уже знаем о прорывных результатах исследования CheckMate-743, где комбинация двух иммунных препаратов ниволумаба и ипилимумаба позволила улучшить общую выживаемость при всех гистологических подтипах по сравнению со стандартной химиотерапией пеметрекседом с цисплатином (18,1 против 14,1 мес. соответственно). Более того, число пациентов, удерживающих ответ через 4 года, составило 16% при иммунотерапии в сравнении с 0% при ХТ.
Безусловным фаворитом на конференции стали результаты исследования Канадской группы по изучению рака (CCTG) IND.227 при использовании комбинации химиотерапии с пембролизумабом в 1 линии лечения (рис.11).
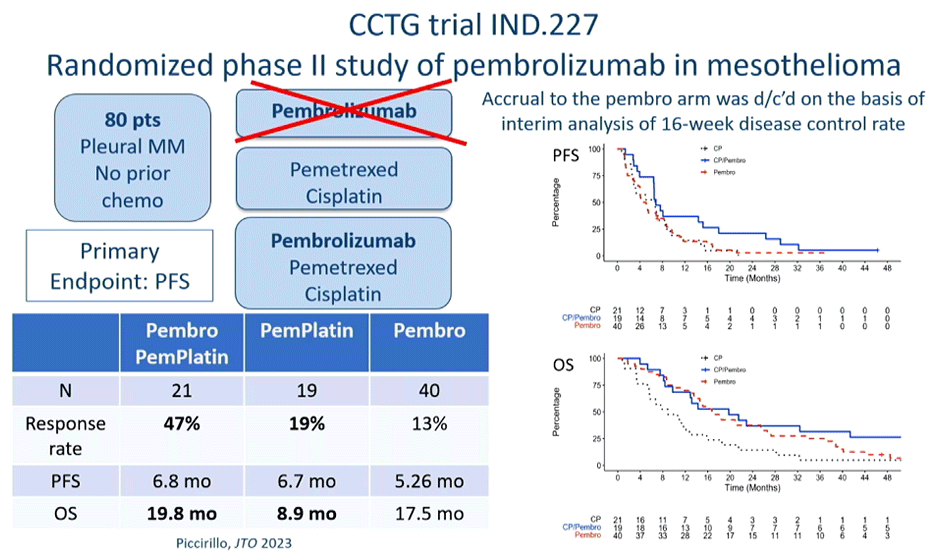
Рисунок 11. Дизайн исследования IND.227.
В исследование рандомизировано 440 пациентов с МП; 218 пациентов в группу химиотерапии пеметрексед/цисплатин и 222 пациента в группу с ХТ теми же препаратами и пембролизумабом. Медиана общей выживаемости составила 17,3 мес. против 16,1 мес. для группы ХТ-пембро против группы с ХТ (HR 0,79; 95% CI 0,64-0,98; p=0,0324), мВБП составила 7,13 мес. против 7,16 мес. соответственно (HR 0,80; 95% CI 0,65-0,99, р=0,0372). Частота объективного ответа была значительно выше для ХТ-пембро (63% против 40%, p<0,0001). Нежелательные явления (НЯ) 3-й степени или выше, связанные с пембролизумабом, наблюдались у 19% пациентов (наиболее часто отмечались утомляемость (5%) и диарея; пульмониты (2%); 16% пациентов прекратили лечение полностью из-за развития иммуноопосредованных НЯ). Авторы однозначно сделали выводы, что со статистически значимым улучшением мОВ и приемлемой переносимостью комбинация пеметрекседа, цисплатина и пембролизумаба является вариантом лечения нерезектабельной МП в 1 линии лечения.
Не менее интересными были результаты исследования PEMMELA, одноцентровое рандомизированное исследование без группы сравнения по изучению эффективности пембролизумаба с ленватинибом во второй и третьей линии у пациентов со злокачественной мезотелиомой плевры. Ленватиниб – это ингибитор рецепторов тирозинкиназ, избирательно подавляющий киназную активность рецепторов фактора роста эндотелия сосудов (VEGF) – VEGFR1 (FLT1), VEGFR2 (KDR) и VEGFR3 (FLT4). Также ленватиниб воздействует на другие рецепторы тирозинкиназ, задействованных в проангиогенных и онкогенных механизмах, включая рецепторы фактора роста фибробластов 1-го, 2-го, 3-го и 4-го типов (FGFR1, 2, 3 и 4), альфа-рецептор тромбоцитарного фактора роста (PDGFRa), а также рецепторы тирозинкиназ KIT и RET. Именно синергизм ингибиторов иммунных контрольных точек с антиангиогенными препаратами послужил началом данного исследования. Дизайн исследования представлен на рисунке 12.
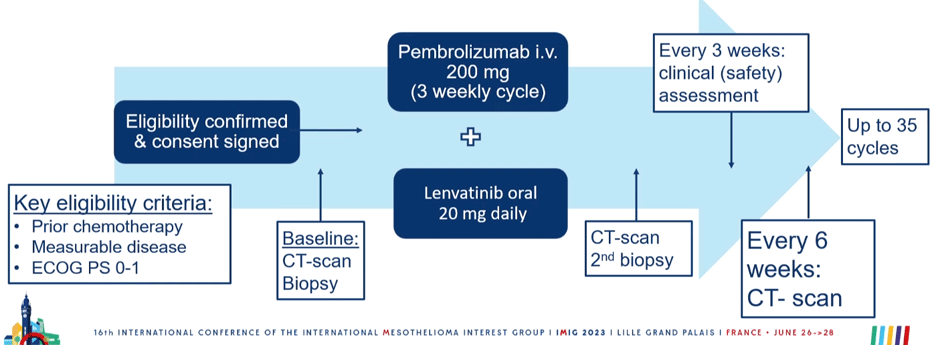
Рисунок 12. Дизайн исследования PEMMELA.
В исследование включено 38 пациентов. Из 38 пациентов 33 (86,8%) были мужчинами, 19 (50%) имели статус ECOG 0 и средний возраст составил 70,5 лет (диапазон 36-83). У большинства пациентов (89,5%) была выявлена эпителиоидная МП, у 5,3% — неэпителиоидная мезотелиома, а у остальных 5,3% — смешанная форма. У 18 пациентов (47,4%) выявлена экспрессия PD-L1, 17 (44,7%) были PD-L1-отрицательными и 3 (7,9%) имели неопределенный статус. Несмотря на то, что полных регрессий не было отмечено, что вполне ожидаемо, учитывая 2 и 3 линию лечения, объективный эффект удалось подтвердить в 40% случаев (39,5%; 95% CI 24-57%; р=0,07). Результаты представлены на рисунке 13.
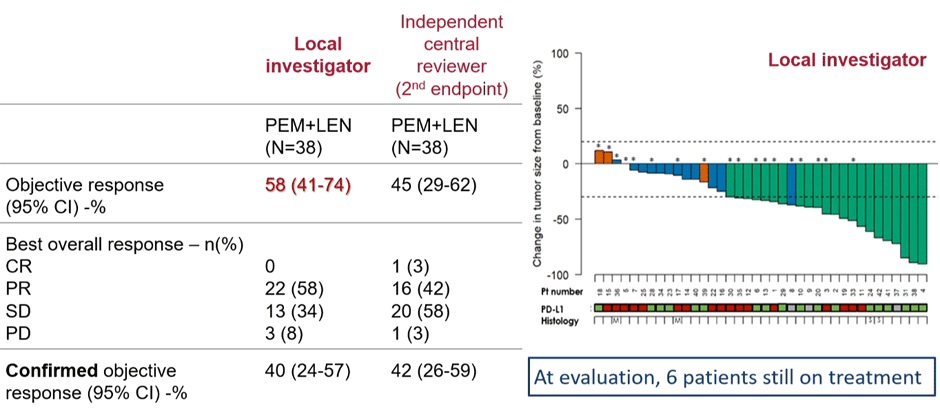
Рисунок 13. Эффективность применения комбинации пембролизумаба и ленватиниба во 2 и 3 линиях лечения в исследовании PEMMELA.
Токсичность изучаемого режима оказалась относительно приемлемой (рис.14). Основными жалобами стали слабость и дисфония 1-2 ст., диарея 1-2 степени, а тяжелые нежелательные явления 3-4 степени в виде повышения артериального давления и анорексии отмечены у 8 (21%) и 4 (10,5%) пациентов соответственно.
Снижение дозы или окончательное прекращение лечения ленватинибом потребовались у 76% пациентов из-за токсичности, что вполне закономерно, учитывая начальную дозу 20 мг/сут. Пембролизумаб полностью отменен в 3 (8%) случаях из 38 из-за НЯ. Кроме того, было 2 пациента с миозитом 3-4 степени и 10 пациентов с 16 серьезными нежелательными явлениями, связанными с лечением.
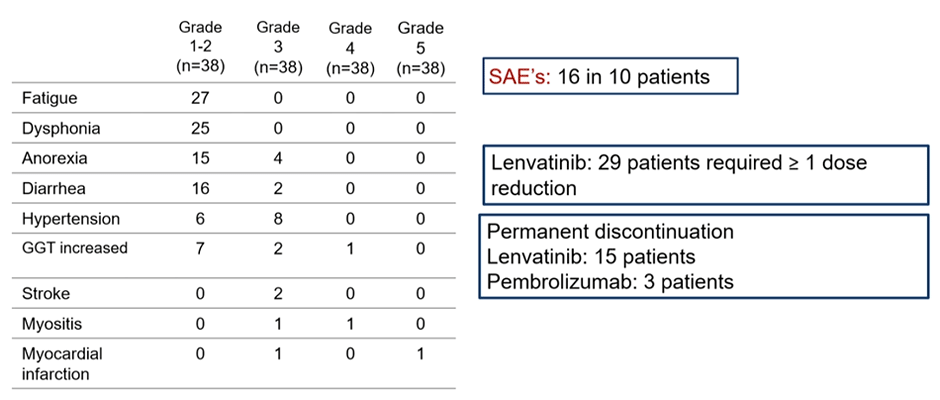
Рисунок 14. Характеристика нежелательных явлений при применении комбинации пембролизумаба и ленватиниба во 2 и 3 линиях лечения в исследовании PEMMELA.
Медиана ВБП составила 5,6 мес., а медиана ОВ – 12,8 мес., что наглядно представлено на рисунке 15.
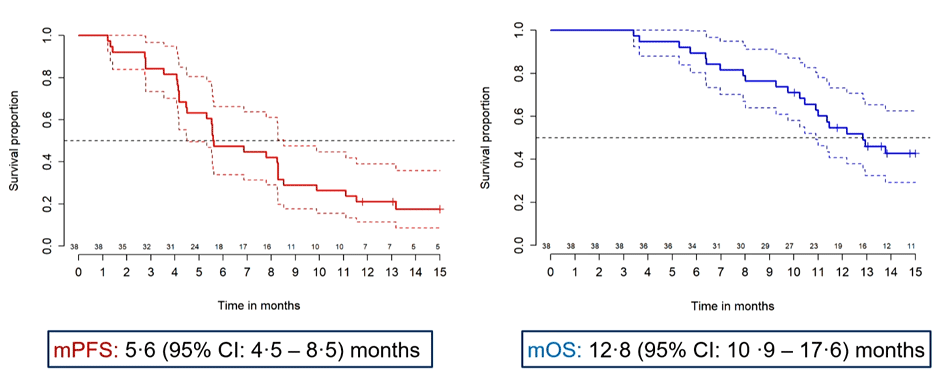
Рисунок 15. Кривые общей выживаемости и выживаемости без прогрессирования в исследовании PEMMELA.
Таким образом, дальнейшие исследования иммуно- и таргетных препаратов представляются перспективными.
Необходимость продолжения исследований по лекарственному лечению мезотелиом очевидна. Повышенный интерес к злокачественной мезотелиоме, несмотря на редкость данной патологии, в виде тематической международной конференции дает надежду на новые научные изыскания, которые, возможно, улучшат перспективы лечения этих больных.
В статье использованы материалы: