01.08.2023

На ASCO 2023 было представлено достаточно большое количество исследований по эффективности противоопухолевой терапии как ранних, так и распространенных стадий меланомы.
Адъювантная терапия меланомы кожи
Jason J. Luke представил финальные результаты выживаемости без отдаленных метастазов при применении пембролизумаба в адъювантном лечении у пациентов IIB/C стадии меланомы кожи в исследовании KEYNOTE-716. В исследовании сравнивались две группы: первая – с использованием пембролизумаба (487 пациентов) и вторая группа - плацебо (489 пациентов). Промежуточные анализы KEYNOTE-716 показали, что адъювантная терапия пембролизумабом улучшает выживаемость без отдаленных метастазов и рецидивов заболевания [1]. При медиане наблюдения 39,4 месяца 320 пациентов в группе пембролизумаба завершили курс лечения, а 163 – прекратили лечение, в группе плацебо 367 пациентов завершили лечение, а 119 досрочно его прекратили. 36-месячная выживаемость без отдаленных метастазов была значительно выше в группе пембролизумаба по сравнению с группой плацебо, составив 84,4% против 74,7% соответственно, а коэффициент риска (ОР) составил 0,59 (рис.1). Применение пембролизумаба ассоциировалось с преимуществами выживаемости без отдаленных метастазов у пациентов со стадиями IIB и IIC (ОР 0,62 и 0,57 соответственно), хотя различия между группами были незначительными; лечение оказалось эффективным во всех обследованных подгруппах. Обновленные анализы безрецидивной выживаемости (БРВ) были аналогичными: показатели БРВ за 39,4 месяца составили 76,2% для группы пембролизумаба и 63,4% для группы плацебо (ОР 0,62) (рис.2). Преимущество пембролизумаба отмечено во всех обследованных подгруппах. Никаких новых сигналов безопасности зарегистрировано не было. Финальный анализ показателей выживаемости без отдаленных метастазов подтверждает, что пембролизумаб является стандартной адъювантной терапией для пациентов с IIB/C стадией меланомы. Анализ биомаркеров исследования KEYNOTE-716 находится на рассмотрении и будет представлен позднее.
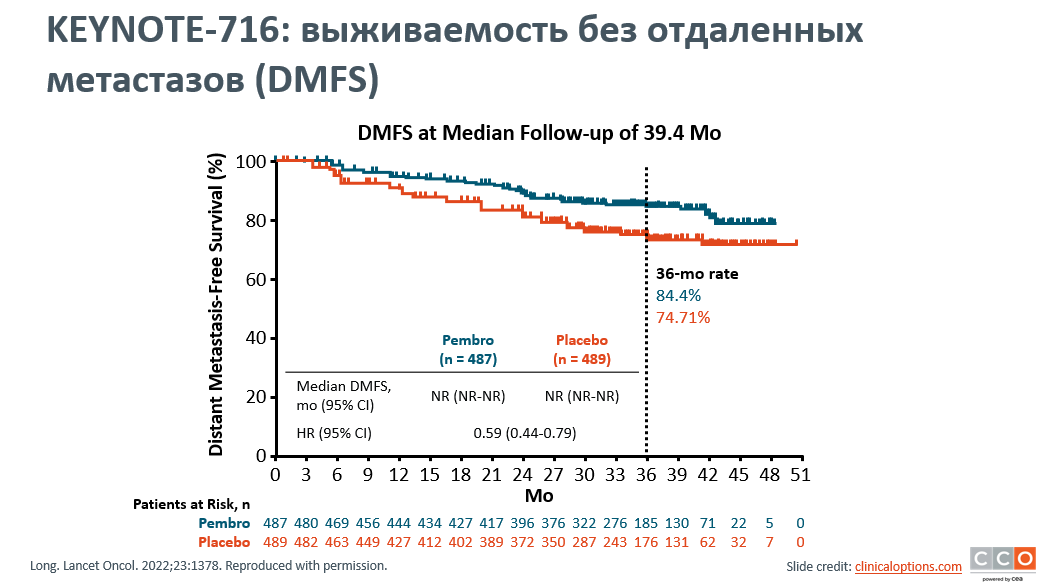
Рисунок 1. KEYNOTE-716: выживаемость без отдаленных метастазов (DMFS).
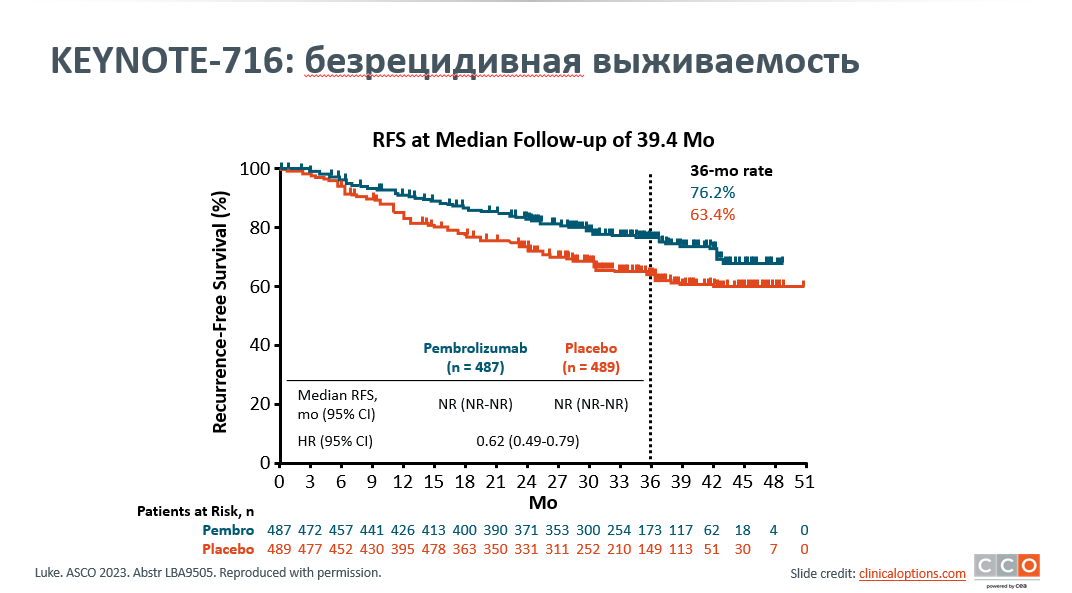
Рисунок 2. KEYNOTE-716: безрецидивная выживаемость (RFS).
На ASCO 2023 заявлено о новом исследовании с применением таргетной терапии энкорафениб + биниметиниб в адъювантном режиме у пациентов с IIB/C стадией и наличием мутации BRAF V600 [2]. Энкорафениб в комбинации с биниметинибом является хорошо переносимым и эффективным вариантом лечения, обеспечивающим высокие показатели безрецидивной и общей выживаемости при неоперабельной или метастатической меланоме. Акцент перенесен на раннюю стадию заболевания с целью предотвращения рецидива. Известно, что 18% пациентов со стадией IIB и 25% пациентов со стадией IIC умирают из-за меланомы в течение 10 лет после постановки диагноза [3]. Для таких пациентов в настоящее время одобрена только иммунотерапия. Существует потребность в большем количестве вариантов лечения заболевания II стадии с мутацией BRAF. Авторами сообщается об исследовании COLUMBUS-AD (NCT05270044), которое представляет собой международное рандомизированное, плацебо-контролируемое, тройное слепое многоцентровое исследование III фазы, в котором будет оценена эффективность комбинации энкорафениб + биниметиниб в сравнении с плацебо у пациентов с резецированной меланомой IIB/C стадии и наличием мутации в гене BRAF V600. Будет зарегистрировано примерно 815 пациентов. Более 170 центров из 26 стран мира примут участие в исследовании, проводимом в сотрудничестве с Европейской организацией по исследованию и лечению рака (EORTC). Пациенты будут получать энкорафениб + биниметиниб или плацебо в течение 12 месяцев или до рецидива заболевания. Основной целью исследования является оценка эффективности комбинации энкорафениб+ биниметиниб для увеличения БРВ. Второстепенными целями являются сравнение выживаемости без отдаленных метастазов (DMFS), общей выживаемости (OВ), качества жизни, связанного со здоровьем (QoL), а также безопасности и переносимости между двумя группами, а также предоставление дополнительных фармакокинетических данных. COLUMBUS-AD является первым рандомизированным исследованием III фазы для оценки адъювантной таргетной терапии BRAF/MEK ингибиторами при меланоме IIB/C стадии.
Перспективным направлением являются исследования с применением комбинированной иммунотерапии, включая персонализированную противоопухолевую вакцину на основе мРНК. Adnan Khattak на ASCO 2023 г. представил первый анализ выживаемости без отдаленных метастазов (DMFS) в открытом рандомизированном исследовании II фазы mRNA-4157-P201/KEYNOTE-942, в котором сравнивались комбинация мРНК-4157/V940 + пембролизумаб (n=107) и монотерапия пембролизумабом (n=50) по поводу резецированной меланомы высокого риска IIIB/C/D и IV стадии [4]. V940 - это новая персонализированная противоопухолевая вакцина на основе мРНК, которая кодирует до 34 опухолевых неоантигенов, специфичных для пациента. Предыдущие отчеты показывают, что комбинированная терапия V940 + пембролизумаб связана со значительным увеличением БРВ по сравнению с монотерапией пембролизумабом (18-месячная БРВ 78,6% против 62,2%, ОР 0,56). Комбинированная терапия была связана со значительным улучшением показателей DMFS по сравнению с монотерапией, при этом показатели DMFS за 18 месяцев составили 91,8% против 76,8% соответственно (ОР 0,347, р=0,0063) (рис.3). Несмотря на небольшое количество событий в каждой группе (9/107 в группе комбинированной терапии, 12/50 в группе монотерапии), можно предположить, что добавление V940 к адъювантной иммунотерапии задерживает отдаленные рецидивы. Предварительный анализ циркулирующей опухолевой ДНК (ctDNA) позволяет предположить, что отрицательный статус ctDNA связан с преимуществами DMFS для обеих групп лечения, но в большей степени для комбинированной группы. мРНК-4157-P201/KEYNOTE-942 является первым рандомизированным исследованием, демонстрирующим взаимосвязь между применением индивидуализированной неоантигенной вакцины со значительным улучшением показателей БРВ и DMFS. Комбинация неоантигенной вакцины и пембролизумаба показала более высокую показатели выживаемости по сравнению со стандартным лечением только пембролизумабом. Исследование III фазы для подтверждения этих результатов у пациентов с резецированной меланомой высокого риска начнется в ближайшем будущем, и планируются исследования, включающие дополнительные типы опухолей.
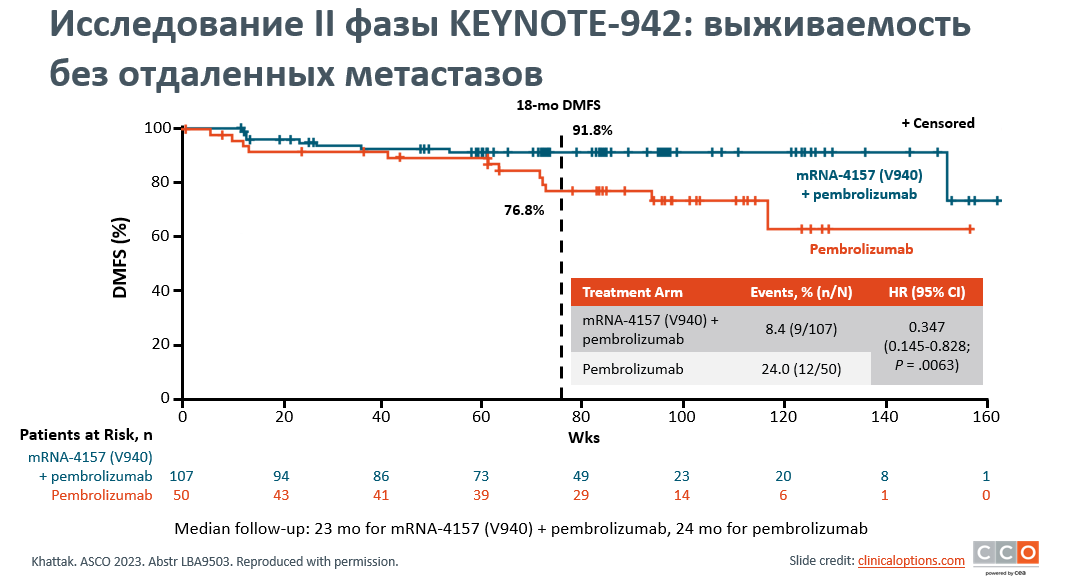
Рисунок 3. Исследование II фазы KEYNOTE-942. Кривые выживаемости без отдаленных метастазов.
Неоадъювантная терапия меланомы кожи
Irene L.M. Reijers представлен анализ трехлетних результатов исследований PRADO и OpACIN-neo для определения преимуществ, связанных с хирургическим вмешательством и неоадъювантной терапией у пациентов с меланомой III стадии. Исследование OpACIN-neo (n=86) отличалось универсальным подходом, в рамках которого пациенты получали неоадъювантно ниволумаб + ипилимумаб (nivo + ipi) с последующей лимфодиссекцией (TLND) без адъювантной системной терапии, хотя некоторые пациенты получали адъювантную лучевую терапию. Исследование PRADO (n=99) отличалось персонализированным подходом, при котором лечение пациентов проводилось по-разному в зависимости от патоморфологического ответа. Пациенты, у которых был достигнут значительный патологический ответ (MPR; жизнеспособная опухоль <=10%) после неоадъювантной nivo + ipi, не проходили TLND и адъювантную терапию, в то время как пациенты, у которых был достигнут частичный патологический ответ (pPR) или отсутствие ответа (pNR), подвергались TLND и адъювантной системной терапии, причем некоторые пациенты получали адъювантную лучевую терапию. Исходные характеристики и частота патоморфологических реакций были сопоставимы для обеих когорт. Хирургическое вмешательство не повлияло на результаты выживаемости среди пациентов с MPR, перенесших TLND (исследование OpACIN-neo; n=53), по сравнению с теми, кто не получал TLND (исследование PRADO, n=59), при этом показатели БРВ составили 96% и 93% соответственно, и показатели выживаемости без отдаленных метастазов (DMFS) составили 98% в обеих группах (рис.4). Ни один из пациентов в этих группах не получал адъювантную терапию, что позволяет предположить, что адъювантная терапия может быть излишней для пациентов, достигших MPR. Проведение адъювантной терапии ассоциировалось с улучшением выживаемости среди пациентов с pNR: 36-месячная БРВ составила 64% у пациентов, которые получали адъювантную системную терапию (n=17) по сравнению с 36% у пациентов, которые не получали адъювантную системную терапию (n=17), и 36-месячная DMFS составила 70% по сравнению с 52% соответственно (рис.5).
Предварительные данные, полученные в небольших группах пациентов, получавших адъювантную терапию ниволумабом (n=7), по сравнению с пациентами, получавшими адъювантную таргетную терапию дабрафенибом/траметинибом (n=10), позволяют предположить, что иммунотерапия может быть связана с лучшими показателями выживаемости пациентов с pNR. Адъювантная лучевая терапия также была связана с улучшением выживаемости среди пациентов с pNR, которые не получали адъювантную терапию, хотя размеры выборки для этих групп были очень малы. Полученные данные указывают на то, что пациентам с выраженным патологическим ответом на неоадъювантную блокаду иммунных контрольных точек может не потребоваться применение TLND и адъювантной системной терапии для достижения положительных результатов выживаемости. Для пациентов, которые не ответили на неоадъювантную иммунотерапию ингибиторами контрольных точек иммунного ответа, адъювантная системная терапия улучшит показатели выживаемости, и адъювантная блокада контрольных точек иммунного ответа может обеспечить больше преимуществ по сравнению с таргетной терапией. Этот анализ подтверждает практику персонализации адъювантной терапии, основанной на патоморфологическом ответе опухоли пациента на неоадъювантную иммунотерапию, ограничивая терапию тем, что необходимо для долгосрочного контроля заболевания.
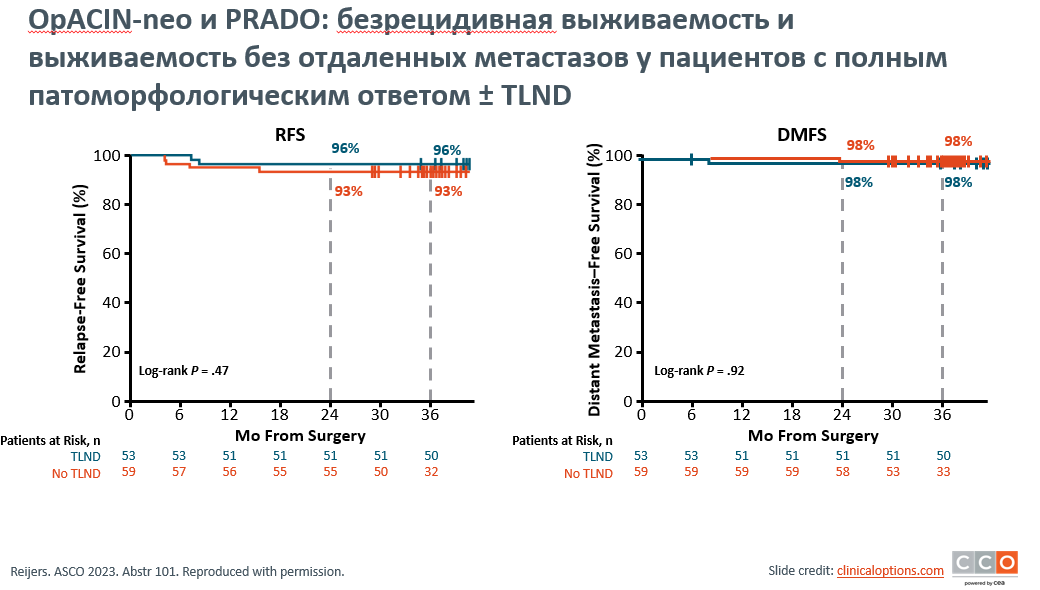
Рисунок 4. OpACIN-neo и PRADO: кривые безрецидивной выживаемости и выживаемость без отдаленных метастазов у пациентов с полным патоморфологическим ответом ± TLND.
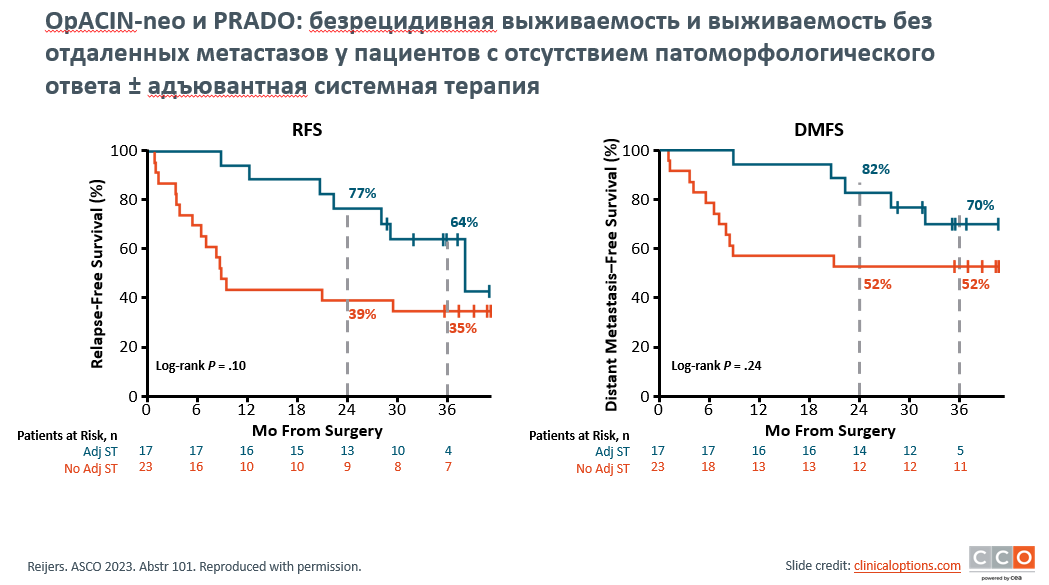
Рисунок 5. OpACIN-neo и PRADO: кривые безрецидивной выживаемости и выживаемость без отдаленных метастазов у пациентов с отсутствием патоморфологического ответа ± адъювантная системная терапия.
Таким образом, достижение полного или почти полного патоморфологического ответа после проведенной неоадъювантной терапии у пациентов с меланомой III стадии приводит к высоким результатам БРВ и DMFS. Дополнительная операция с полной диссекцией лимфатических узлов у этих пациентов практически не повлияла на результаты БРВ или DMFS.
Пациенты без 90% регресса опухоли или отсутствием полного патологического регресса получат пользу от последующей адъювантной системной терапии. Добавление лучевой терапии не принесло явной пользы к системной адъювантной терапии у пациентов без 90% регресса или полного патологического ответа.
Исследования неоадъювантной терапии меланомы продолжаются. Особенный интерес вызывают возможности предоперационного системного лечения пациентов с меланомой слизистых. Результаты исследования NeoPlus II фазы неоадъювантной комбинированной терапии ленватиниб + пембролизумаб при резектабельной меланоме слизистых представлены китайскими учеными.
По состоянию на декабрь 2022 года было зарегистрировано 19 пациентов (из них 14 женщин) с медианой наблюдения 49 недель (95% ДИ, 38--60). Средний возраст пациентов составил 57 лет. Первичные локализации опухоли включали: 8 – женские половые органы, 6 – аноректальная область, 4 – органы головы и шеи, 1 – пищевод. У 12 (63%) пациентов был локальный процесс, у 7 (37%) – с наличием вовлеченных регионарных лимфатических узлов. Мутации KIT или NRAS были представлены у 5 пациентов. Больные получали ленватиниб по 20 мг в сутки и пембролизумаб по 200 мг каждые 3 недели в течение 2 циклов с последующим оперативным вмешательством. Терапия пембролизумабом после операции продолжалась до 15 циклов. Первичная конечная точка исследования – полный патоморфологический ответ (pCR).
Операция проведена 15 пациентам. У 2 больных достигнут полный патоморфологический ответ (13,3 %), у 1 пациента – почти полный ответ (MPR), у 3 пациентов (40%) – частичный патоморфологический ответ (pPR); (6/15,95%ДИ 16-67%) (рис. 6,7). Отказались от операции 4 пациента. Медиана БРВ не достигнута. Данные ИГХ исследования опухоли показали более высокую плотность CD8+ Т-клеток у ответивших на лечение больных (р=0,04). Наиболее распространенными нежелательными явлениями были протеинурия (6,32%), гипотиреоз (6,32%), дисфония (5,26%), у одного пациента (5%) было повышение АЛТ 3 степени. Токсичности 4-5 степени не наблюдалось.
Авторами сделаны следующие выводы: комбинация пембролизумаба и ленватиниба в качестве неоадъювантной терапии при меланоме слизистых является безопасным методом лечения. Предварительные данные показали многообещающий патоморфологический ответ с повышением инфильтрации CD8+ Т-клетками.
Необходимо дальнейшее изучение неоадъювантного лечения при меланоме слизистых.
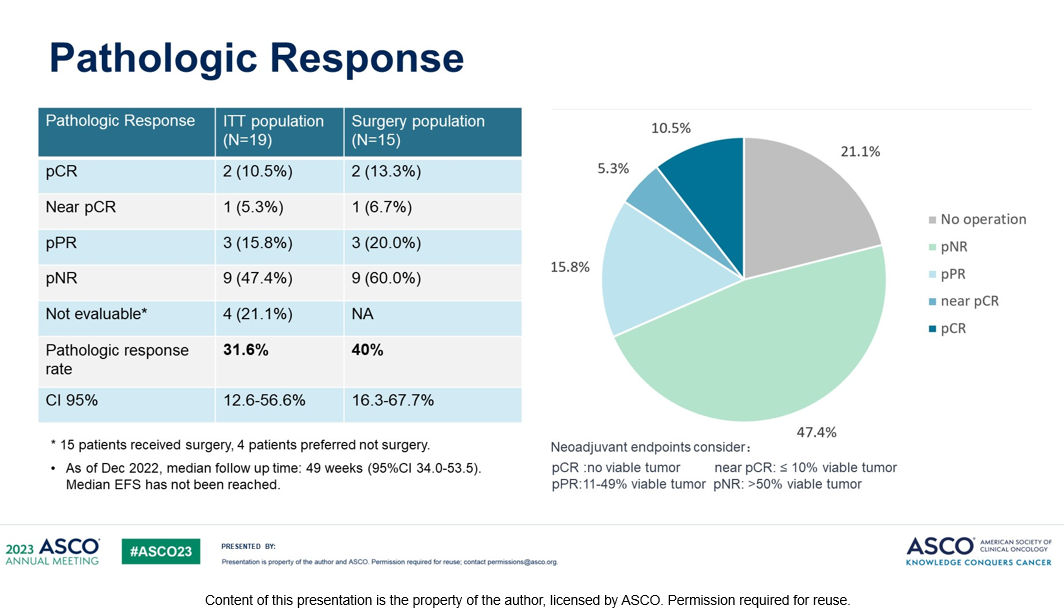
Рисунок 6. Исследование NeoPlus: неоадъювантная ленватиниб + пембролизумаб при резектабельной меланоме слизистых. Частота патоморфологического ответа.
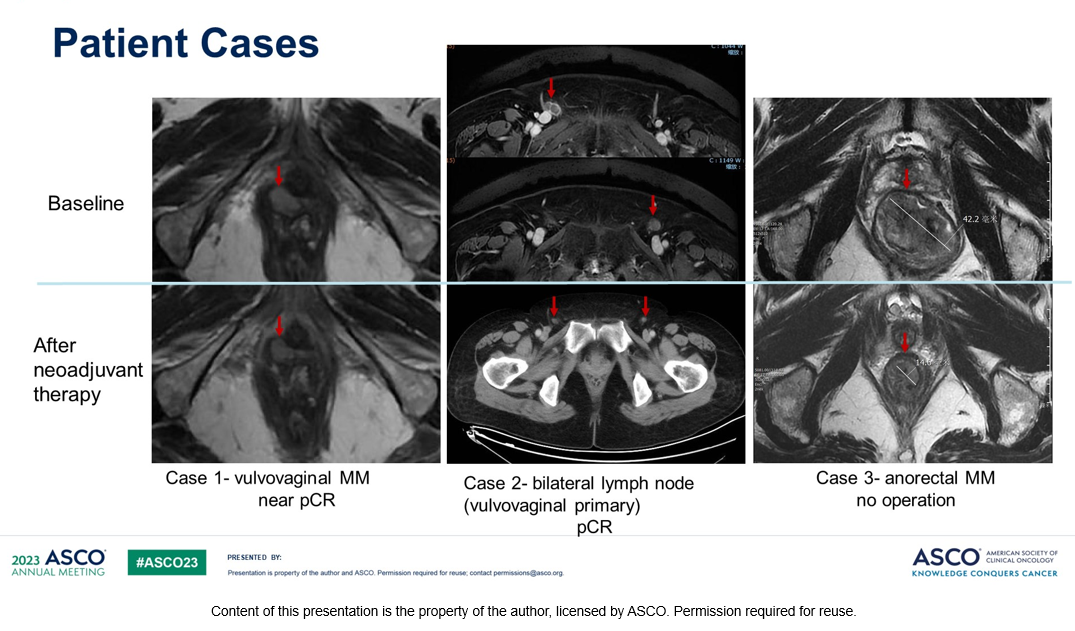
Рисунок 7. Исследование NeoPlus: неоадъювантная ленватиниб + пембролизумаб при резектабельной меланоме слизистых. Клинические случаи.
Терапия метастатической меланомы
Современная противоопухолевая терапия метастатической меланомы за последние годы претерпела большие изменения. Именно с метастатических форм меланомы кожи началось применение современной таргетной и иммунотерапии. На сегодняшний день известны результаты длительной выживаемости пациентов на фоне комбинированной иммунотерапии ниволумаб + ипилимумаб (рис.8) [7].
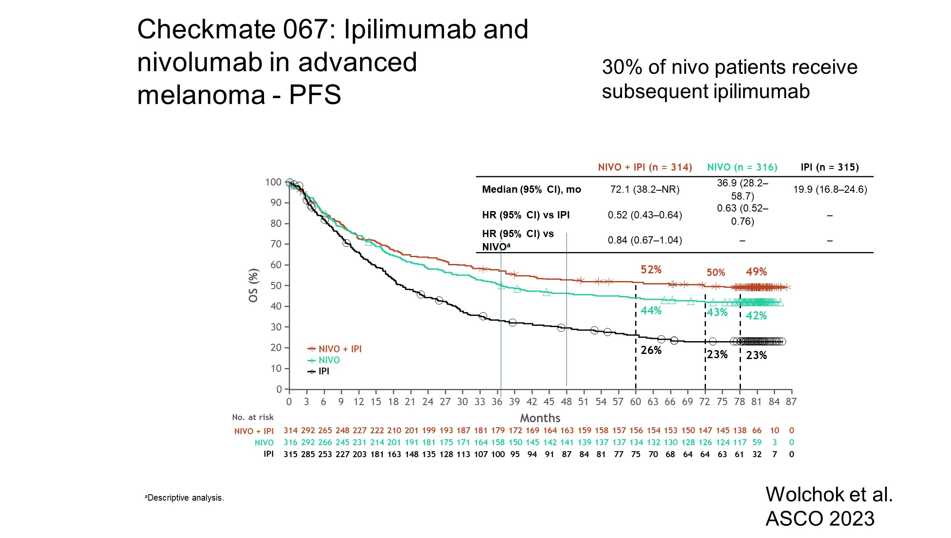
Рисунок 8. Исследование Checkmate 067: ипилимумаб + ниволумаб при метастатической меланоме. Кривые общей выживаемости.
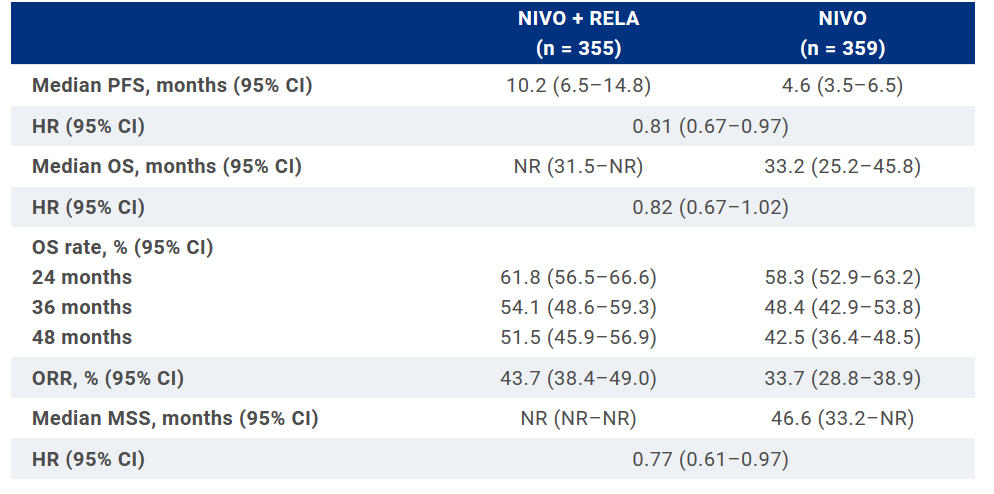
Однако остается проблема резистентности к иммунотерапии. Почему не все пациенты отвечают на лечение и как преодолеть эту проблему? Очевидно, что исследования, посвященные резистентности к анти-PD1 терапии заслуживают внимание клиницистов. В исследовании RELATIVITY-047 комбинация ниволумаб плюс релатлимаб (NIVO + RELA) сравнивалась с монотерапией ниволумабом (NIVO) у нелеченых ранее пациентов с нерезектабельной меланомой. На ASCO 2023 были представлены дополнительные результаты 2-летнего наблюдения [8]. В результате рандомизации 355 пациентов получили ниволумаб + релатлимаб и 359 – только ниволумаб. Медиана наблюдения составила 25,3 месяца. Результаты дополнительного наблюдения подтверждают преимущество комбинации NIVO + RELA в сравнении с NIVO по показателям БРВ, ОВ, частоте объективного ответа (ЧОO). Также меланома-специфическая выживаемость (MSS) оказалась выше в группе NIVO + RELA (медиана не достигнута) в сравнении с NIVO (46,6 мес.). Данные представлены в таблице 1 и на рис.1,2.
Последующую системную терапию получили 131 (36,9%) пациент в группе NIVO + RELA and 136 (37,9%) – в группе NIVO. Частота осложнений, приведших к прекращению терапии, составила 17,2% и 8,6% соответственно. Осложнения 3-4 степени, связанные с лечением, наблюдались у 78 (22,0%) пациентов в группе NIVO + RELA и у 43 (12,0%) – в группе NIVO, отмечено 6 смертельных случаев (NIVO + RELA, n = 4; NIVO, n = 2). Новых осложнений, связанных с лечением, со времени последнего анализа среза данных не отмечено.
Таблица 1. RELATIVITY-047: комбинация ниволумаб плюс релатлимаб* (NIVO + RELA) против монотерапии ниволумабом. Показатели безрецидивной выживаемости (PFS), общей выживаемости (OS), частоты объективного ответа (ORR), меланома-специфической выживаемости (MSS)
Релатлимаб не зарегистрирован в РФ. Регистрация ожидается.
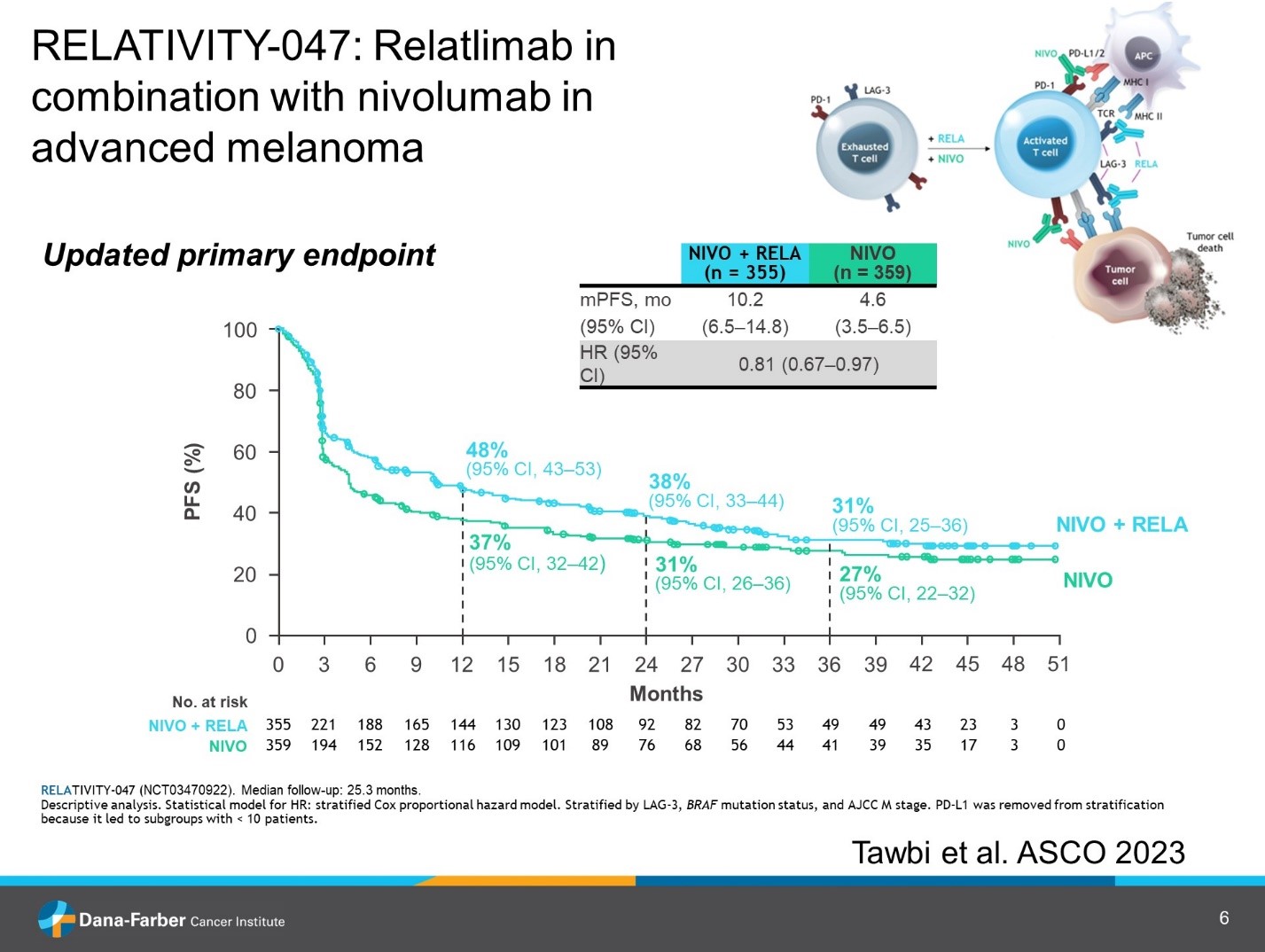
Рисунок 9. RELATIVITY-047: релатлитаб в комбинации с ниволумабом в пациентов с метастатической меланомой. Кривые безрецидивной выживаемости.
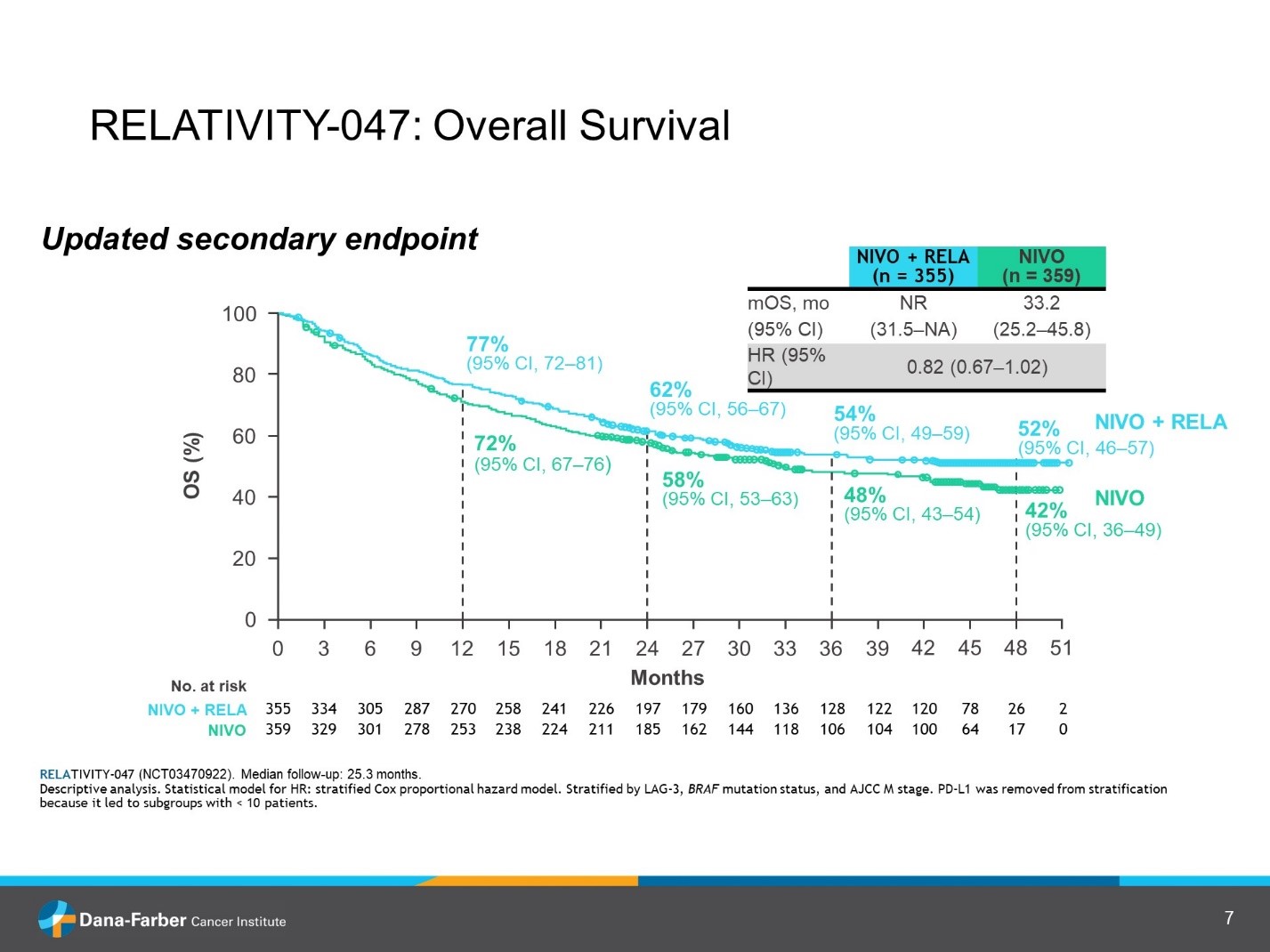
Рисунок 10. RELATIVITY-047: релатлимаб в комбинации с ниволумабом у пациентов с метастатической меланомой. Кривые общей выживаемости.
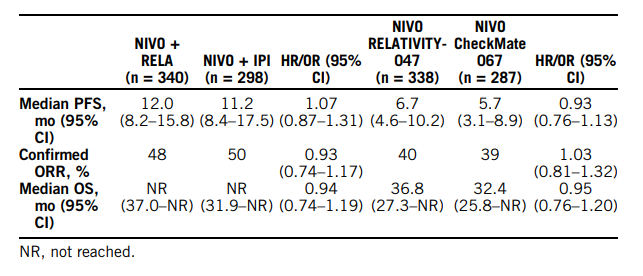
Комбинированная иммунотерапия с применением ингибиторов контрольных точек ниволумаб + ипилимумаб и ниволумаб + релатлимаб одобрены в качестве возможных опций лечения первой линии для пациентов с прогрессирующей меланомой на основе результатов RELATIVITY-047 (NIVO + RELA против NIVO) и CheckMate 067 (NIVO + IPI или NIVO против IPI) исследований. Препарат релатлимаб не зарегистрирован в РФ, ожидается его регистрация. Прямого исследования по сравнению этих комбинаций не проводилось. На основании непрямого сравнения двух видов лечения отмечено, что результаты эффективности были схожими, хотя тенденции в пользу NIVO + IPI наблюдались в определенных подгруппах (с наличием мутации в гене BRAF или повышенным более чем в два раза уровнем лактатдегидрогеназы). Нежелательные явления 3-4 степени имели место у 23% и 61% пациентов, получавших NIVO + RELA и NIVO + IPI, соответственно; нежелательные явления любой степени тяжести, приводящие к отмене лечения, отмечались у 17% и 40% пациентов соответственно. Таким образом, непрямое сравнение двух режимов лечения предполагает, что применение в первой линии терапии комбинации NIVO + RELA может иметь сопоставимую эффективность и лучшую переносимость, чем NIVO + IPI у пациентов с прогрессирующей меланомой (табл.2). Результаты следует интерпретировать с осторожностью, учитывая различия в дизайне исследования и изменения в структуре лечения с течением времени [9].
Таблица 2. Эффективность первой линии терапии комбинаций ниволумаб + релатлимаб (NIVO + RELA) против ниволумаб + ипилимумаб (NIVO + IPI) при метастатической меланоме
В настоящее время исследуются новые анти-LAG3 моноклональные антитела для лечения пациентов как с метастатической, так и резектабельной меланомой. Мультицентровое нерандомизированное открытое исследование I фазы комбинации анти-LAG3 антитела fianlimab + cemiplimab (анти-PD-1) показало положительные результаты при распространенной меланоме у нелеченных ранее анти-PD-1/PD-L1 препаратами пациентов. Включено 98 больных, две когорты (80 пациентов), не леченные прежде анти-PD-1/PD-L1 терапией, получали fianlimab + cemiplimab в качестве первой или второй линии, а третья когорта пациентов (18 человек) имели в анамнезе неоадъювантную или адъювантную терапию (не ранее 6 месяцев после ее окончания). Первичной конечной точкой была ЧОО, которая составила 61%, включая 12% полных и 49% частичных ответов [10]. Медиана длительности ответа (DOR) не была достигнута, медиана БРВ составила 15 месяцев (рис.10).
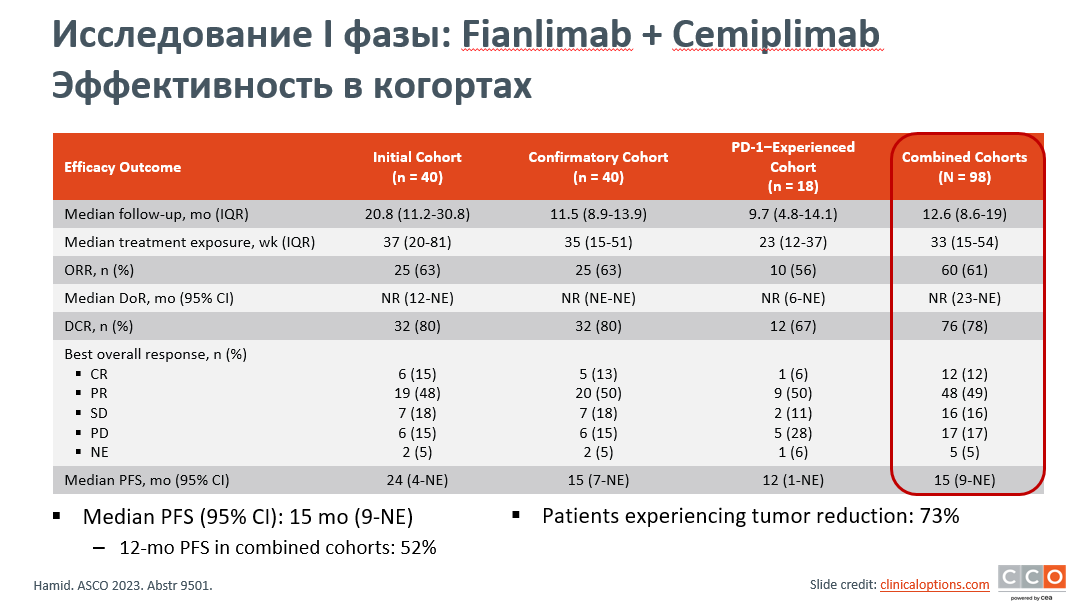
Рисунок 11. Эффективность комбинации fianlimab (анти LAG3 антитело) + cemiplimab (анти-PD-1 антитело).
Ответы на лечение были сходными у пациентов, которые ранее не получали адъювантную или неоадъювантную терапию, по сравнению с теми, кто ее получал. ЧОО составила 60,9% и 61,5% соответственно, медиана DOR не была достигнута ни в одной из групп, а медиана БРВ составила 13,3 месяца и 11,8 месяцев соответственно. Клинические преимущества комбинированной терапии наблюдались во всех когортах пациентов и при всех уровнях экспрессии PD-L1 и LAG-3. Профиль безопасности был аналогичен результатам предыдущих исследований монотерапии cemiplimab и другими препаратами против PD-(L)1. Иммуноопосредованные нежелательные явления отмечены у 65,3% пациентов, и 16,3% пациентов прекратили лечение из-за побочных эффектов. Таким образом, комбинированная терапия fianlimab + cemiplimab при распространенной меланоме показала стабильные, воспроизводимые результаты во всех группах пациентов, и в настоящее время продолжаются исследования III фазы fianlimab + cemiplimab как при распространенной меланоме, так и в качестве адъюванта.
Осложнения лечения
Интерес у клиницистов вызовут исследования по иммуноопосредованным нежелательным явлениям (ИоНЯ). Известно, что пациенты, у которых наблюдаются ИоНЯ в результате лечения ингибиторами контрольных точек иммунного ответа, демонстрируют значительно лучшие результаты по сравнению с пациентами без токсичности. Однако данные о воздействии конкретных ИоНЯ в настоящее время отсутствуют. Представлена реальная когорта пациентов с метастатической меланомой, которые проходили лечение иммуноонкологическими препаратами в качестве первой линии в период с 2014 по 2020 годы. Проведен анализ лечения 395 пациентов, 65,4% из которых получали моно анти-PD-1 терапию, 24,3% - комбинированную иммунотерапию и 10,3% пациентов - анти- CTLA-4 [11]. Средний возраст составил 68 лет (от 12 до 99 лет), 57% составляли мужчины. Медиана периода наблюдения составила 24,5 месяца. ИоНЯ любой степени тяжести наблюдались у 72% (299) пациентов, у 26% (104) больных отмечались ИоНЯ высокой степени тяжести. Наиболее частыми ИоНЯ были следующие осложнения: дерматологические (n = 110, 27,8%), витилиго (n = 48, 12,1%), ревматологические (n = 68, 17,2%), желудочно-кишечные (n = 66, 16,7%) и эндокринные (n = 61, 15,4%). Развитие ИоНЯ было связано со значительно более длительной медианой БРВ (19,3 мес. против 4,5 мес.; ОР 0,46, р=0,001) и медианой ОВ (55 мес. против 16,9 мес.; ОР 0,44, р=0,001). Специфическими ИоНЯ, которые были достоверно связаны с улучшением выживаемости, были ревматологические (ОР 0,34 для БРВ, p = 0,001; ОР 0,38 для OВ, p= 0,001), дерматологические (ОР 0,58 для БРВ, p = 0,001; ОР 0,54 для OВ, p = 0,001), витилиго (ОР 0,30 для БРВ, p = 0,001; ОР 0,29 для OВ, p = 0,001) и эндокринопатии (ОР 0,6 для БРВ, p = 0,01; ОР 0,52 для OВ, p = 0,001). Авторами сделан вывод о том, что развитие ревматологических, витилиго и других дерматологических заболеваний во время лечения ингибиторами контрольных точек коррелирует с заметным преимуществом в выживаемости. Эти ИоНЯ могут отражать гиперактивированный иммунный ответ и, таким образом, могут служить значимыми клиническими биомаркерами.
Подводя итоги, хочется отметить, что несмотря на имеющиеся успехи в лечении пациентов с меланомой, достаточно много вопросов остаются нерешенными и, возможно, в этом нам помогут дополнительные данные проведенных клинических испытаний, результаты новых исследований и, безусловно, фундаментальная работа наших экспериментаторов.
Источники: