16.05.2023
В настоящий момент больным дифференцированным раком щитовидной железы (РЩЖ), резистентным к радиойодтерапии и без драйверных мутаций в генах NTRK, ALK, RET или BRAF, возможно назначение сорафениба, ленватиниба, вандатениба, сунитиниба или пазопаниба при ожидаемой медиане выживаемости без прогрессирования (мВБП) на фоне лечения в 11-18 мес. и частоте достижения объективного ответа в 63%. Разработка новых стратегий лечения радийодрезистентного РЩЖ – это актуальная задача.
Цедираниб является низкомолекулярным пероральным ингибитором рецепторов VEGFR-1,2,3, а также c-Kit, а леналидомид обладает антинеопластическими, антиангиогенными и иммуномодулирующими свойствами.
В исследование были включены пациенты старше 18 лет, с ECOG статусом от 0-2 и верифицированным дифференцированным РЩЖ (папиллярным, фолликулярным и гюртлеклеточным).
Исследование обладало сложным, ступенчатым дизайном. Первый этап был разработан как классическое исследование 1 фазы, основной задачей которого являлось определение дозового режима. Второй этап – рандомизированное исследование второй фазы, первичной конечной точкой которого была медиана выживаемости без прогрессирования (ВБП), вторичными – частота достижения объективного ответа (ЧОО), медиана общей выживаемости (ОВ) и токсичность терапии.
На первом этапе (1 фаза) исследования оптимальный дозовый режим терапии был определен как цедираниб 30 мг ежедневно и леналидомид 15 мг в дни с 1 по 21, курс 28 дней.
На втором этапе (2 фаза) пациенты были рандомизированы в 2 группы в соотношении 2:1:
Большинство пациентов были женщинами (59%) с медианой возраста в 63 года и ECOG 0-1, 23% больных ранее получали анти-VEGF терапию.
При медиане времени наблюдения в 11 мес. медиана ВБП в группе цедираниба составила 14,8 мес. и 11,3 мес. в группе комбинированной терапии (p=0,36) (рис.1).
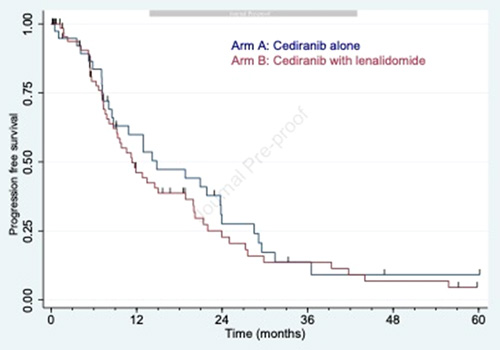
Рисунок 1. График выживаемости без прогрессирования в 2 группах.
Частота объективного ответа составила 44% как в группе цедираниба, так и в группе комбинации цедираниба и леналидамида (p=0,99). При подгрупповом анализе показано, что у пациентов, ранее не получавших анти-VEGF терапию, частота ОО составила 53% и 43% против 11% и 44% в лечебных группах соответственно.
Медиана общей выживаемости не достигнута, при зарегистрированной 2-летней ОВ в 64,8% в группе монотерапии и 75,3% при комбинированном лечении.
Нежелательные явления 3-й степени или выше, связанные с лечением, были представлены астенией (26% в группе А и 26% в группе В), гипертонией (26% и 28%) и диареей (15% и 12%). НЯ 3-й степени, которые чаще зарегистрированы при применении цедираниба и леналидомида в сравнении с только цедиранибом, включали протеинурию (5,1% и 8,7%), мышечную слабость (0% и 5,8%) нейтропению (2,6% и 16%), тромбоцитопению (0% и 4,3%) и лимфопению (0% и 4,3%).
Не существует рандомизированных исследований, сравнивающих между собой мультикиназные ингибиторы, можно только сопоставить результаты различных работ (табл.1).
Таблица 1. Эффективность тирозинкиназных ингибиторов при дифференцированном раке щитовидной железы.
| Препарат | Ленватиниб [2] | Сорафениб [3] | Вандатениб [4] | Цедираниб [1] |
|---|---|---|---|---|
| VEGF1-3, FGF1-4, PDGF, KIT, RET | VEGF1-3, PDGF, FGF, KIT, RET | EGF, RET, VEGF2, VEGF3 | VEGF1-3, KIT | |
| мВБП, мес. | 18,3 | 10,8 | 30,5 | 14,8 |
| ЧОО,% | 64,8 | 12,2 | 44,4 | 44,4 |
Таким образом цедираниб может быть еще одной эффективной опцией терапии при дифференцированном раке щитовидной железы.
Источники: