25.04.2023
Торипалимаб представляет собой моноклональное антитело против PD-1, первоначально разработанное в Китае, но в настоящее время набирающее обороты в Соединенных Штатах. Это было первое одобренное в Китае отечественное моноклональное антитело против PD-1 для лечения меланомы, рака носоглотки, уротелиального рака, рака пищевода и немелкоклеточного рака легкого (НМРЛ). В Соединенных Штатах Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предоставило статус «терапии прорыва» для схем, содержащих торипалимаб, при карциноме носоглотки. FDA также присвоило торипалимабу статус Fast Track для лечения меланомы слизистой оболочки и статус орфанного препарата для лечения рака пищевода, карциномы носоглотки, меланомы слизистой оболочки, саркомы мягких тканей и мелкоклеточного рака легкого.
Использование антител против PD-1/PD-L1, таких как торипалимаб, до и после радикальной операции по поводу НМРЛ привлекло значительное внимание в последние годы. Несколько адъювантных и неоадъювантных иммунопрепаратов были одобрены FDA, Европейским агентством по лекарственным средствам и Китайским национальным управлением по производству медицинских изделий (NMPA) для лечения НМРЛ на ранней стадии. Тем не менее, есть еще несколько клинических вопросов, на которые необходимо ответить.
Neotorch – это рандомизированное двойное слепое плацебо-контролируемое исследование 3 фазы, проводимое в Китае у пациентов с операбельным НМРЛ II/III стадии без мутаций EGFR или ALK. Все пациенты в исследовании были сначала стратифицированы по стадии заболевания, гистопатологическому подтипу, уровню экспрессии PD-L1 и хирургическому вмешательству, а затем были рандомизированы в группу торипалимаба или плацебо в комбинации с химиотерапией на основе платины каждые 3 недели, 3 цикла до операции и 1 цикл после. Затем монотерапия торипалимабом или плацебо продолжалась каждые 3 недели в течение 13 циклов.
Текущий промежуточный анализ, проведенный у пациентов с НМРЛ III стадии, был заранее спланирован, чтобы оценить первые результаты, прежде всего бессобытийную выживаемость (БСВ). На момент окончания сбора данных (30 ноября 2022 г.) средний срок наблюдения за пациентами составил в среднем 18,3 месяца. В итоге периоперационный торипалимаб в сочетании с химиотерапией привел к 60% снижению риска бессобытийной выживаемости среди пациентов с III стадией заболевания по сравнению с только периоперационной химиотерапией.
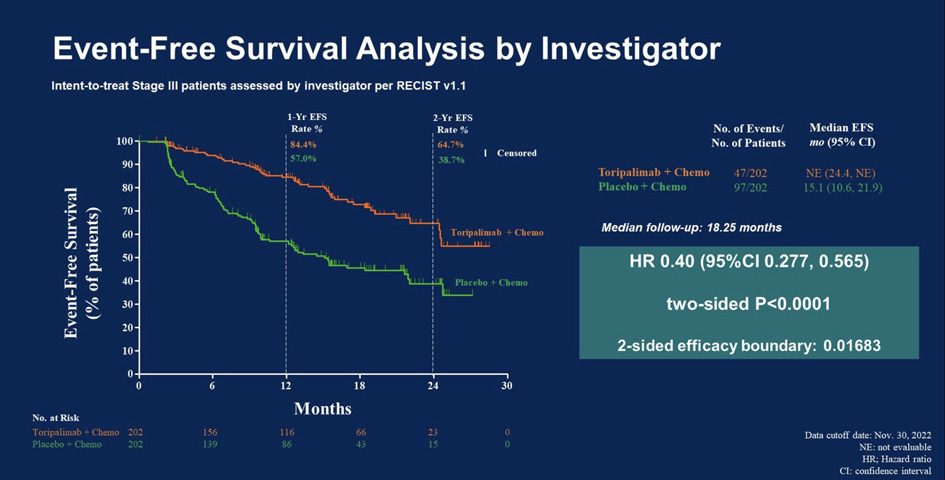
Рисунок 1. Бессобытийная выживаемость.
Преимущество в БСВ, наблюдаемое при применении торипалимаба в общей популяции III стадии, распространилось на пациентов в ключевых подгруппах. Улучшение БСВ было более заметным среди больных с положительной экспрессией опухолевых клеток PD-L1 (т.е. ≥1%), но при этом у других пациентов также отмечены лучшие результаты лечения торипалимабом независимо от статуса экспрессии PD-L1.
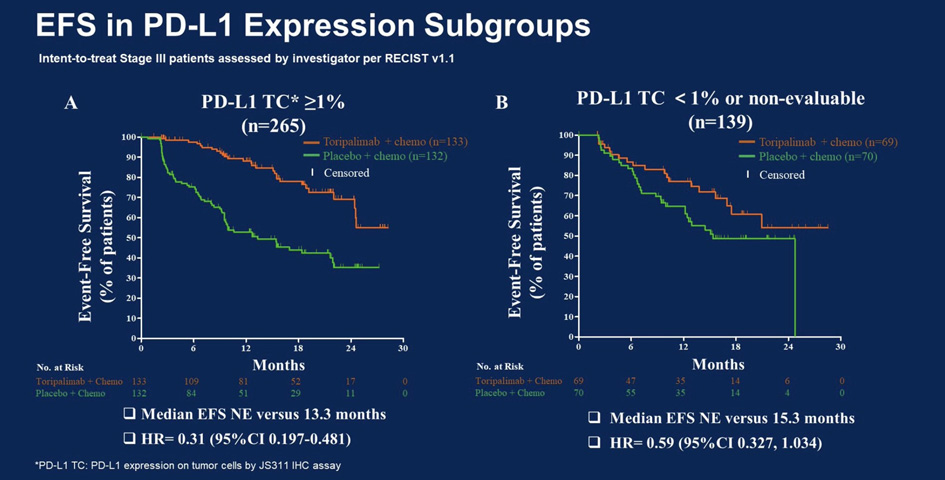
Рисунок 2. Бессобытийная выживаемость в подгруппах с экспрессией PD-L1.
Группа торипалимаба также продемонстрировала более высокие показатели максимального патоморфологического ответа (MPR; 48,5% против 8,4%) и полного патоморфологического ответа (pCR; 24,8% против 1,0%) по сравнению с группой плацебо согласно ослепленным независимым данным после операции. Данные по общей выживаемости (ОВ) еще не готовы, но в настоящее время показатели имеют тенденцию улучшаться в пользу группы торипалимаба.
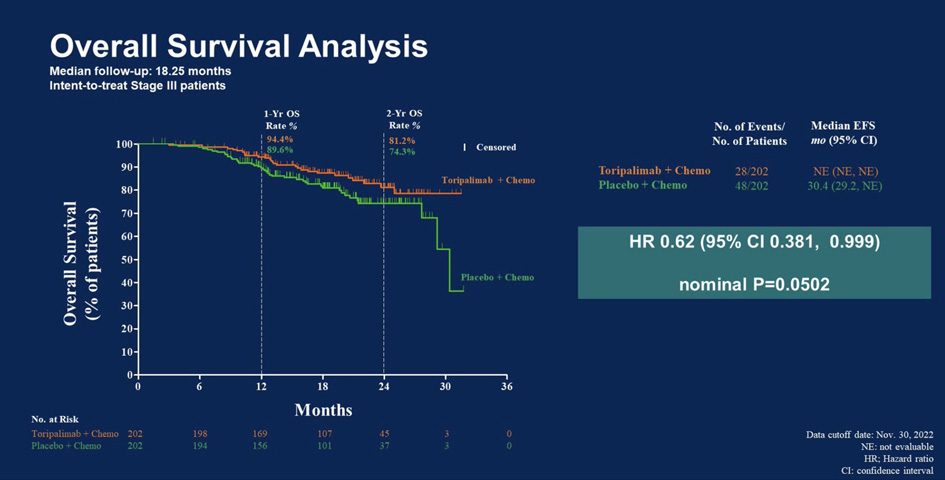
Рисунок 3. Общая выживаемость.
Конечная точка pCR была принята в качестве суррогатной конечной точки неоадъювантного лечения, что и привело к ускоренному одобрению FDA препаратов для лечения рака молочной железы высокого риска на ранней стадии, но вопрос о том, можно ли использовать pCR/MPR в качестве суррогатной конечной точки для оценки БСВ/ОВ у пациентов с НМРЛ, остается спорным.
Профиль безопасности торипалимаба, наблюдаемый в Neotorch, является управляемым и согласуется с предыдущими исследованиями. Нежелательные явления ≥3 степени (63,4% против 54,0%) и побочные эффекты, связанные с иммунным ответом (42,1% против 22,8%), чаще возникали при применении торипалимаба по сравнению с плацебо, при этом гипотиреоз, сыпь и гипертиреоз стали наиболее частыми побочными эффектами, связанными с иммунной системой. Тем не менее, фатальные побочные эффекты, связанные с лечением (0,5% против 0%), и побочные эффекты, приведшие к прекращению приема торипалимаба или плацебо (9,4% против 7,4%), были сходными между 2 группами.
По мнению д-ра Charu Aggarwal из Университета Перельмана Пенсильвании, США, это исследование базируется на текущем стандарте лечения неоадъювантной иммунотерапии с химиотерапией перед хирургической резекцией у пациентов с хирургически резектабельным НМРЛ, демонстрируя потенциальную новую парадигму периоперационной иммунотерапии.
Источник: Shun Lu, Lin Wu, Wei Zhang, et al. Perioperative toripalimab + platinum-doublet chemotherapy vs chemotherapy in resectable stage II/III non-small cell lung cancer (NSCLC): Interim event-free survival (EFS) analysis of the phase III Neotorch study. J Clin Oncol. 2023; 41 (suppl 36; abstr 425126). DOI 10.1200/JCO.2023.41.36_suppl.425126.