14.02.2023

В последнее время в связи с высокой распространенностью сердечно-сосудистых заболеваний (ССЗ), успешным их лечением и увеличением продолжительности жизни большой интерес вызывает проблема онкологической безопасности сердечно-сосудистых препаратов. Увеличилась и выживаемость пациентов, перенесших онкологические заболевания (ОЗ), что привело к широкому распространению возрастной коморбидной патологии, что, в свою очередь, требует повсеместного и частого применения лекарств для лечения ССЗ. По результатам Childhood Cancer Survivor Study (CCSS), в которое были включены пациенты детского возраста, получавшие химио- и лучевую терапию по поводу ОЗ, и которые выжили после 35-летнего возраста, вероятность возникновения инсульта и инфаркта миокарда у пациентов после онкологической терапии в 5 раз выше по сравнению с их здоровыми братьями и сестрами. Этот риск был выше у лиц с дислипидемией, сахарным диабетом (СД) и ожирением [1]. В многофакторных моделях только артериальная гипертензия (АГ) продемонстрировала значительно повышенный риск для всех основных сердечных событий среди выживших, подвергшихся как лучевой терапии в области грудной клетки, так и лечению антрациклинами [2]. Такой актуальной проблеме, как кардиотоксичность противораковой терапии, в настоящее время справедливо посвящено немало работ, но, на наш взгляд, недостаточно освещены вопросы влияния сердечно-сосудистых препаратов на возникновение и рецидивы злокачественных новообразований. В 2012 году были опубликованы обобщенные данные семи когортных исследований из Норвегии, Австрии и Швеции, которые включали 577 799 пациентов, наблюдавшихся в среднем в течение 12 лет. Было выявлено, что АГ увеличивает не только риск развития рака, но и смертность от онкозаболеваний [3]. Эти данные еще больше убеждают в необходимости адекватного контроля артериального давления (АД). В то же время уже не первое десятилетие обсуждается вопрос безопасности применения антагонистов рецепторов аниотензина II 1-го типа (АРА) – сартанов [4]. Существуют работы и ретроспективные метаанализы, которые сообщают о канцерогенном эффекте и других классов антигипертензивных агентов. Проблема усугубляется еще и тем, что пациенты подвергаются воздействию гипотензивных препаратов в течение десятилетий, намного дольше, чем учитывали первоначальные клинические испытания этих препаратов на безопасность. В связи с этим в настоящее время есть повышенный интерес к хроническому использованию антигипертензивной терапии и к тому, как она может влиять на риск развития или рецидивирования рака. Однако существует немало данных о противораковом эффекте ацетилсалициловой кислоты и плейотропных противовоспалительных эффектах статинов. Таким образом, учитывая частое применение лекарств для лечения ССЗ и продолжительные, нередко пожизненные курсы терапии, а также широкое распространение коморбидной патологии и большой арсенал кардиологических средств, представляется крайне актуальным разобраться, в каких ситуациях и у каких пациентов назначение сердечно-сосудистых препаратов является безопасным.
Диуретики
История изучения побочных эффектов мочегонных препаратов началась еще во второй половине прошлого века. В 80-х годах были опубликованы результаты исследований, выполненных на моделях животных, которые показали резкое увеличение риска развития рака, в частности, рака простаты, и нефропатии при применении фуросемида и гидрохлоротиазида [5,6]. Интерес к этой проблеме развивался дальше, и в 90-х годах было обнаружено (уже на пациентах), что повышенный риск онкообразования при использовании диуретиков (отношение шансов 1,55; 95% ДИ 1,42-1,71) связан с женским полом и длительным сроком лечения [7]. Дополнительные исследования с поправкой на гипертонию демонстрируют ослабленную, хотя и статистически значимую связь между диуретиками и риском рака; более того, было показано, что увеличение риска развития ОЗ возникает и у нормотензивных пациентов, принимающих диуретики по альтернативным показаниям [8-10]. В более современных исследованиях обнаружен дозозависимый эффект между возникновением немеланоцитарного рака кожи (базальноклеточной карциномы и плоскоклеточного рака губы) и приемом гидрохлортиазида, а также тенденция к увеличению риска развития Меркель-клеточной карциномы, связанного с использованием фуросемида (ОШ 1,9; 95% ДИ 0,9-4,0) [11-13]. Есть еще одна интересная работа, которая подтвердила связь между антигипертензивными препаратами и папиллярной почечноклеточной карциномой [14]. При анализе результатов и попытке объяснить полученные эффекты было выдвинуто предположение, что некоторые диуретики могут превращаться в желудке в мутагенное нитрозопроизводное или что химическая бомбардировка почечных канальцевых клеток (мишень диуретиков) в течение многих лет может оказывать канцерогенное действие.
Вероятно, следует избегать огульного постоянного применения диуретиков и быть осторожными с комбинированными препаратами, а также учитывать дозы мочегонных препаратов у пациентов с ОЗ в анамнезе.
Ингибиторы ангиотензин-превращающего фермента (ИАПФ) и β-блокаторы
В 2011 году были опубликованы результаты исследования LACE (Life After Cancer Epidemiology) [15], в котором анализировалась связь между рецидивом рака молочной железы и использованием ИАПФ и β-блокаторов. Было выявлено, что применение ИАПФ связано с рецидивом рака молочной железы (ОШ 1,56; 95% ДИ 1,02-2,39), в то время как воздействие β-блокатора в этом отношении безопасно (ОШ 0,86; 95% ДИ 0,57-1,32). В дальнейшем появилось еще несколько исследований, которые утверждали, что β-адреноблокаторы могут снизить риск рецидива рака молочной железы, в то время как ИАПФ и АРА не связаны с повышенным риском развития и рецидива опухоли груди [16-18]. Таким образом, в настоящий момент нет четких данных о влиянии ИАПФ на возникновение рецидива маммарных опухолей, и потенциальные механизмы этого остаются неясными, но, на наш взгляд, при наличии большого выбора антигипертензивных средств следует соблюдать некую осторожность в назначении ИАПФ пациенткам, перенесшим рак молочной железы.
Сартаны
Сартаны являются, наверное, самыми обсуждаемыми и «скандальными» препаратами из всего сердечно-сосудистого арсенала. В 2003 г. в журнале Lancet были опубликованы результаты исследования CHARM-Overall [19], в котором утверждалось, что на фоне терапии кандесартаном чаще, чем на фоне лечения плацебо, регистрировались случаи фатального рака. В совокупности ряд исследований начиная с 2003 г. – CHARM-Overall, LIFE, ONTARGET, OPTIMAAL, PROFESS, TRANSCEND, TROPHY, VALIANT, Val-HeFT, в которых приняли участие 61 950 пациентов, показал, что применение сартанов на 1-2% увеличивает риск развития рака, в особенности это касается телмисартана, который увеличивает риск возникновения рака легких на 8%. I. Sipahi с соавторами в 2010 году предложил гипотезу о том, что высокая концентрация циркулирующего в плазме крови ангиотензина II, индуцированная селективной блокадой рецепторов 1-го типа, может увеличить стимуляцию рецепторов ангиотензина 2-го типа, что, в свою очередь, возможно, стимулирует ангиогенез опухоли [20]. Известно, что РААС вовлечена в ангиогенез. Тем не менее, большинство экспериментальных работ доказывает, что ангиогенез стимулируется исключительно с помощью рецепторов 1-го типа. Некоторые авторы предполагают, что стимуляция рецепторов ангиотензина 1-го типа активирует ангиогенез посредством активации экспрессии сосудистого эндотелиального и других факторов роста, а также генов, вовлеченных в регуляцию клеточной пролиферации. Однако исследование канадских авторов, которые обследовали когорту в Великобритании, получавшую телмисартан, демонстрирует отсутствие повышенного риска развития рака при применении этого препарата по сравнению с другими АРА. Тем не менее, авторы делают немаловажную приписку, что исследование дает уверенность всего лишь в краткосрочной безопасности телмисартана [21]. Не успели утихнуть споры в научной литературе по поводу канцерогенного действия сартанов, как разразился новый «скандал». 1 февраля 2019 г. Комитет по лекарственным средствам для человека (CHMP) Европейского агентства по лекарственным средствам (European Medicines Agency – EMA) принял решение обязать компании, производящие лекарственные средства класса сартанов, пересмотреть свои производственные процессы во избежание появления примеси нитрозамина [22]. Решение было принято после того, как EMA 2 мая 2019 г. опубликовало подробный отчет по проблеме нитрозаминовых примесей в сартанах. Помимо информации о более изученных примесях – N-нитрозодиметиламинам (NDMA) и N-нитрозодиэтиламинам (NDEA) – в отчете содержится информация о трех других типах: N-нитрозо-N-метил-4-аминомасляной кислоте (NMBA), N-нитрозодиизопропиламине (DIPNA) и N-нитрозоэтилизопропиламине (EIPNA). Обзор касается кандесартана, ирбесартана, лозартана, олмесартана и валсартана, которые имеют специфическую кольцевую структуру (тетразол), синтез которой потенциально может привести к образованию примесей нитрозаминов. Другие лекарственные средства класса сартанов, которые не имеют этого кольца, такие как азилсартан, эпросартан и телмисартан, не были включены в отчет (рис.1).
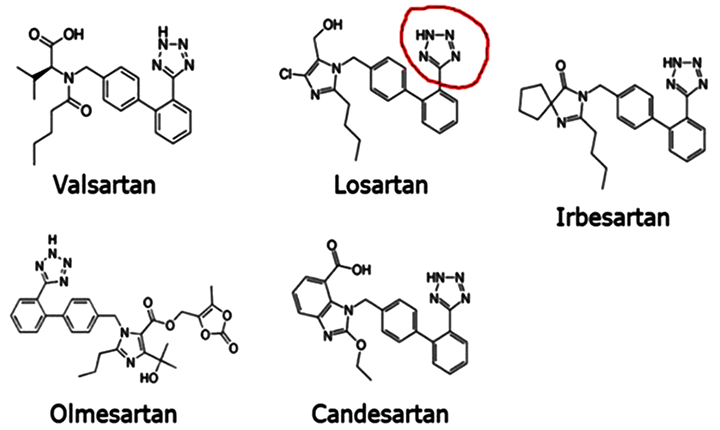
Рисунок 1. Сартаны, содержащие тетразольное кольцо.
Следует отметить, что кандесартан, лозартан, олмесартан и валсартан одобрены для лечения АГ у детей.
Оказалось, что во всем повинна китайская компания Zhejiang Huahai Pharmaceutical (Чжецзиан Хуахай Фармасьютикал), которая выпускает активный фармацевтический ингредиент (АФИ) для производства сартанов. Именно там и было обнаружено повышенное содержание нитрозаминов (табл.1).
Таблица 1. Данные о содержании NDMA в АФИ от Zhejiang Huahai и готовых лекарственных средствах с этим АФИ.
| Источник | Количество протестированных серий/ |
Содержание NDMA ppm (мкг/г) | ||
|---|---|---|---|---|
| Среднее | Максимальное | Минимальное | ||
| Валсартан, АФИ от Zhejiang Huahai | 6833 | 60,13 | 240,1 | 0,1 |
| Валсартан, готовое лекарственное средство, содержащее АФИ от Zhejiang Huahai | 5 | 75,4 | 97,4 | 56,7 |
Данные EMA
В обновленных результатах расследования Food and Drug Administration (FDA), США, содержится предположение о том, что примеси могут являться следствием использования определенных растворителей, реагентов и других исходных материалов. Кроме того, не исключается, что примеси присутствовали в некоторых сартанах, потому что производители непреднамеренно использовали загрязненное оборудование или реагенты в процессе производства.
Обзор оценил максимально возможный риск рака в связи с наличием нитрозаминов. Максимальная продолжительность воздействия на пациентов валсартана, загрязненного NDMA, составляет 6 лет (с июля 2012 г. по июль 2018 г.). Если 100 000 пациентов принимали валсартан из провинции Чжэцзян Хуай (где были найдены самые высокие уровни примесей) каждый день в течение 6 лет в самой высокой дозе, то может возникнуть 22 дополнительных случая рака из-за NDMA в течение жизни этих 100 000 пациентов. NDEA в этих лекарствах может привести к 8 дополнительным случаям на 100 000 пациентов, которые принимали лекарство в самой высокой дозе каждый день в течение 4 лет [23]. Среднесуточное воздействие NDMA, по цитируемым ЕМА данным, из-за загрязненных напитков, продуктов питания, воздуха и воды составляет 100-1000 нг в сутки = 0,1-1 мкг/день. Keszei с соавт. установил, что увеличение потребления NDMA на 0,1 мкг/день ведет к появлению плоскоклеточного рака пищевода, причем риск сцеплен с мужским полом. А поступление NDMA в связи с лечением контаминированными на среднем уровне препаратами валсартана более чем в 24 раза выше, чем при ежедневном потреблении напитков, продуктов питания, воздуха и воды с нитрозаминовыми соединениями [24]. Федеральная служба по надзору в сфере здравоохранения РФ тоже не осталась в стороне от этой проблемы и опубликовала Письмо №01И-591/19 от 27.02.2019 о безопасности лекарственных препаратов группы сартанов, в котором определены отечественные и зарубежные производители лекарственных препаратов валсартана, в чьей регистрационной документации содержится информация об использовании субстанции валсартан, в отношении которой приняты регуляторные решения, и содержатся напоминания об обязанностях производителей и распространителей лекарств контролировать качество продаваемой продукции.
Таким образом, на данный момент нет ясности в вопросе безопасности применения препаратов класса АРА в отношении канцерогенеза, особенно у пациентов с неблагоприятным анамнезом или наследственностью.
Сердечные гликозиды (СГ) и антагонисты кальция (АК)
Противоопухолевые свойства СГ начали изучаться в 60-х годах прошлого века в доклинических исследованиях. Эпидемиологические исследования, касающиеся связи между использованием СГ и риском развития рака, дали противоречивые результаты. Противоопухолевая активность СГ, наблюдаемая в исследованиях на животных, требует высоких концентраций, которые обычно очень плохо переносятся людьми. В анализе 14 исследований типа случай-контроль и 15 когортных исследований было выявлено, что использование СГ было связано с более высоким риском рака молочной железы определенных видов. Ученые сделали вывод, что эстрогеноподобная активность СГ может быть ответственна за увеличение риска некоторых типов опухолей груди. Тем не менее, постоянный долгосрочный прием СГ снизил общий риск развития опухолей [25].
В 1996 г. был поднят вопрос о возможной связи между приемом АК и увеличением риска развития рака [26]. Проспективное когортное исследование показало, что применение АК связано с повышением общего риска развития рака в когорте пожилых людей, принимавших АК. Коэффициенты риска, связанные с верапамилом, дилтиаземом и нифедипином, существенно не отличались друг от друга. А начиная с 1977 г. стали появляться многочисленные сообщения о статистически значимом увеличении риска развития рака груди. Особенно это касалось длительного приема АК (в течение 10 лет или более) [27]. В то же время результаты большого популяционного когортного исследования показывают, что длительное использование блокаторов кальциевых каналов не связано с повышенным риском рака молочной железы, независимо от длительности приема препарата [28]. Авторитетный метаанализ, включающий шесть когортных и четыре исследования «случай-контроль», анализировал воздействие АК на риск развития рака легких. Выяснилось, что применение АК длительностью ≥4 лет достоверно связано с повышенным риском рака легких. Авторы делают вывод, что, учитывая широкое использование этих препаратов и недостаток данных о долгосрочных последствиях хронического воздействия АК, результаты являются поводом для беспокойства и требуют дальнейшего изучения [29]. Предполагалось, что потенциальные механизмы канцерогенного эффекта АК связаны с концентрацией внутриклеточного кальция. И вот в 2020 г. появилась работа, которая пытается объяснить связь кальциевого обмена с возникновением опухолей. Ранее было обнаружено, что амплификация хромосомы 17q24.1-24.2 связана с метастазами в лимфатические узлы, размером опухоли и лимфоваскулярной инвазией при инвазивной протоковой карциноме. Ген в этом ампликоне, CACNG4, гамма-субъединица потенциал-управляемых кальциевых каналов L-типа, повышен при раке молочной железы с плохим прогнозом. Гомеостаз кальция достигается путем поддержания низкого уровня внутриклеточного кальция. Изменение механизмов притока/оттока кальция позволяет опухолевым клеткам поддерживать гомеостаз, несмотря на высокий уровень кальция в сыворотке, часто связанный с распространенным раком (гиперкальциемия) и аберрантной передачей сигналов кальция [30].
Аспирин
Положительное влияние аспирина на сердечно-сосудистую систему в значительной степени связано с его антиагрегантными свойствами, в то же время он играет важную роль как противовоспалительный агент в профилактике и лечении рака. В 2014 г. были опубликованы результаты исследования NIH-AARP [31], в котором изучался протективный эффект нестероидных противовоспалительных препаратов (НПВП) в отношении риска развития определенных видов рака – рака, связанного с воспалением, и рака, связанного с конкретными причинами:
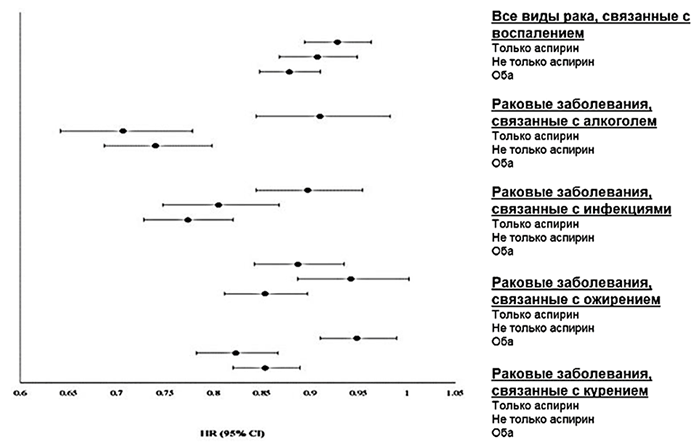
Рисунок 2. Отношения рисков и 95% доверительный интервал для риска развития рака при изолированном использовании аспирина или НПВП или совместном использовании аспирина и НПВП в течение 12 месяцев
Метаанализ, исследующий связь между аспирином и колоректальным раком, обнаружил, что аспирин уменьшает риск колоректального рака на 24% [32]. Этот эффект, по результатам некоторых исследований, может быть связан как с циклооксигеназо-зависимыми, так и с циклооксигеназо-независимыми механизмами [33,34]. Данные о вовлечении в антиканцерогенный эффект аспирина циклооксигеназо-зависимого пути подтверждаются и работами, изучающими выживаемость после лечения опухолей молочной железы и их метастазирование [35]. Тем не менее, существуют и противоречивые данные о влиянии терапии аспирином на онкогенез, например, в отношении рака эндометрия [36]. В то время как некоторые данные указывают на защитные эффекты у женщин с ожирением, другие исследования показали потенциальное вредное влияние этих препаратов на исходы рака эндометрия. Таким образом, будущие исследования в этой области необходимы для выяснения влияния аспирина на выживаемость женщин с опухолями эндометрия, особенно для выявления конкретных групп населения, у которых аспирин может оказывать положительные эффекты. И все же, в целом можно сказать, что аспирин регулирует почти все проявления пула раковых клеток. Внутри опухолевой ткани аспирин подавляет биологическую активность самих раковых клеток и ухудшает микроокружение опухоли, которое поддерживает прогрессирование рака. Помимо опухолевых тканей, блокирование активации тромбоцитов также увеличивает способности аспирина ингибировать прогрессирование ОЗ. С точки зрения молекулярного механизма аспирин воздействует на онкогены и связанные с раком сигнальные пути и активирует некоторые опухолевые супрессоры [37]. Защитное действие аспирина в отношении онкогенеза, возможно, связано с его противовоспалительным действием и действием как кислоты, особенно в случае опухолей желудочно-кишечного тракта.
Статины
Статины – наиболее известный класс препаратов, который позиционируется как способствующий снижению заболеваемости и смертности от ССЗ. Препараты статинов имеют плейотропные эффекты. Многие эксперименты in vitro продемонстрировали противоопухолевое действие статинов против раковых стволовых клеток и определенных клеточных линий через подавление клеточной пролиферации и апоптоза [38]. Статины также обладают сильным противовоспалительным эффектом, который оказывает защитное действие против раковых клеток. Однако некоторые клинические исследования нашли потенциальную связь между статинами и раком [39]. Статины посредством ингибирования гидроксиметилглутарил-КоА-редуктазы (HMGCR), основного фермента пути биосинтеза холестерина, ингибируют путь мевалоната, который обеспечивает изопреноиды для пренилирования различных белков, таких как суперсемейство Ras, которое играет существенную роль в развитии рака. Ингибирование мевалонатного/изопреноидного пути является причиной холестерин-независимых эффектов статинов или плеотропных эффектов. В зависимости от их проникновения во внепеченочные клетки статины по-разному влияют на путь мевалоната/изопреноида. Липофильные статины диффундируют во все клетки, а гидрофильные используют различные мембранные транспортеры, чтобы получить доступ к клеткам, отличным от гепатоцитов. Было высказано предположение, что более низкая доступность статинов для внепеченочных тканей может привести к компенсаторной индукции мевалоната/изопреноидного пути и развитию рака [40]. Тем не менее, большинство популяционных исследований показывают, что статины не влияют на развитие рака, даже снижают риск различных видов рака. Некоторые работы демонстрируют убедительные доказательства улучшения состояния онкологических пациентов, например – безрецидивной выживаемости больных раком молочной железы, которые были на терапии статинами во время постановки диагноза, и снижение риска смертельного рака простаты, если пациенты находились на терапии статинами на момент диагностирования опухоли [41,42]. В одном из метаанализов, который включал тридцать девять когортных исследований и два исследования типа «случай-контроль» с общим числом пациентов 990 649, были проанализированы 3 крупнейшие онкологические подгруппы – колоректальный рак, рак груди и рак простаты. Результаты показали, что применение статинов до или после диагностики рака ассоциируется с улучшением онкологической и общей выживаемости [43]. Считается, что гепатоцеллюлярная карцинома (ГЦК) является основной причиной смертности от рака во всем мире, особенно это касается азиатских стран с высоким распространением гепатита В. В одном из обзоров было показано, что использование статинов связано со сниженным риском развития ГЦК. Авторы работы выразили уверенность, что рандомизированные клинические испытания влияния статинов на развитие ГЦК оправданны, особенно в азиатских популяциях [44]. С этими результатами пересекаются и выводы экспертов, авторов другого метаанализа: использование статинов связано с общим снижением риска рака поджелудочной железы на 30% [45]. Таким образом, можно сделать вывод, что применение статинов является безопасным, а в некоторых случаях и полезным при лечении больных ОЗ. Правда, справедливости ради, надо отметить, что есть работы, предполагающие влияние статинов на возникновение и рецидивирование рака мочевого пузыря [46]. В практике автора этой статьи был случай возникновения карциномы мочевого пузыря у молодого пациента с наследственной гиперхолестеринемией, находящегося на высоких дозах статинов. Вероятно, следует рекомендовать регулярное УЗИ мочевого пузыря у пациентов, принимающих статины.
Вместо заключения
В завершении хочется сказать, что не является секретом тот факт, что лечить болезнь гораздо сложней и опасней, чем ее предотвращать. Это касается и ССЗ и ОЗ. Общности факторов риска ССЗ и ОЗ нами был посвящен целый обзор, подготовленный совместно с сотрудниками МНИОИ им. П.А. Герцена – филиала ФГБУ НМИЦ радиологии Минздрава России и опубликованный в журнале «Кардиология» [47]. В данном контексте очень показательны результаты двух исследований, в которых анализировалось влияние традиционных факторов риска ССЗ на возникновение рака. В исследовании EPIC [48] была поставлена цель проанализировать вероятность возникновения ОЗ у лиц, ведущих здоровый образ жизни (ЗОЖ). В испытание были включены 23 153 участника в возрасте от 35 до 65 лет. Факторы ЗОЖ были определены как отсутствие курения, индекс массы тела (ИМТ) <30 кг/м2, физическая активность (ФА) >3,5 часов в неделю, здоровое питание. После среднего периода наблюдения 7,8 лет участники, которые придерживались всех 4 факторов ЗОЖ, имели гораздо более низкий риск возникновения рака в сравнении с теми, кто не исповедовал принципы ЗОЖ (ОШ 0,64; 95% ДИ 0,43-0,95). Когортное исследование ARIC также анализировало риск возникновения рака у людей (45-64 лет), придерживающихся 7 идеальных маркеров здоровья по классификации Американской ассоциации сердца (AHA). Оказалось, что приверженность хотя бы к 6 из 7 идеальным маркерам здоровья снижала риск возникновения ОЗ (кроме немеланоцитарного рака кожи) на 51% по сравнению с теми, кто не был привержен правилам ЗОЖ, и это после поправки на пол, возраст и этническую принадлежность [49]. Наиболее сильная корреляция с риском возникновения рака была обнаружена у диеты, ФА, ИМТ и курения. Именно сочетание нескольких принципов ЗОЖ приводит впоследствии к снижению риска ОЗ. Несомненно, результаты подобных исследований могут послужить основой для создания рекомендаций по сочетанной профилактике ССЗ и ОЗ.
Эта статья не имеет целью снизить и так невысокую приверженность к лечению пациентов с АГ, например, ведь статья предназначена не для пациентов, хотя меня в этом и упрекали. Данный обзор имеет целью повысить приверженность врачей к более индивидуальному подходу и учету всех аспектов коморбидности у больных с ОЗ в анамнезе в век персонифицированной медицины, тем более что в настоящее время мы имеем большой выбор средств для лечения ССЗ, который нам и позволяет обеспечить этот подход.
Список литературы: