13.01.2023

Метастатическое поражение костей при раке молочной железы остается актуальной проблемой, несмотря на прогресс в ранней диагностике этого заболевания и успехи противоопухолевого лекарственного лечения. Частота метастатического поражения скелета при раке молочной железы (РМЖ) составляет по разным данным 65-75%, незначительно «уступая» лишь раку простаты и множественной миеломе. Возможности лечения пациентов с метастазами в костях расширились благодаря применению препаратов, тормозящих костную резорбцию, – остеомодифицирующих агентов (ОМА), а также новым технологиям дистанционного облучения и инновационным хирургическим техникам [1,2].
Цель применения антирезорбтивной лекарственной терапии – купирование болевого синдрома, предотвращение или отсрочка скелетных событий. Сохраняя плотность костной ткани, обеспечивается качество жизни пациента: сохраняется мобильность, снижается необходимость в постороннем уходе [3,4].
Бисфосфонаты – группа препаратов, аналогов пирофосфата костного матрикса, берет свое начало с создания клодроната в 1992 году. Применение его при РМЖ позволило существенно снизить частоту скелетных событий. Последующие поколения препаратов этой группы показывали все большую эффективность: в 1996 году в клинику пришел памидронат, в 2002-2003 годах – ибандронат и, наконец, золедронат, который явился самым активным бисфосфонатом и прочно занял позиции в клинических рекомендациях по сопроводительной терапии при наличии у больного метастазов в костной ткани любых солидных опухолей. В 2010 году открылись новые возможности в этой области: появился первый и пока единственный таргетный препарат, воздействующий на костную резорбцию, – деносумаб [5,6].
Естественно, все мы понимаем, что применение ОМА является средством сопроводительного лечения, основной эффект несет специфическое противоопухолевое лечение: гормонотерапия, химиотерапия, таргетные препараты. Но поскольку применение костно-направленной терапии при наличии метастазов в костях является обязательной рекомендацией для больных раком молочной железы, вряд ли какой онколог возьмет на себя ответственность лишить больную этой опции лечения [1,8,9]. Несмотря на это, с регулярной периодичностью в медицинских кругах возникает дискуссия о целесообразности применения антирезорбтивных средств у больных с немногочисленными «бессимптомными» метастазами в костях. Почему?
Вот несколько аргументов, ставящих под сомнение необходимость и неотложность остеотропного лечения.
1. Большинство наблюдательных исследований по антирезорбтивной терапии показывают, что отсроченное начало применения этих препаратов не является критичным для пациентов с метастазами рака молочной железы в костной ткани. Так, в большинстве европейских стран время от момента диагностики метастазов в скелете до получения первой дозы ОМА при разных солидных опухолях составляет не менее 3 месяцев. Также известно, что даже регулярное применение антирезорбтивных средств и высокая комплаентность пациентки к лечению не гарантируют отсутствие скелетных осложнений в процессе лечения. Так, согласно данным агентства Министерства здравоохранения и социальных служб США, несмотря на применение ОМА у пациентов все равно развиваются костные осложнения, будь то патологические переломы позвонков или необходимость применения ЛТ. Причем частота их возрастает со временем: так, при РМЖ скелетные события в первые 6 месяцев лечения отмечены у 38,7% больных, а через 2 года – у 54,2% [10,11].
2. А что мы понимаем под понятием «бессимптомные метастазы в костях»?
Как известно, симптомами поражения скелета являются боль (чаще всего), деформации скелета и связанные с этим нарушения мобильности и повседневной жизнедеятельности. В тяжелых случаях, при прогрессировании метастазов и развитии скелетных осложнений, мы имеем клиническую картину перелома, компрессии спинного мозга, метаболических нарушений при гиперкальциемии. А если этих симптомов нет? Нужно ли отказываться от антирезорбтивного лечения? Можно ли считать бессимптомным единственный литический очаг в шейном отделе позвоночника? Вряд ли опытный клиницист оставит такую пациентку без остеотропной терапии. Таким образом, определение «бессимптомности» весьма субъективно. Проще сказать – его не существует.
Врач обязан оценить риск костных осложнений, который определяется следующими факторами:
А если все эти факторы отсутствуют и мы имеем дело с олигометастатическим процессом (1-3 очага), поражены неопорные кости, отсутствуют какие-либо жалобы? На какие моменты стоит еще обратить внимание, чтобы принять оптимальное решение об антирезорбтивной терапии: назначить прямо сейчас или позже?
3. Как известно, РМЖ относится к опухолям, чувствительным к лекарственному лечению. Подавляющее число случаев РМЖ является люминальным раком. Еще до эры молекулярных подтипов РМЖ онкологам было известно, что поражение костей характерно для гормонозависимого рака. Сама гормонотерапия оказывает положительное влияние на репарацию костной ткани. По опросам врачей-онкологов из 6 европейских стран, показаниями для назначения ОМА в рутинной клинической практике являются наличие болевого синдрома и угроза деструкции кости. В остальных случаях применение данной группы препаратов может быть отложено, а ряд специалистов вообще предпочитает провести оценку эффективности основного противоопухолевого лечения, а только затем добавить ОМА [3,10,14].
4. К сожалению, не существует данных о выживаемости больных с поражением костной системы при применении ОМА и без них. Современные стандарты лечения не подразумевают отказ от ОМА при наличии МТС в костной ткани, а сравнение современных данных с данными о выживаемости пациентов «добисфосфонатной» эры некорректно, ведь сфера лекарственного лечения рака молочной железы насыщена инновациями, практически ежегодно в клиническую практику вводятся новые препараты, способные сами по себе существенно улучшать эффективность лечения. Мы знаем, что ОМА способны отсрочить скелетные события у этой категории больных, хотя и это утверждение может быть спорным, поскольку разграничить долю ОМА и противоопухолевого агента в этом эффекте невозможно [4,5,15].
5. Метастазы в костной ткани при раке молочной железы, как правило, носят смешанный характер, то есть содержат как литические, так и бластические участки. Для клинициста важно не столько определение типа метастаза, сколько их локализация в скелете. Излюбленными костями для метастазирования являются позвоночный столб (особенно грудной и поясничный отделы), кости таза; реже – ребра, трубчатые кости, свод черепа; крайне редко – мелкие кости конечностей, лицевой скелет [1,4,5]. Таким образом, если у пациентки имеются метастазы в костях опорного скелета, откладывать антирезорбтивную терапию не стоит. За очагами, расположенными, скажем, в ребрах или костях черепа, можно наблюдать.
6. Безопасность остеомодифицирующих препаратов и мониторинг возможных токсических явлений.
Наиболее частым побочным явлением бисфосфонатов является их нефротоксичность. Частота НЯ со стороны почек при применении золедроновой кислоты составляет около 12%, деносумаб не обладает почечной токсичностью, однако в большей степени способствует гипокальциемии (5-13% по сравнению с 3,4-6% при применении ЗК). Данное состояние, как правило, протекает без выраженных клинических симптомов и регистрируется лишь лабораторно. Гипокальциемия является противопоказанием для введения ОМА. Также обязательным условием лечения БФ является определение уровня креатинина, прием препаратов кальция и витамина Д [1,5,6,16].
Таким образом, взвесив соотношение «риск-польза», назначение ОМА у пациентов с ХБП нужно отложить, хотя бы до окончания химиотерапии. Такая же тактика должна быть при отсутствии возможности регулярно выполнять лабораторный мониторинг во избежание гипокальциемии.
Пожалуй, самым грозным осложнением использования антирезорбтивных средств является остеонекроз челюсти. Частота его возрастает с длительностью терапии и составляет при применении золедроновой кислоты по литературным данным от 1,2% до 6,2%, при применении деносумаба – от 1,8-4,2%. Совместное использование ОМА с антиангиогенными препаратами, кортикостероидами резко повышает вероятность возникновения данного осложнения. Клиника остеонекроза часто стерта и диагностируется только при участии стоматолога. В 65% случаев провоцирующим фактором является экстракция зуба; из всех описанных случаев более чем в 70% поражается нижняя челюсть. Купирование данного осложнения не всегда простая задача. Применяются как консервативные методы (полоскания, антибиотикотерапия, аппликации), так и хирургические (удаление секвестров и даже резекция кости) [1,9,16,17].
Контролировать состояние полости рта пациентов в реальной практике онкологу весьма проблематично. Поэтому пациентке с наличием стоматологической патологии, скажем, зубов с плохим прогнозом, плохо контролируемых зубных конструкций, а также пациентке, планирующей в ближайшей перспективе протезирование зубов, не стоит назначать ни деносумаб, ни золедроновую кислоту. Прибегнуть к этому лечению можно, только удостоверившись в удовлетворительном состоянии зубов и десен.
7. Прогноз жизни пациента определяется висцеральными метастазами.
Полное излечение при метастатическом раке молочной железы невозможно. Особую категорию пациенток представляют больные, у которых помимо метастазов в костях есть множественные висцеральные метастазы. Клиническая практика показывает, что именно диссеминация опухоли в печень, легкие и другие органы (часто головной мозг) определяет прогноз пациентки. Так, продолжительность жизни у больных только с поражением скелета составляет 2,1 года, а при наличии еще и висцеральных метастазов – 1,6 года [12]. Назначение антирезорбтивной терапии в таких случаях представляется нецелесообразным, поскольку процесс костного ремоделирования биологически не быстрый, занимает, как правило, от нескольких месяцев до 1 года. Ни бисфосфонаты, ни деносумаб просто не успеют оказать свое терапевтическое действие. Поэтому важно оценить ожидаемую продолжительность жизни у пациентов с диссеминированным опухолевым процессом.
8. Трудности интерпретации при визуализации костных очагов.
Несмотря на прогресс диагностических методов, остается актуальной проблема оценки эффективности лечения. Традиционно изотопные методы являются методами первичного выявления очагов в костной ткани. Подтверждающими наличие метастазов в скелете являются рентгеновские методы: рентгенография, КТ и МРТ. В процессе лечения интерпретация визуальной картины метастазов в скелете вызывает затруднения даже у специалистов высокого уровня. Появление бластических изменений рядом рентгенологов рассматривается как репарация рентген-негативных очагов (литических участков или исходно «нормальной» костной ткани), другими специалистами нередко расценивается как прогрессирование процесса, что ведет к необоснованной смене противоопухолевого лечения. Клиницисту не всегда просто принимать решение о динамике состояния скелета при исходно бессимптомном течении болезни и отсутствии некостных очагов. Вывод: отсутствие четкой трактовки характера очагов в костной ткани – повод воздержаться от остеотропной терапии [1,9].
9. Деэскалация остеомодифицирующей терапии на примере исследований с более редким (1 раз в 3 месяца) введением золедроновой кислоты не показала отрицательных последствий: из 820 больных РМЖ, участвовавших в рандомизированном исследовании II фазы, скелетные осложнения отмечены у 113 пациенток из группы ежемесячного применения и у 119 пациенток из группы 3-месячного. Плюсы такого подхода – снижение числа нежелательных явлений вдвое: остеонекроза челюсти (18 случаев против 9), нефротоксичности (11 случаев против 5), а также несомненный фармакоэкономический выигрыш (расход препарата, сокращение лабораторных тестов, посещений врача) [18].
10. Существуют литературные данные о влиянии образа жизни на прогноз как появления метастазов в костной ткани, так и развития ряда осложнений, в частности, остеонекроза челюсти. Исследование японских авторов во главе с Tanda N. и др. посвящено корреляции между чувствительностью к алкоголю и частотой метастазирования в кости и связанных со скелетом событий при первичном операбельном раке молочной железы. Гиперчувствительность к алкоголю определяется генетическим дефицитом фермента алкогольдегидрогеназы-2, в результате чего нарушается метаболизм этанола в организме, создается избыточная концентрация эндогенного ацетальдегида, что проявляется покраснением лица, тошнотой, тахикардией. Изменяется микробиота полости рта, нарушаются процессы кроветворения и другие более сложные метаболические каскады. Ретроспективное когортное исследование, в которое были включены 332 пациентки, позволило доказать, что женщины с повышенной чувствительностью к алкоголю (N=45) в большей степени подвержены метастазированию в кости, чем женщины с низкой чувствительностью (N=287): 60,6% по сравнению с 25,1% соответственно; у них чаще возникли скелетные осложнения: 22,3% по сравнению с 9,0%. Один случай ОНЧ в этом исследовании также зарегистрирован в группе больных с дефектом фермента алкогольдегидрогеназы-2 [19].
Выводы
Суммируя имеющуюся информацию, «клинический портрет» пациентки, у которой имеется низкий риск костных осложнений и которой не стоит торопиться назначать остеомодифицирующую терапию, представляется следующим:
Несомненно, решение о том, какие из вышеперечисленных факторов будут превалировать в решении назначить ОМА или подождать, будет принимать врач или, лучше, мультидисциплинарная команда. Оценивать показания к назначению бисфосфонатов или деносумаба необходимо регулярно на протяжении всего периода лечения пациентки.
В заключение еще раз акцентирую внимание на том, что вышеприведенные доводы относятся не ко всем больным, а только лишь к той немногочисленной категории, которой можно не спешить с назначением остеомодифицирующей терапии, несмотря на клинические рекомендации.


Рак молочной железы (РМЖ) является онкологическим заболеванием, характеризующимся частым метастазированием в кости (65-80%). Наиболее часто поражаются поясничные (59%) и грудные (57%) отделы позвоночника, кости таза (49%) и рёбра (30%), то есть преимущественно вовлекаются в процесс кости осевого скелета [1]. Различают три типа метастазов в зависимости от особенностей патологического процесса: остеолитические, остеобластические и смешанные. Для РМЖ наиболее характерны остеолитические (не менее 50%) и смешанные метастазы, но и частота поражения, характеризующегося как остеобластное, может достигать 10-15% [2]. Наиболее характерны метастазы в кости для люминальных и Her-2 позитивных типов РМЖ [3].
Клиническими проявлениями метастазов в кости являются болевой синдром, снижение качества жизни, а также так называемые скелетные события, или костные осложнения (единого термина в русскоязычной литературе нет), которые включают необходимость облучения или хирургического вмешательства, патологические переломы, компрессию спинного мозга и гиперкальциемию. Наиболее часто, до 70% случаев, метастазы в кости при РМЖ клинически манифестируют болевым синдромом, менее 15% пациенток на этапе установки диагноза РМЖ с метастазами в кости не имеют болевого синдрома [4]. До 40% пациенток, включаемых в исследования по лечению метастазов РМЖ в кости, имеют в анамнезе скелетные осложнения [5].
Применение в дополнение к противоопухолевой терапии РМЖ остеомодифицирующих агентов (ОМА) – препаратов, уменьшающих костную резорбцию, – позволяет уменьшить выраженность клинических проявлений метастазов в кости и частоту скелетных осложнений, увеличить время до их появления [5]. Наиболее распространенный и доступный класс остеомодификаторов – это бисфосфонаты (БФ). По своей химической структуре они являются аналогами пирофосфатов костного матрикса. БФ связываются с кальцием, накапливаются в костях, утилизируются зрелыми остеокластами, угнетая их активность. По наличию или отсутствию атома азота БФ определяют как азотсодержащие или неазотсодержащие. Неазотсодержащие БФ (клодронат, этидронат и др.) действуют посредством цитотоксического влияния на остеокласты, тогда как азотсодержащие БФ (памидронат, ибандронат и золедронат) оказывают на них прямое апоптотическое действие [6-8]. Как и любые лекарственные препараты, БФ имеют свой спектр токсичности, где наиболее значимы неблагоприятное влияние на функцию почек и остеонекроз нижней челюсти [9].
Другой класс остеомодификаторов – блокаторы RANK лиганда, представленные пока единственным препаратом деносумабом. Это таргетный препарат, который представляет собой полностью гуманизированное моноклональное антитело к RANK лиганду [10,11]. Ключевым звеном гомеостаза костной ткани, регулирующим дифференцировку остеокластов и остеолиз, является лиганд-рецепторная система RANK/RANKL/OPG, где RANK (Receptor activator of nuclear factor kappa-B) – рецептор-активатор, экспрессируемый на поверхности остеокластов и их предшественников, RANKL – лиганд, секретируемый остеобластами, связывающийся с внеклеточным доменом RANK и запускающий процессы остеокластогенеза и активации зрелых остеокластов, и остеопротегерин (OPG), секретируемый остеобластами природный антагонист RANKL, связывающий его и блокирующий взаимодействие с RANK [12]. Деносумаб является по сути синтетическим аналогом остеопротегерина. Среди наиболее значимых недостатков данного препарата – феномен рикошетного остеолиза при отмене и достаточно высокая стоимость такого лечения.
Американское общество NCCN рекомендует применение ОМА при РМЖ в дополнение к химиотерапии или эндокринной и таргетной терапии во всех случаях, когда есть костные метастазы и ожидаемая продолжительность жизни при этом составляет ≥3 месяцев [13], Европейское и Российское профессиональные сообщества – в любом случае при наличии метастазов в кости [14,15].
При этом в отношении назначения ОМА при метастазах в кости опухолей других локализаций все рекомендации не так категоричны. Так действительно ли раннее назначение ОМА при РМЖ с метастазами в кости является необходимым?
К сожалению, нет данных рандомизированных исследований, позволяющих определить, все ли пациенты с костными метастазами РМЖ нуждаются в назначении ОМА сразу же после подтверждения диагноза, в частности – пациенты с бессимптомными метастазами. Однако в отношении именно этой нозологии такой подход (пока не имеется результатов исследований с высокой степенью доказательности, доказывающих обратное) представляется оправданным.
1. Резорбция кости при метастатическом поражении повышена в любом случае, следовательно, необходимо раннее начало терапии антирезорбтивными препаратами, даже при отсутствии клинических проявлений.
Костная ткань является динамической системой, в ней непрерывно происходят процессы ремоделирования в объеме Базовой многоклеточной единицы (БМЕ) – функционально объединенной совокупности остеокластов, разрушающих кость, остеобластов, формирующих кость, и остеоцитов, поддерживающих кость, во временной полости ремоделирования кости. Процессы остеолиза и остеобразования происходят параллельно, как в норме, так и при патологии. Опухолевые клетки выделяют факторы, стимулирующие резорбцию костной ткани остеокластами, влияющие на активность остеобластов путем ингибирования (при остеолитических очагах) или стимулирования (при остеобластных очагах) образования костной ткани [10,16].
Ключевой причиной активации резорбции кости при метастатическом поражении является паратгормон-подобный пептид, в большом количестве секретируемый клетками РМЖ, стимулирующий остеокластогенез и резорбцию кости. Выделяемые во время резорбции костной ткани ростовые факторы, в свою очередь, стимулируют рост опухолевых клеток [10,16]. В механизме формирования остеобластных метастазов ключевую роль в настоящее время отдают Эндотелину-1-пептиду, который также секретируется клетками РМЖ и является мощным стимулятором остеобластов и формирования костной ткани.
В целом течение остеобластных метастазов считается более благоприятным из-за меньшей выраженности болевого синдрома и меньшей угрозы скелетных осложнений. Тем не менее, патологическое костеобразование делает кости утолщенными, жесткими, негибкими, хрупкими, что увеличивает вероятность патологических переломов и приводит к трофическим и неврологическим нарушениям [6]. При этом резорбция костной ткани при метастатическом поражении в остеобластных очагах повышена нисколько не в меньшей степени, чем в остеолитических. Это подтверждается повышенным уровнем маркеров костной резорбции при остеобластном поражении. Ингибирование рецептора Эндотелина-1 блокирует не только активацию остеобластов, но и резорбцию костной ткани [6]. ОМА с любым механизмом действия снижают интенсивность резорбции, замедляя процессы разрушения нормальной кости и замещения ее клетками опухоли в случае остеолитических метастазов либо клетками опухоли и патологической костной тканью в случае метастазов остеобластных [17].
2. Взаимодействие RANK и RANKL является не только основным звеном в «порочном круге» костной деструкции, но и играет важную роль в формировании и функционировании молочных желез, развитии и метастазировании РМЖ, противоопухолевом иммунном ответе. Блокада взаимодействия RANK-RANKL может расцениваться как этиопатогенетическое лечение при РМЖ независимо от наличия или отсутствия клинической симптоматики.
Как уже упоминалось, ключевым звеном гомеостаза костной ткани является лиганд-рецепторная система RANK/RANKL/OPG [10-12]. Однако значение взаимодействия RANK-RANKL не ограничивается исключительно процессами ремоделирования кости [18]. В частности, в формировании лобуло-альвеолярных структур молочных желез, необходимых для лактации, взаимодействие RANK-RANKL также играет важную роль. В эксперименте после блокады RANKL или RANK у мышей не развивалась молочная железа во время беременности должным образом [19]. Передача сигналов RANKL-RANK вовлечена во все стадии онкогенеза [20]. При этом клетки РМЖ сами экспрессируют RANKL: постоянная высокая экспрессия RANKL наблюдается в опухолях и клеточных линиях РМЖ [19]. Доказана корреляция высокой экспрессии RANKL и склонности к метастазированию в кости на моделях у мышей для клеток РМЖ [21]. Возможно, эти данные дают ключ к пониманию того, почему РМЖ так часто метастазирует в кости и для него характерны преимущественно остеолитические метастазы.
Немаловажным моментом также является участие пути RANK-RANKL в развитии и функционировании иммунной системы, а именно – в развитии лимфатических узлов, формировании и дифференцировке В- и Т-клеток, стимуляции и угнетении противоопухолевого иммунитета) [22].
Исходя из вышеизложенного, блокада взаимодействия RANK-RANKL может расцениваться как этиопатогенетическое лечение при РМЖ.
3. РМЖ в большинстве случаев гормонозависим, и в этом процессе взаимодействие RANK и RANKL имеет значение. Блокада данного взаимодействия может являться дополнительным вкладом в эффективную противоопухолевую терапию люминального РМЖ.
Большинство случаев РМЖ относится к числу гормонозависимых опухолей. Известно, что прогестерон частично через взаимодействие RANK и RANKL опосредует пролиферацию эпителия молочных желез [23,24] и онкогенез [25]. В ряде исследований показано, что блокада RANKL в гормоноиндуцированном РМЖ приводит к уменьшению инвазивного [26,27] и пролиферативного потенциала опухолевых клеток [28]. Рак молочной железы, ассоциированный с мутациями BRCA1, также может быть опосредован RANK/RANKL. В экспериментальных моделях инактивация RANK приводила к уменьшению частоты и увеличению времени развития РМЖ, а также к замедлению прогрессирования уже возникших опухолей, а ингибирование RANKL приводило к предотвращению онкогенеза [29].
4. Для всех ОМА в многочисленных рандомизированных исследованиях доказано снижение частоты и риска скелетных осложнений, увеличение времени до возникновения скелетных осложнений при РМЖ, снижение необходимости лучевых и хирургических методов лечения для всех сравниваемых подгрупп, в том числе – для пациенток с отсутствующим либо слабым болевым синдромом.
Даже при отсутствии клинических проявлений метастазов в кости на ранних этапах их формирования всегда присутствует высокий риск костных осложнений. При РМЖ, в отличие от других ЗНО, скелетные осложнения в течение 2 лет регистрируются наиболее часто – в 64%, для сравнения: при раке простаты – в 49%, при раке легкого и других злокачественных опухолях – в 46% [30-33]. В настоящее время нет достоверных способов прогнозирования того, у каких пациентов разовьются скелетные осложнения. Тем не менее, первое скелетное осложнение часто возникает достаточно рано от момента метастатического поражения костей. Так, в регистрационном исследовании, сравнивающем деносумаб с золедроновой кислотой, 37% пациентов уже пережили скелетные осложнения до включения в исследование в среднем всего через 2 месяца после выявления костных метастазов [24,34].
Более 2 десятков рандомизированных исследований (24), в которых участвовали почти 11 тысяч пациенток, были посвящены изучению эффективности и безопасности ОМА при РМЖ с метастазами в кости. Польза ОМА при метастазах РМЖ в кости в отношении скелетных осложнений доказана и несомненна: это снижение риска и частоты, увеличение времени до первого и последующих скелетных осложнений, а в некоторых исследованиях – улучшение результатов лечения в плане выживаемости (при нормализации маркеров костной резорбции). При этом в большинстве исследований изучаемый ОМА демонстрирует преимущество перед группой сравнения в большинстве или всех стратицификационных подгруппах [5]. Кроме того, данный анализ показал, что для женщин с ранним РМЖ БФ снижают риск метастазов в кости и обеспечивают улучшение общей выживаемости по сравнению с плацебо или наблюдательной тактикой, особенно при раннем начале терапии (рис.1). Имеются данные, свидетельствующие о том, что БФ улучшают общую и безрецидивную выживаемость у женщин в постменопаузе только по сравнению с плацебо или отсутствием БФ (рис.2).
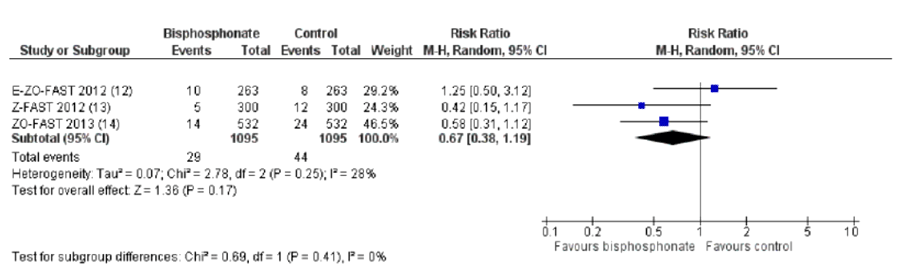
Рисунок 1. Влияние БФ на частоту костных метастазов при раннем РМЖ: немедленное назначение vs отсроченное назначение.
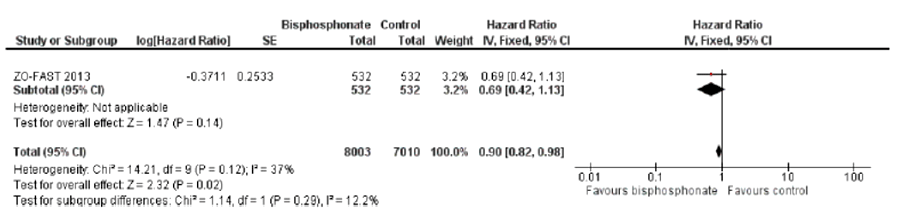
Рисунок 2. Влияние БФ на общую выживаемость при раннем РМЖ: немедленное назначение vs отсроченное назначение.
Наиболее высок риск костных событий у больных с остеолитическими метастазами, и БФ значимо влияют на этот процесс. Так, например, в рандомизированном двойном слепом плацебо-контролируемом исследовании по изучению эффективности памидроната в сравнении с плацебо в сочетании с химиотерапией при РМЖ с метастазами в кости доля пациенток, у которых возникли какие-либо скелетные осложнения, была достоверно ниже (43% и 56% соответственно), а среднее время до первого скелетного осложнения увеличилось в 2 раза (13,9 и 7,0 мес. соответственно) [35]. У пациенток с литическими метастазами РМЖ в кости, получающих гормональную терапию, памидронат также значительно снижал частоту скелетных осложнений и увеличивал время до их возникновения в сравнении с плацебо. Через 24 месяца от начала терапии доля пациентов со скелетными осложнениями составила 56% в группе памидроната и 67% в группе плацебо, а медианы времени до первого скелетного осложнения составили 13,8 и 7,0 мес. [36]. Для оценки долгосрочной эффективности и безопасности памидроната были объединены результаты этих двух исследований, при анализе получены аналогичные данные с высокой степенью достоверности: снижение количества скелетных осложнений по сравнению с плацебо на 13% (51 и 64% соответственно, р<0,001) и увеличение медианы времени до появления первых скелетных осложнений с 7 до 12,7 мес. (р<0,001) [30].
Самым эффективным из БФ является золедроновая кислота, которая в ряде рандомизированных исследований продемонстрировала преимущество перед другими БФ в отношении скелетных осложнений [5].
В рандомизированное исследование фазы III по сравнению эффективности золедроновой кислоты и памидроната были включены в общей сложности 1130 пациенток, у которых были все типы костных метастазов по данным рентгенологического исследования (остеолитические, смешанные или остеобластные). Количество пациенток со скелетными осложнениями было практически одинаковым в общей популяции (43% и 45%), а при наличии хотя бы одного остеолитического очага – на 10% меньше в группе золедроновой кислоты (48% против 58%), хотя эти различия и не достигли статистической значимости. Но при этом медиана времени до первого скелетного осложнения была значительно больше при лечении золедроновой кислотой в сравнении с памидронатом (310 и 174 дней соответственно, р=0,013). Кроме того, риск развития скелетных осложнений в группе золедроновой кислоты был достоверно ниже – на 20% для всех пациентов (р=0,037) и на 30% в подгруппе с остеолитическими очагами (р=0,010). Отдельно по результатам этого исследования были проанализированы данные для пациенток с остеобластными метастазами. Для них также отмечено снижение частоты и риска скелетных осложнений и увеличение времени до их появления [29].
По данным рандомизированных исследований рекомендовано применение золедроновой кислоты и памидроната в США, ибандроната, клодроната и золедроновой кислоты в европейских странах.
Что же касается блокатора RANKL, то деносумаб, в свою очередь, в регистрационном исследовании продемонстрировал преимущество перед золедроновой кислотой при метастазах РМЖ в кости в отношении времени до первого и последующих скелетных осложнений на 18% (р=0,001). Снижение маркеров костной резорбции также было более выраженным при применении деносумаба [29].
5. Увеличение времени до появления/усиления болевого синдрома, улучшение качества жизни, снижение уровня потребления анальгетиков отмечается в подгруппах с низким и отсутствующим болевым синдромом, то есть и среди пациенток, не имеющих клинической симптоматики.
К сожалению, в проведенных исследованиях пациентки с бессимптомными метастазами (без болевого синдрома и скелетных осложнений в анамнезе) не выделялись в отдельную подгруппу для анализа. Там, где была проведена стратификация по уровню болевого синдрома, больные объединялись в подгруппы с отсутствующим и легким болевым синдромом и с умеренным и выраженным. При этом в большинстве исследований, как и для скелетных осложнений, отмечается преимущество БФ над плацебо, золедроновой кислоты над более ранними БФ и деносумаба над золедроновой кислотой [5].
В рандомизированном двойном слепом плацебо-контролируемом исследовании по изучению эффективности внутривенного ибандроната у пациенток с метастазами РМЖ в кости препарат в дозировке 6 мг каждые 3-4 недели показал значительное уменьшение болевого синдрома и улучшение качества жизни. Так, по сравнению с исходными показателями оценка боли в костях по 5-балльной шкале была значительно ниже у пациентов, получавших ибандронат, в отличие от плацебо. Значительное и достоверное улучшение качества жизни было продемонстрировано у пациентов, получавших ибандронат, в отношении физического, эмоционального и социального функционирования, а также общего состояния здоровья (р<0,05) [37]. В другом исследовании в группе памидроната в сравнении с плацебо отмечено достоверно меньшее количество пациенток с усилением боли в костях (р =0,046) и ухудшением общего состояния (р<0,05) [35,38]. В объединенном анализе двух рандомизированных исследований по оценке эффективности и безопасности памидроната показатели боли и использования анальгетиков были значительно лучше в группе памидроната в сравнении с плацебо, в том числе и среди пациенток с изначально отсутствующим или легким болевым синдромом [30].
Золедроновая кислота в отношении снижения выраженности болевого синдрома продемонстрировала сходные результаты с памидронатом и ибандронатом [5]. Но деносумаб у пациентов с РМЖ с метастазами в кости имел преимущество в сравнении с золедроновой кислотой в регистрационном исследовании. Около 15% пациенток, включенных в исследование, не имели исходно болевого синдрома. Подгруппа с отсутствующим и легким болевым синдромом, куда вошли эти пациентки, имела значимое преимущество во времени до усиления болевого синдрома и связанных с этим составляющих оценки качества жизни, а также использовании наркотических анальгетиков. Медиана периода до развития умеренного или тяжелого болевого синдрома у больных без боли или с легкой болью в костях на момент включения в исследование составила 9,7 мес. в группе деносумаба и 5,8 мес. в группе золедроновой кислоты (р=0,0024), а среди пациенток, у которых не было болевого синдрома исходно, умеренная или выраженная боль на 73 неделе исследования отмечена в 14,8% при использовании деносумаба и в 26,7% при использовании золедроновой кислоты [5,29,39]. На опиоидные анальгетики перешли на 20% меньше пациенток в группе деносумаба, медиана времени до начала использования наркотических анальгетиков в группе золедроновой кислоты составила 29,5 мес., в группе деносумаба не была достигнута [39].
6. Непосредственное противоопухолевое действие и другие полезные терапевтические эффекты (антиангиогенное, иммуномодулирующее и даже химиопотенциирующее действие) ОМА могут иметь значение для проведения противоопухолевого лечения РМЖ.
Помимо антирезорбтивного, ОМА могут оказывать непосредственное противоопухолевое, антиангиогенное и иммуномодулирующее действие [6]. Так, в доклинических исследованиях азотсодержащие бисфосфонаты продемонстрировали способность ингибировать ангиогенез, клеточную адгезию, и активность матриксных металлопротеиназ [40-46]. В экспериментах на культурах клеток установлено, что обработка БФ клеток РМЖ разных линий приводит к апоптозу опухолевых клеток, то есть данные препараты оказывают прямое противоопухолевое действие на клетки РМЖ человека [47,48]. При этом золедроновая кислота превосходит по активности ибандронат и клодронат. Также БФ продемонстрировали способность ингибировать инвазию опухолевых клеток дозозависимым образом [49]. Имеются сведения об иммуномодулирующем действии БФ [50-52]. БФ стимулируют естественный противоопухолевый иммунный ответ, активируя T-клетки [53], а золедронат, вдобавок к этому, способен генерировать опухолесупрессирующие стромальные клетки костного мозга (BMSC) в мышиных моделях РМЖ [54]. Таким образом, БФ могут усиливать противоопухолевое действие основных препаратов и способствовать профилактике дальнейшего метастазирования.
Также имеются сведения о непосредственном противоопухолевом и иммуномодулирующем действии и блокатора RANK-лиганда [53]. Деносумаб, ингибируя путь RANK-RANKL, оказывает как прямое, так и косвенное противоопухолевое действие. Прямое противоопухолевое действие деносумаба связывают с блокадой прямого стимулирующего действия RANKL на опухолевые клетки, экспрессирующие RANK [20].
Имеются данные сравнения противоопухолевого действия деносумаба с золедроновой кислотой. Ингибирование RANKL приводило к уменьшению костных опухолей, в отличие от золедроновой кислоты, на мышиных моделях в исследовании Д. Джонс [55]. В другой модели РМЖ размеры опухолей в кости уменьшались как при ингибировании RANKL, так и при лечении золедроновой кислотой, но при ингибировании RANKL это действие было более выраженным [57]. Дополнительные доказательства прямого действия RANKL на опухолевые клетки, экспрессирующие RANK, были получены в исследованиях Gonzalez-Suarez et al. [58]. Используя мышиные модели трансгенного и ортотопического РМЖ, которые характеризуются высокой частотой метастазирования в легкие, авторы смогли показать, что ингибирование RANKL уменьшало метастазы в легких. Также Yoldi и соавт. продемонстрировали, что ингибирование RANKL у мышей приводило к уменьшению частоты метастазирования в легкие за счет повышения дифференцировки опухолевых клеток [59]. Таким образом, на экспериментальных моделях доказано, что ингибирование RANKL способно прямым образом снижать частоту скелетных и висцеральных метастазов.
РМЖ относится к числу гормонозависимых опухолей эпителия молочных желез. Блокада RANKL в клетках гормоноиндуцированного РМЖ приводит к уменьшению инвазивного [60] и пролиферативного потенциала опухолевых клеток [27]. Кроме того, отмечено положительное влияние блокады RANK при рецидиве РМЖ в виде повышения дифференцировки опухолевых клеток и повышения чувствительности к лечению доцетакселом в эксперименте, таким образом, имеет место определенный химиопотенциирующий эффект [27]. РМЖ, вызванный мутациями BRCA1, также может быть опосредован RANK/RANKL. В моделях на мышах, имитирующих дефицит BRCA1, ингибирование RANKL приводило к уменьшению опухолей молочной железы [61]. В другом исследовании инактивация RANK приводила к уменьшению частоты и увеличению времени развития РМЖ, а также к замедлению прогрессирования уже возникших опухолей, а ингибирование RANKL приводило к предотвращению онкогенеза [28].
Считается, что косвенные противоопухолевые эффекты возникают за счет изменения микроокружения в кости и влияния ингибиторов RANKL на иммунные клетки [22,25]. Косвенный противоопухолевый эффект ингибирования RANKL реализуется через иммунную систему [22,62]. Инфильтрирующие опухоль регуляторные Т-клетки, экспрессирующие RANKL, способствуют развитию метастазов в легкие на моделях РМЖ путем создания и поддержания этого иммуносупрессивного микроокружения, способствующего опухолевому росту и метастазированию [63]. Ингибирование RANKL временно блокирует толерантность Т-клеток к клеткам опухоли, что приводит к улучшению противоопухолевого ответа [21,64]. Таким образом, иммуноопосредованный противоопухолевый эффект деносумаба вполне вероятен, хотя убедительных доклинических и клинических доказательств в настоящее время недостаточно.
7. Нежелательные явления ОМА: есть данные о безопасности длительного применения и возможности коррекции режима.
Одной из возможных причин для отказа от применения бисфосфонатов являются имеющиеся или ожидаемые нежелательные явления (НЯ), особенно почечная токсичность. Тем не менее, есть данные о профиле безопасности БФ, сравнимом с плацебо.
Так, всем пациенткам, завершившим двойное слепое рандомизированное исследование по изучению эффективности ибандроната в течение 96 недель, было предложено открытое активное лечение еще на 96 недель (расширенная фаза), пациентки были стратифицированы в зависимости от предшествующего лечения – ибандронат или плацебо. В течение 4 лет в расширенной фазе исследования было зарегистрировано меньше НЯ, связанных с лечением (6,3% у пациенток, ранее получавших плацебо, и 13,0% – у получавших ранее ибандронат), чем в начальной фазе исследования (плацебо – 56,3%, ибандронат – 67,4%). Серьезные НЯ были в основном связаны с прогрессированием злокачественного новообразования. Клинически значимых НЯ со стороны почек не было, и в обеих группах уровень креатинина в сыворотке был одинаковым в течение 4 лет [65,66].
Кроме того, влияния на профиль безопасности БФ можно добиться путем снижения интенсивности терапии без потери в эффективности. В трех рандомизированных исследованиях сравнивали эффективность золедроновой кислоты, вводимой каждые 4 недели, в сравнении с введением каждые 12 недель. В исследование ZOOM включались пациентки, которые ранее получали ежемесячное введение золедроновой кислоты в течении 12-15 месяцев. Частота скелетных осложнений достоверно не отличалась в группе 12 недель по сравнению с ежемесячным введением. Наиболее частыми побочными явлениями 3-4 степени были боль в костях, тошнота и астения, нефротоксичность и остеонекроз челюсти развивались редко, без достоверных различий в зависимости от режима введения [67]. Отмечена возможность уменьшения интенсивности лечения золедроновой кислотой без потери терапевтического эффекта. Однако увеличение концентрации маркера костной резорбции N-концевого телопептида по сравнению с исходным уровнем в группе 12-недельного лечения (12% и 0%) вызывает некоторую настороженность в отношении такого подхода [68]. В другом крупном рандомизированном открытом клиническом исследовании CALGB, в которое были включены пациенты с метастатическим РМЖ, метастатическим РПЖ или множественной миеломой, у одинакового количества пациентов (менее 30%) в группах 4-недельного и 12-недельного введения в течение 2 лет после рандомизации возникло как минимум одно скелетное осложнение. Таким образом, снижение интенсивности дозирования золедроновой кислоты не приводило к увеличению риска скелетных осложнений течение 2 лет. Частота развития НЯ, в частности, остеонекроза челюсти и нарушения функции почек, были сопоставимы [69]. В рандомизированное исследование OPTIMIZE-2 включались пациентки с РМЖ, которые ранее получали золедроновую кислоту и/или памидронат в стандартном режиме. Через 1 год наблюдения скелетные осложнения возникли у 22,0% пациентов в группе золедроновой кислоты каждые 4 недели и у 23,2% пациентов в группе золедроновой кислоты каждые 12 недель, и время до первого скелетного осложнения между группами лечения статистически значимо не различалось. Профили безопасности в группах были сопоставимы [29,69].
При сравнении профилей безопасности БФ и деносумаба и золедроновой кислоты при лечении блокатором RANKL отмечена более высокая частота гиперкальциемии, при использовании БФ чаще регистрируются почечная токсичность и острофазовые реакции, частота развития остеонекроза нижней челюсти на фоне терапии деносумабом и БФ достоверно не отличается [29].
Имеются данные о безопасности длительного применения деносумаба [70,71]. Снижение интенсивности терапии деносумабом не было изучено, но фармакокинетика препарата свидетельствует против такого подхода.
Выводы
Таким образом, особенности биологии РМЖ таковы, что именно эта опухоль обладает наибольшим остеодеструктивным потенциалом. Поэтому отказ от применения ОМА сразу же после диагностики метастазов в кости при РМЖ в настоящее время представляется нецелесообразным, даже при бессимптомном процессе и/или относительно благоприятном молекулярно-генетическом (люминальном) подтипе опухоли. Кроме того, непосредственное противоопухолевое, антиангиогенное и иммуномодулирующее действие ОМА может быть значимым компонентом эффективной противоопухолевой терапии. При этом, учитывая значение взаимодействия RANK-RANKL для онкогенеза РМЖ, использование в качестве первого ОМА блокатора RANKL при РМЖ является предпочтительным.
Всего проголосовало: 73
Доводы, отраженные в п.4 не относятся к самой теме дискуссии.
Представленные данные (рис. 1 и рис. 2) касаются адъювантного применения БФ у женщин с РАННИМ РМЖ.
Мы же обсуждаем метастатический процесс.