19.03.2021

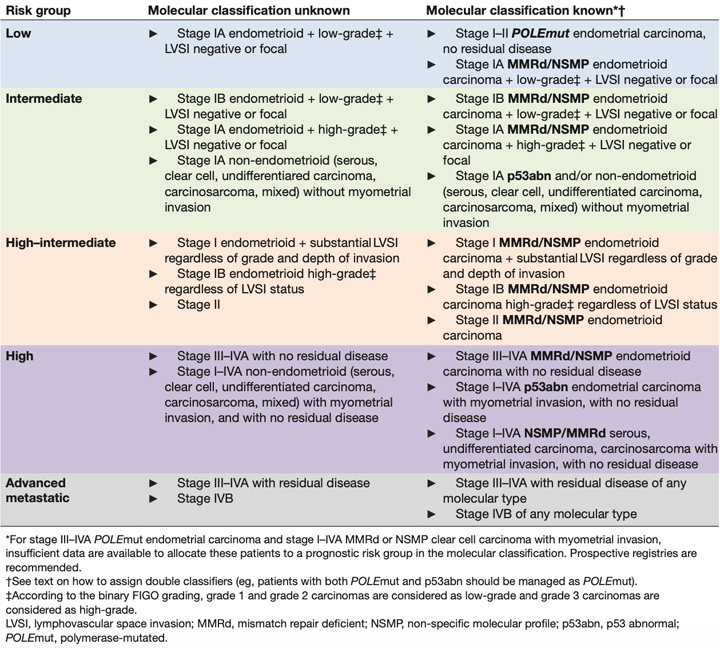
Рак эндометрия (РЭ) – самое распространенное заболевание в онкогинекологии, которое позволяет себя обнаружить на ранних стадиях в связи с быстрыми появлениями симптомов болезни, поэтому на передовой лечения РЭ оказываются хирурги онкогинекологи. У большинства пациенток, у которых болезнь выявляется на ранних стадиях, сохраняется высокий шанс быть излеченными. Для достижения этой задачи необходимым фактором является совместная командная работа хирурга, морфолога, лучевого терапевта и химиотерапевта. Правильное стадирование заболевания, выявление факторов риска прогрессирования определяют в последующем необходимость адъювантного лечения в том или ином объеме, которое является залогом успешного лечения. В настоящий момент мы используем морфологическую классификацию, которая определяет группу риска, в которую входит пациентка, исходя из гистологического подтипа опухоли, степени злокачественности, наличия эмболов в лимфатических сосудах и инвазии в миометрий (см. табл. 1). Для больных ранними стадиями и благоприятным прогнозом достаточно адекватного хирургического лечения. Тогда как для неблагоприятного прогноза, наоборот, необходимо назначение адъювантной ХТ и/или ЛТ. Трудности заключаются при выборе адъювантного лечения у пациенток с промежуточным риском, где проводится ЛТ, чаще всего это брахитерапия при адекватном хирургическом вмешательстве. Выделение группы высокого-промежуточного прогноза всегда ставило перед специалистами вопросы о необходимости активного системного воздействия.
Таблица 1. Классификации прогностических групп, используемые в лечении рака эндометрия.
В мировой литературе опубликовано несколько рандомизированных работ с целью определения наиболее адекватного объема адъювантного лечения. Самым крупным и обсуждаемым было исследование PORTEC-3. Это исследование оценивало эффективность адъювантной совместной химиотерапии и лучевой терапии против только лучевой терапии у пациенток высоким риском рака эндометрия. Напомню, что анализ 2019 года продемонстрировал увеличение как медианы времени без прогрессирования (ВБП), так и медианы продолжительности жизни (ПЖ) для больных РЭ с высоким риском, к которому относится стадия I и высокая степень злокачественности с глубокой инвазией миометрия и/или лимфоваскулярной инвазией; II и III стадии; I-III стадии у больных с серозной или светлоклеточной аденокарциномой [1]. Авторы отметили, что с наибольшей эффективностью такой комбинированный подход имеет преимущество у больных III стадией РЭ и у пациенток с серозным подтипом. В связи с этим в рекомендациях, в том числе в нашей стране, назначение адъювантного системного лечения начинается при III стадии рака эндометрия и при агрессивных гистологических подтипах, начиная с I стадии [2].
В 2020 году авторы PORTEC-3 не остановились, а продолжили изучать эффективность адъювантной терапии в зависимости от молекулярных характеристик опухоли [3]. Оценив 423 образца опухолевой ткани пациенток, принимавших участие в исследовании, был проведен анализ частоты встречаемости мутаций POLE, нарушений в системе репарации неспаренных оснований (MMRd), нарушений белка p53 или отсутствии вышеуказанных изменений (NSMP). Данный анализ позволил определить 4 основных молекулярных подтипа РЭ: мутация POLE встречалась в 12% (N=51) случаев, MMRd – у трети больных – 33% (N=137), нарушения белка р53 – в 23% (N=93) и NSMP – у 32% (N=129) соответственно (рис. 1). Каждая из 4 подгрупп отличалась разными цифрами выживаемости. Наиболее благоприятное течение вне зависимости от типа адъювантного лечения и факторов прогноза отмечалось у больных с мутацией POLЕ (98%), практически ни у одной больной не было выявлено прогрессирование (5-летняя БРВ – 98%). Тогда как при наличии мутации p53 отмечались худшие показатели выживаемости (5-летняя БРВ – 48%). Назначение адъювантной ХТ не улучшало результаты лечения у пациенток с мутацией POLE (5-летняя БРВ 100% в группе комбинированного лечения и 98% в группе ЛТ). Для больных с нарушениями р53 отмечалось значимое снижение возникновения рецидивов при назначении системного адъювантного лечения (5-летняя БРВ для комбинированного лечения – 59%, для ЛТ – 36%; р=0,019). Для MMRd и NSMP различия не были получены. Эти тренды выживаемости были оценены в нескольких ретроспективных анализах опухолевых образцов больных РЭ, позволившие заявить о новой прогностической роли не гистологической классификации опухоли и патоморфологических факторов риска, а молекулярно-генетической классификации, где наиболее благоприятным прогнозом обладают опухоли с мутацией POLE, самым неблагоприятным – новообразования с повреждением р53, а все остальные подтипы попадают в группу умеренного риска (рис. 2) [4].
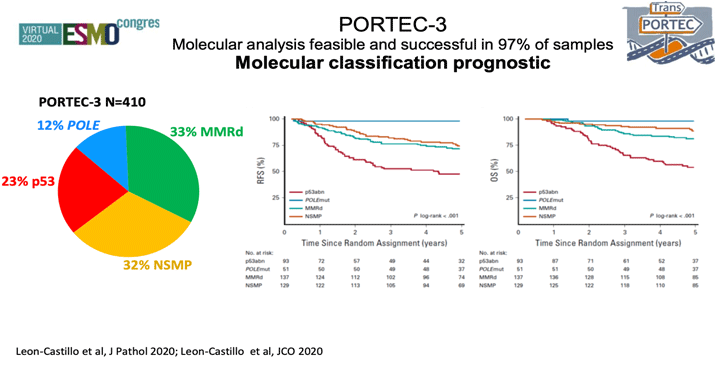
Рисунок 1. Молекулярная прогностическая классификация у больных раком эндометрия.
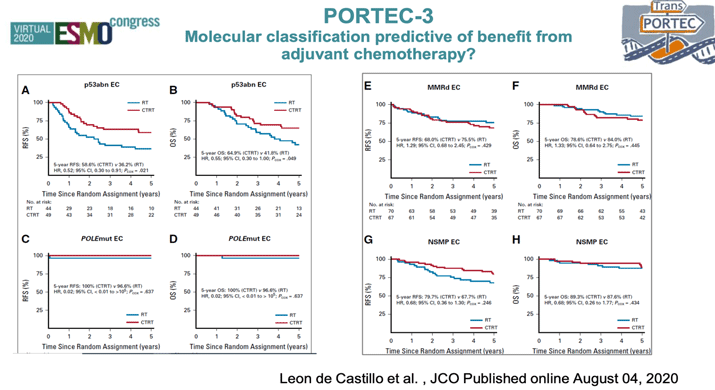
Рисунок 2. Предиктивная роль молекулярной классификации при раке эндометрия
в зависимости от вида адъювантного лечения.
На основании этих данных клиницисты поставили вопрос о необходимости проведения проспективных исследований по оценке адъювантной терапии РЭ в зависимости от молекулярно-генетического подтипа. В настоящий момент идут два крупных проспективных исследования. Одно из них называется PORTEC-4A, где включаются больные только с I стадией РЭ, которые в зависимости от молекулярных факторов прогноза рандомизируются либо в группу наблюдения, при промежуточном риске назначается только брахитерапия, при высоком риске – дистанционная ЛТ (ERBT). Вторым исследованием является зонтичное исследование RAINBO, где пациенты в зависимости от стадии, молекулярного подтипа набираются в 4 когорты, где происходит рандомизация в зависимости от вида терапии: адъювантная ЛТ, ЛТ+ХТ или наблюдение, а также добавляются препараты направленного действия (см. рис. 3). Результаты этих исследований будут ожидаться с нетерпением научным сообществом.
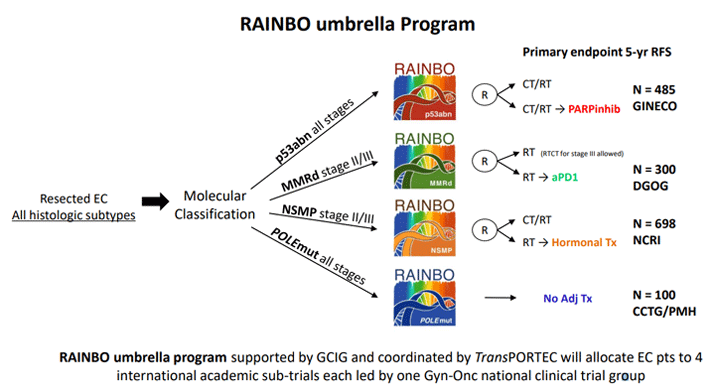
Рисунок 3. Дизайн исследования RAINBO.
Несмотря на отсутствие проспективных данных, европейское онкогинекологическое общество ESGO совместно с ESTRO публикуют новые рекомендации по лечению рака эндометрия в январе 2021 года [5]. Уже сегодня эксперты предлагают перейти на молекулярно-генетическую классификацию для определения показаний к адъювантной терапии. Для этого предложена схема из трех последовательных тестов, которую необходимо выполнять всем больным РЭ с эндометриоидной, серозной и светлоклеточной аденокарциномами: определение мутации POLE методом ПЦР, в случае ее отсутствия – выявление микросателлитной нестабильности (ИГХ). В случае MSS в опухоли – тест на р53 (методом ПЦР или ИГХ) (рис. 4). Исходя из этого в таблице 1 представлено сравнение патоморфологической и молекулярно-генетической классификаций. Особенностью новой классификации является то, что при наличии мутации POLE пациентки РЭ относятся к хорошему прогнозу и требуют только наблюдения. Тогда как в настоящий момент многие пациенты с I-II стадией и факторами риска получают адъювантное лечение, то есть существует вероятность «перелечивания» таких больных. И наоборот, наличие нарушений p53, даже при первой стадии, требует назначения адъювантной ХТ и ЛТ как при III-IVA стадии РЭ. То есть по старой классификации это благоприятный и промежуточный группы риска для эндометриоидной аденокарциномы, требующие наблюдения или только ЛТ. Два других молекулярных подтипа (MSI-H и NSMP) пока относятся к промежуточному и промежуточному-высокому риску, и тактика адъювантного лечения в настоящий момент не меняется.
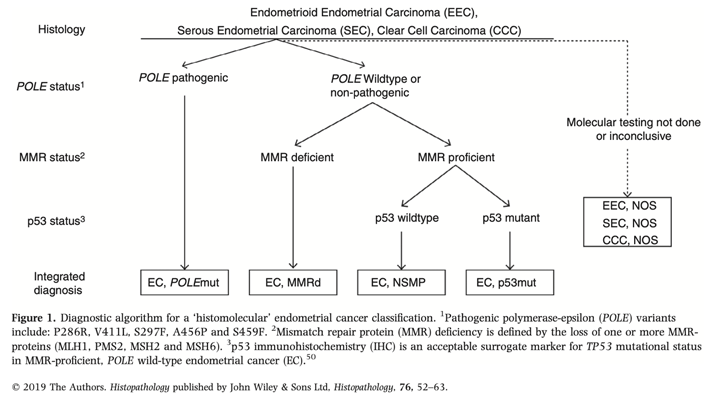
Рисунок 4. Алгоритм тестирования для определения молекулярного подтипа РЭ.
На мой взгляд, это большой шаг вперед в лечении и классификации РЭ, если не назвать очередной революцией. Но в то же самое время этот шаг требует от нас новых усилий и ставит трудные задачи перед специалистами, поскольку не везде в нашей стране доступны анализ и правильная интерпретация ИГХ исследований для выявления MSI и нарушений р53. Определение мутации POLE пока недоступно в нашей стране. С другой стороны, уже сейчас понятно, что определение микросателлитной нестабильности всем больным РЭ является необходимым знанием для выбора лечения при возникновении рецидивов заболевания, поскольку влияет на выбор терапии с использованием чекпойнт-ингибиторов и ингибиторов тирозинкиназы. Следовательно, определение этого маркера после первичного хирургического лечения будет также являться важным подспорьем в будущем.
Часть экспертов будет говорить о слишком раннем внедрении такого подхода с использованием молекулярной классификации к определению тактики адъювантного лечения, поскольку отсутствуют данные проспективных рандомизированных исследований. С другой стороны, примеры других онкологических патологий, таких как рак легкого, меланома, колоректальный рак, показывают нам, что молекулярно-генетические характеристики опухоли имеют большее значение, чем гистологический подтип опухоли в определении прогноза и тактики лечения. Поэтому переход и внедрение молекулярной классификации РЭ — это дело времени.
Список литературы: