08.10.2020

ЕSMO2020 был богат на события в онкогинекологии, что позволило получить нам удовольствие от просмотра виртуального конгресса в домашних условиях. Начнем традиционно разбирать основные события по нозологиям и уделим первостепенное внимание раку яичников (РЯ), поскольку основные важные исследования были посвящены именно этой патологии.
Итак, начнем с химиотерапии (ХТ) первой линии, где были озвучены окончательные результаты продолжительности жизни (ПЖ) в исследовании ICON8 [1]. Напомню, что это исследование ставило перед собой задачу сравнить три режима: 1) стандартный режим ХТ первой линии – паклитаксел и карбоплатин; 2) карбоплатин каждые 3 недели и паклитаксел еженедельно; 3) оба препарата еженедельно (N=1566). Обновленные данные по медиане времени без прогрессирования (ВБП) продемонстрировали отсутствие различий между всеми тремя исследовательскими группами и составили 17,4 мес., 20,1 мес. и 20,1 мес. соответственно. Окончательные данные ПЖ показали отсутствие достоверных различий между группами: 47,4 мес. в группе контроля, 54,1 мес. в группе еженедельного паклитаксела и 53,4 мес. в группе еженедельного введения обоих препаратов. Выводы, которые делают исследователи, просты: режим с еженедельными введениями переносим, но не улучшает отдаленные результаты по сравнению с «золотым стандартом» паклитакселом и карбоплатином каждые 3 недели.
Закончив первую линию терапии больным РЯ, встает вопрос о поддерживающем лечении. Мы помним потрясающие результаты исследования SOLO1 (N-391), которые были озвучены на ESMO 2018, где было показано, что использование олапариба в поддерживающем режиме в течение 2-х лет после эффективной химиотерапии первой линии у больных BRCA-ассоциированным РЯ не позволяет достигнуть медианы ВБП при 3-летнем наблюдении за больными по сравнению с группой контроля. Поэтому научное сообщество с большим интересом ждало обновления отдаленных результатов этого исследования. Через два года на ESMO2020 были продемонстрированы результаты через 5 лет наблюдения за пациентками [2]. Медиана ВБП достигла своего цифрового значения и составила 56 мес. с момента рандомизации (т.е. окончания ХТ первой линии), тогда как в группе плацебо этот показатель равнялся 13,8 мес. (HR 0,33; 95% CI 0,25-0,43). Хочу отметить, что до настоящего времени у нас был предел мечтаний иметь медиану ПЖ для больных с мутацией BRCA1/2, а это только медиана ВБП! Кривые времени без прогрессирования не сходятся вместе с течением времени после прекращения приема олапариба через 2 года, и 5 лет без признаков прогрессирования переживает 48% больных РЯ с мутацией генов BRCA1/2. Среди больных, достигших полного ответа на платиносодержащую терапию первой линии, медиана ВБП не была достигнута в группе олапариба, и 52% пациенток переживают 5-летний рубеж без признаков прогрессирования, тогда как в группе плацебо эта цифра составила 22% (HR 0,37; 95% CI 0,27-0,52). Безусловно, это значимый прорыв в лечении больных распространенным раком яичников с наличием мутации BRCA1/2, позволяющем практически половине пациенток надеяться на излечение от этой болезни.
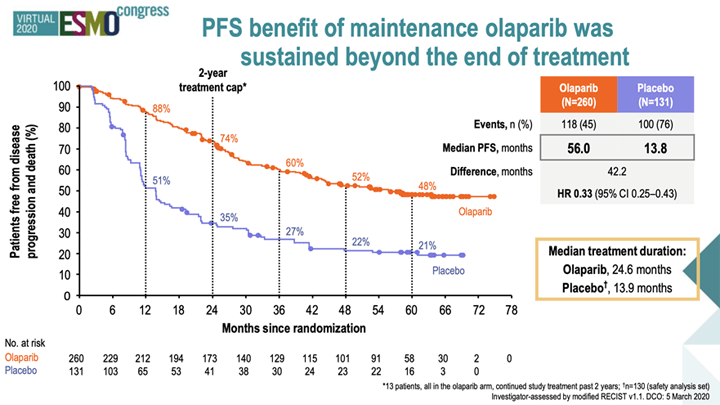
Рисунок 1. ВБП в исследовании SOLO1.
Другим исследованием по изучению PARP-ингибитора олапариба в поддержке после 1-й линии ХТ является исследование PAOLA-1 [3]. Пациентки с распространенным РЯ вне зависимости от статуса BRCA1/2, а также факторов прогноза для назначения бевацизумаба получали после окончания эффективной ХТ первой линии комбинацию олапариба и бевацизумаба (введения бевацизумаба инициировались во время ХТ) или плацебо и бевацизумаба. На ESMO 2019 было показано достоверное увеличение ВБП в группе комбинации по сравнению с группой олапариба. Исследователи провели незапланированный в исследовании анализ в зависимости от статуса HRD. При наличии мутации BRCA1/2 результаты были сопоставимы с данными SOLO1, поэтому многие эксперты пришли к мнению, что в данной популяции больных достаточно использование одного олапариба и назначение бевацизумаба не добавляет выигрыша. В группе больных с наличием нарушений в системе репарации (HRD+) также отмечался достоверный, но меньший выигрыш в медиане ВБП от добавления олапариба к бевацизумабу по сравнению с одним бевацизумабом. В группе HRD негативных больных добавление олапариба не давало никакого преимущества. На ESMO2020 были показаны данные по оценке времени до второго прогрессирования (ВБП2), то есть от момента рандомизации до развития второго последующего прогрессирования заболевания. В общей популяции было отмечено достоверное увеличение медианы ВБП2 в группе олапариба/бевацизумаба (36,5 мес.) против плацебо/бевацизумаба (32,6 мес.) (HR 0,78; 95% CI 0,64-0,95; p=0,0125). При этом любопытно, что кривые начинают расходиться после наступления второго прогрессирования. Сохраняется отмеченная ранее тенденция в зависимости от статуса HRD: при наличии мутации BRCA1/2 выигрыш от добавления олапариба составляет 14,7 мес. (HR 0,56), в группе HRD+ без мутации BRCA1/2 разница составила 20,2 мес. (HR 0,60), в группе HRD негативных больных различия не были получены (HR 0,98). На основании этого исследования FDA и EMA зарегистрировали данное показание для использования у больных с HRD позитивным статусом. Россия не отстает от зарубежных коллег, но регистрирует комбинацию бевацизумаб и олапариб у всех больных РЯ III-IV стадий после первой линии платиносодержащей химиотерапии. Безусловно, у онкологической общественности это исследование и показание вызывает ряд вопросов. Во-первых, мы до конца не уверены в значимости назначения бевацизумаба в поддержке после первой линии, особенно у больных после полной или оптимальной циторедукции. Во-вторых, большой проблемой является отсутствие теста для определения HRD в нашей стране. Использование теста Myriad myChoice CDx для определения нарушений в системе гомологичной репарации не может стать рутинной практикой для России. А назначение комбинации двух дорогостоящих препаратов без селекции больных может ограничить возможность их использования у категории пациенток, где доказана эффективность каждого из этих препаратов по отдельности. Поэтому экспертное сообщество обращает ваше внимание на сознательный и вдумчивый подход к назначению комбинации олапариба и бевацизумаба в поддержке после первой линии терапии у больных без мутации BRCA1/2. В то же время, положительным моментом данной регистрации является мотивация ученых и генетиков на острую необходимость разработки собственного теста для выявления нарушений в системе гомологичной репарации (HRD).
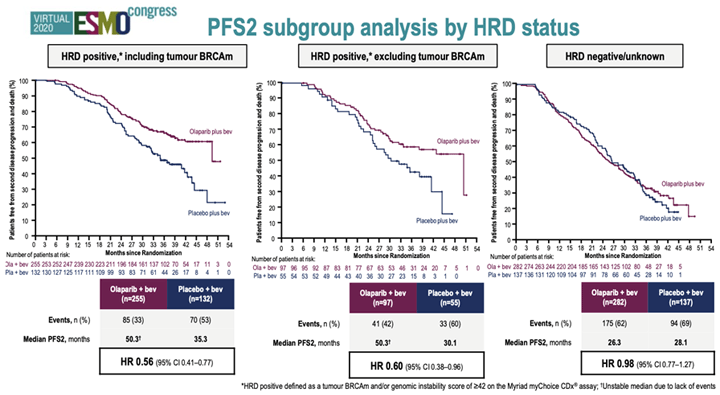
Рисунок 2. ВБП2 в исследовании PAOLA-1 в зависимости от HRD статуса.
Любопытным оказался post-hoc анализ результатов исследования Solo2. Напомню, что в исследование включались больные с платиночувствительным рецидивом BRCA-ассоциированного РЯ. Ранее в данной работе показано достоверное улучшение медианы ВБП на 13,6 мес., если пациентки после эффективной ХТ получали олапариб в поддержке: 19,1 мес. в группе олапариба и 5,5 мес. в группе плацебо (HR 0,30; 95% CI 0,22-0,41; p<0,0001). На ASCO2020 финальные результаты по ПЖ показали, что медиана ПЖ была выше в группе олапариба (51,7 мес.) по сравнению с группой плацебо (38,8 мес.), однако данные не достигли статистической значимости: HR 0,70, 95% CI 0,54-1,00, р=0,0537 [4]. Только в подгрупповом анализе, где исключили больных, которые получали PARP ингибиторы, в последующем было продемонстрировано достоверное увеличение ПЖ: медиана в группе олапариба – 51,7 мес., в группе плацебо – 35,8 мес. (HR 0,56; 95% CI 0,35-0,97). На ESMO2020 был проведен анализ эффективности последующей терапии в группах больных, которые ранее получали олапариб или плацебо [5]. Таких пациенток оказалось 161, из них 147 получали химиотерапию (78 в группе олапариба и 69 в группе плацебо), из них 96 больных получили платиносодержащую химиотерапию и 51 пациентка – системное лечение, не включающее препараты платины. Поддерживающую терапию PARP-ингибиторами в последующем получили всего 18 больных после платиновой комбинации. Стоит отметить, что во всех группах химиотерапии половина больных имела бесплатиновый интервал >12 мес. (в 50-59% случаев). При этом полный ответ на платиносодержащую химиотерапию достоверно чаще достигался у больных, получавших ранее плацебо (45%), а не олапариб (26%), р=0,05. Время до второго прогрессирования было достоверно ниже, если пациентки получали ранее олапариб: 6,9 мес. по сравнению с 12,6 мес. в группе плацебо (HR 2,17; 95% CI 1,47-3,19). Если пациентки после применения олапариба/плацебо получали при прогрессировании платиносодержащую химиотерапию, то тенденция была аналогичная: медиана ВБП в группе олапариба составила 7,0 мес., в группе плацебо в два раза выше – 14,3 мес. (HR 2,89; 95% CI 1,73-4,82). И только у больных, получивших неплатиновые режимы химиотерапии, не было получено различий в ВБП в зависимости от того, получали или нет ранее олапариб больные раком яичников. Авторы ставят множество вопросов для последующего анализа с целью понимания, что привело к полученным результатам: активация химиорезистентности, а именно к препаратам платины, случайная селекция больных с рецидивами, обладающими низкой чувствительностью в химиотерапии? И несмотря на полученные результаты, авторы делают заключительный вывод, что олапариб остается опцией выбора для больных с BRCA-ассоциированным раком яичников в случае развития платиночувствительного рецидива, поскольку выигрыш по времени без прогрессирования на фоне приема олапариба несомненно выше. Это первое небольшое поисковое исследование, целью которого является попытка понять, что же происходит дальше с чувствительностью к химиотерапии после использования PARP-ингибиторов. В настоящий момент будем ожидать данные других исследований с включением PARP-ингибиторов для более внимательной оценки отдаленных результатов лечения.
Наконец-то пришли данные исследования III фазы INOVATION об уже забытом трабектидине в лечении рака яичников [6]. Напомню, что целью исследования являлась оценка эффективности бесплатиновой комбинации трабектидин/пегилированный липосомальный доксорубицин (ПЛД) по сравнению со стандартной комбинацией карбоплатин/ПЛД у больных с бесплатиновым интервалом 6-12 мес. (N=617). Первичная конечная точка (ПЖ) оказалась одинаковой в обеих группах: в экспериментальной – 21,5 мес., в контрольной – 21,3 мес. Оценка ВБП показала, что назначение платиновой комбинации достоверно увеличивает медиану ВБП на 2,5 мес. Прослушав похоронный марш по трабектидину на ESMO2020, авторы сделали вывод, что ничего лучше комбинаций с платиной не существует для лечения рецидивов в интервале 6-12 мес.
Иммунотерапия в очередной раз пытается пробить стену неэффективности у больных раком яичников. Исследование MEDIOLA – это исследование II фазы по изучению комбинации олапариба, дурвалумаба и бевацизумаба против олапариба и дурвалумаба у больных с платиночувствительным рецидивом РЯ без герминальной мутации BRCA1/2 в качестве линии лечения [8]. Первичной конечной точкой являлся контроль болезни (DCR) через 24 недели. В группе тройной комбинации DCR составил 77,4%, медиана ВБП – 14,7 мес.; в группе олапариба и дурвалумаба DCR – 28,1%, медиана ВБП – 5,5 мес. Объективный ответ составил 87,1% в группе тройной и 34,4% в группе двойной комбинации. Полученные результаты позволяют исследователям надеяться на возможность проведения успешной III фазы исследования.
Обратим внимание также на данные исследования II фазы LEAP-005, где пациенты с различными солидными опухолями получали комбинацию ленватиниба и пембролизумаба [9]. Среди них оказалась 31 пациентка РЯ, получающая данную комбинацию по поводу 4-й линии ХТ в превалирующем большинстве. Объективный ответ отмечался у 32,3% больных, что является достойным результатом для предлеченных больных, при этом контроль болезни (DCR) отмечался у 74,5% больных. И эти показатели были наиболее значительными по сравнению с пациентами с другими солидными опухолями, принимавшим участие в исследовании.
Перейдем от позитивных II фаз к огорчительным III фазам исследований. IMAGYN050 – это исследование III фазы по изучению совместного применения ХТ первой линии вместе с бевацизумабом или бевацизумабом и атезолизумабом у больных III-IV стадиями РЯ с неблагоприятным прогнозом (макроскопической резидуальной болезнью или после неоадъювантной ХТ) [10]. К сожалению, нас постигла очередная неудача, как и во всей популяции, так и в группе PD-L1+ больных не было получено достоверных различий во ВБП. Первый анализ ПЖ также показал, что добавление иммунотерапии к бевацизумабу не позволяет улучшить результаты лечения в когорте больных с таким неблагоприятным прогнозом. И только в подгрупповом анализе при PD-L1 и IС ≥5% отмечалось достоверное увеличение ВБП: медиана в группе атезолизумаба не достигнута, в группе контроля составила 20,2 мес. (HR 0,64; 95% CI 0,43-0,96; p=0,0278).
В исследование NINJA, III фаза из Японии, включались пациентки с платинорезистентными рецидивами РЯ (N=316), где больные рандомизировались на 2 группы – ниволумаб 240 мг в/в каждые 2 недели или ХТ по выбору врача (гемцитабин или ПЛД) [7]. Отметим, что практически каждая 5-я больная имела гистотип светлоклеточного рака яичников. Первичная конечная точка – ПЖ – была одинакова в обеих группах и составила 10,1 мес. в когорте ниволумаба и 12,1 мес. для ХТ. В подгрупповом анализе отмечалась тенденция в пользу использования ниволумаба у больных со светлоклеточным раком яичников. Таким образом, авторы делают вывод, что ниволумаб неэффективен у всех больных, а может быть изучен у определенных субпопуляций пациенток.
Подведя итоги последних новостей в лечении рака яичников, хочется отметить, что PARP-ингибиторы сделали значительный прорыв и подарили надежду на действительную помощь нашим пациенткам, особенно среди больных с мутацией BRCA1/2. И мы все еще не теряем надежду дождаться исследований III фазы, где иммунотерапия покажет себя во всей красе при лечении больных этой непростой нозологией.
В лечении рака эндометрия я бы кратко отметила одно исследование. Это исследование II фазы по изучению комбинации летрозол и палбоциклиб [11]. Больные раком эндометрия при наличии позитивных рецепторов прогестерона рандомизировались на две группы: первая получала только летрозол, вторая комбинацию летрозола и палбоциклиба. Исследование продемонстрировало достоверное увеличение медианы ВБП в группе комбинации 8,3 мес. против 3,0 мес. в группе летрозола (HR 0,56; 95% CI 0,32-0,98; p=0,0276). Контроль болезни тоже в два раза был выше в группе комбинации – 63,6% и 37,8% соответственно. Таким образом, исследователи с радостью заключили, что продолжат изучать комбинацию гормонотерапии с палбоциклибом в рамках исследования III фазы.
В лечении больных раком шейки матки стоит отметить одно потенциально интересное исследование. Перспективными могут быть результаты исследования с использованием тизотумаба ведотина, конъюгированного моноклонального антитела против тканевого фактора, что позволяет беспрепятственно попасть в опухолевую клетку, и препарата цитостатика на основе монометилуристатина E (MMAE), блокирующего образование микротрубочек, тем самым проводя к аресту клеточного цикла [12]. Пациентки с раком шейки матки и получившие как минимум 2 линии ХТ включались в исследование II фазы, где получали данный препарат каждые 3 недели до прогрессирования или непереносимой токсичности. Частота объективных эффектов составила 24%, медиана контроля болезни – 8,3 мес. Медиана ВБП равнялась 4.2 мес., ПЖ – 12,1 мес. Исследователи отметили, что эффективность терапии не коррелировала с экспрессией тканевого фактора на мембране опухолевых клеток. Данный препарат может стать основным конкурентом пембролизумаба в лечении рецидивов рака шейки, где частота объективных ответов составляет 14,6% у больных с PD-L1 позитивным статусом.
В заключение хочу отметить, что это ESMO2020 хоть и было уже привычно виртуальным, но позволило нам радоваться новым изменениям в лечении онкогинекологических больных, позволяющим нам развиваться дальше, надеяться на успехи в лечении наших пациенток дома и на работе. Берегите себя, дорогие коллеги!
Список литературы: