23.06.2020

Уротелиальный рак (УР) – одна из самых часто встречающихся злокачественных патологий мочевыводящих путей; по распространенности она занимает 7-е место в структуре онкопатологии у мужчин и 17-е место у женщин [1]. Возрастной и гендерный состав пациентов преимущественно включает в себя пациентов старше 55 лет, в основном – мужчин [1]. УР встречается у мужчин чаще, чем у женщин (соотношение 5:1), что связано с большим распространением среди мужчин курения и профессий, связанных с канцерогенными веществами, увеличивающими риск развития заболевания [2]. В течение практически трех десятилетий для пациентов с распространенным УР не было зарегистрировано ни одного препарата для терапии. Долгое время золотым стандартом терапевтического лечения была химиотерапия на основе комбинаций с включением препаратов платины: гемцитабин + цисплатин или гемцитабин + карбоплатин. Однако с появлением современных иммуноонкологических препаратов у больных с УР появился шанс на значительное улучшение исхода при, что немаловажно, хорошей переносимости лечения.
Атезолизумаб – ингибитор PD-L1, первый онкоиммунологический препарат, одобренный для применения у пациентов с местнораспространенным или метастатическим раком мочевого пузыря [3]. Препарат комплексно стимулирует противоопухолевый иммунный ответ, восстанавливает активность T-клеток и усиливает активацию новых иммунных клеток в лимфатических узлах [3]. Результаты многоцентрового международного исследования IMvigor130 (III фаза) показали, что сочетание атезолизумаба и химиотерапии на основе препаратов платины демонстрирует статистически значимое улучшение выживаемости без прогрессирования заболевания. Более того, исследование продемонстрировало, что среди популяции исследования были также и пациенты, показавшие полный ответ на проводимую терапию атезолизумабом [4].
Приводим клинический пример лечения больного уротелиальным раком, которому проводилось комбинированное лечение, включая активную хирургическую тактику и химиотерапевтическое лечение, после чего пациент был включен в международный протокол исследования IMVigor130. Данный клинический случай отражает классическое течение болезни и, что немаловажно, типичный соматический статус у большинства больных. При этом благодаря терапии атезолизумабом нам удалось добиться полного ответа и регрессии заболевания, которая сохраняется и до настоящего момента.
В 2012 году пациент Х., 1936 г.р., обратился с жалобами на макрогематурию по месту жительства, был обследован, в результате чего обнаружена опухоль мочевого пузыря размерами до 3 см. Ему была выполнена первичная трансуртеральная резекция и гистологически был поставлен уротериальный рак G1. Больной был оставлен под динамическое наблюдение. В последующем ему неоднократно проводились ТУР по поводу рецидивов: в мае 2012, в ноябре и апреле 2013. В декабре 2013 с очередным рецидивом заболевания пациент поступил в МНИОИ им. П.А. Герцена.
При обследовании выявлены экзофитные папиллярные образования, по МРТ отмечалась инвазия в мышечной слой стенки. Емкость мочевого пузыря сокращена до 50 мл. По данным обследования (КТ ОГК, ОБП) отдаленных метастазов не наблюдалось.
Была выполнена цистпростатвезикулэктомия с пластикой мочевого пузыря сегментом тонкой кишки. По результатам гистологического исследования подтвердилось, что у пациента неинвазивный высокодифференцированный процесс: УР G1 с мультифокальным ростом, субтотальным поражением мочевого пузыря, без инвазии в мышечную стенку; метастазов опухоли в удаленных лимфоузлах не обнаружено.
После этого больной был оставлен под динамическое наблюдение. Через полгода, 01.06.2014, у больного возник рецидив: по результатам КТ была обнаружена опухоль верхних мочевых путей, в средней группе чашечек, лоханке правой почки размерами 28×18 мм. По данным комплексного обследования (ОСГ, МРТ малого таза, УЗИ, КТ ОБП) другой очаговой патологии выявлено не было. Больному был поставлен диагноз – рак лоханки правой почки III ст. В МНИОИ им. П.А. Герцена было проведено хирургическое лечение: нефруретерэктомия, забрюшинная лимфаденэктомия. В результате гистологии был обнаружен инвазивный низкодифференцированный процесс: уротелиальная карцинома G3 с признаками инвазивного роста, распространением на лоханочно-мочеточниковый сегмент, инвазией клетчатки лоханки почки. Но в то же время в 25 удаленных ЛУ метастазов выявлено не было. Больной был оставлен под динамическое наблюдение. В течение последующих 32 месяцев признаков рецидива или прогрессирования заболевания не наблюдалось.
В марте 2017 года было выявлено прогрессирование опухолевого процесса, а именно были выявлены метастазы в забрюшинных ЛУ (см. рис.1). Был поставлен диагноз: первично-множественный метахронный рак. Рак мочевого пузыря I ст. Состояние после неоднократных ТУР мочевого пузыря. Состояние после хирургического лечения (цистпростатвезикулэктомия с пластикой мочевого пузыря сегментом тонкой кишки). Рак лоханки правой почки III ст. Состояние после хирургического лечения (нефруретерэктомия, забрюшинная лимфаденэктомия). Прогрессирование заболевания (метастазы в ретроперитонеальных лимфатических узлах). При этом у пациента ранее была диагностирована хроническая болезнь почек (ХБП) 3б стадии, ИБС (стенокардия напряжения ФК III), гипертоническая болезнь III ст., 3 ст., компенсированная на фоне терапии, а также хроническая анемия сочетанного генеза за счет гематурии и железнодефицитных компонентов. Также он перенес в 2007 году аортокоронарное шунтирование.
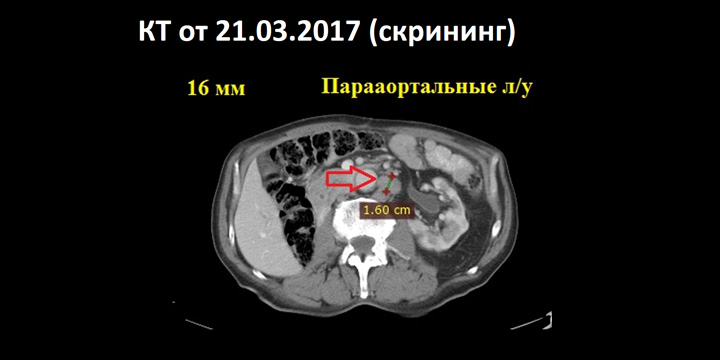
Рисунок 1. Результаты КТ от 21.03.2017.
Больному было предложено участвовать в международном клиническом исследовании IMVigor130. Изначально в это исследование включали больных, у которых были противопоказания для назначения цисплатина. Биохимический анализ крови данного больного подтверждал противопоказания для назначения цисплатина: мочевина 22,4 ммоль/л, креатинин 168,3 мкМ/л, скорость клубочковой фильтрации – 33 мл/мин. По результатам КТ от 21.03.2017 были обнаружены таргетные очаги в парааортальных ЛУ – 16 мм, а также нетаргетные очаги – метастазы в ЛУ брюшной полости, забрюшинного пространства.
В результате оценки скрининга больной был включен в исследование, рандомизирован в группу атезолизумаба/плацебо 1200 мг в комбинации с химиотерапией (гемцитабин 1000 мг/м2 в 1 и 8 дни, карбоплатин AUC 4,5 в 1 день). По результатам первого курса терапии у больного отмечалась гематологическая токсичность: снижение лейкоцитов (с 5,3×109/л до 2,3×109/л), гемоглобина (с 91 г/л до 84 г/л), тромбоцитов (74×109/л), а также увеличение уровня креатинина с 198 мкМ/л до 249 мкМ/л. НЯ после первого курса терапии – анемия II степени, тромбоцитопения II степени, нейтропения II степени, а также нефротоксичность I степени, слабость, диспепсия и рвота.
После 2-го курса терапии клиническая ситуация ухудшилась: лейкоциты упали до 1,2×109/л, эритроциты – 2,6×109/л. Показатели гемоглобина составили 68 г/л, тромбоцитов – 24×109/л. Отмечалась гепатотоксичность, нефротоксичность; тромбоцитопения IV степени, анемия III степени, лейкоцитопения III степени, макрогематурия II степени, повышение креатинина II степени, а также гипертермия, в результате чего была отменена химиотерапия. После этого больной стал получать, как выяснилось в дальнейшем, монотерапию атезолизумабом. Через два месяца терапии (13.06.2017) была отмечена стабилизация заболевания (SD), новых очагов выявлено не было. Через 4 месяца сохраняется стабилизация заболевания с уменьшением таргетных очагов на 25% (до 12 мм) (см. рис.2). Через 8 месяцев терапии отмечается полный общий ответ на терапию атезолизумабом: ЛУ уменьшились до нормального размера (7 мм), новых очагов выявлено не было. Через 2 года, по данным КТ от 26.03.2019, сохраняется полная регрессия заболевания и контрольная КТ в мае 2020 года также подтвердила полный ответ на проведенную терапию (см. рис.3 и рис.4).
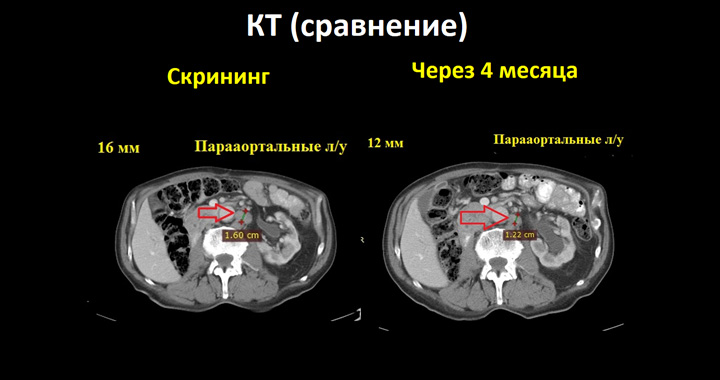
Рисунок 2. Результаты КТ от 15.08.2017.
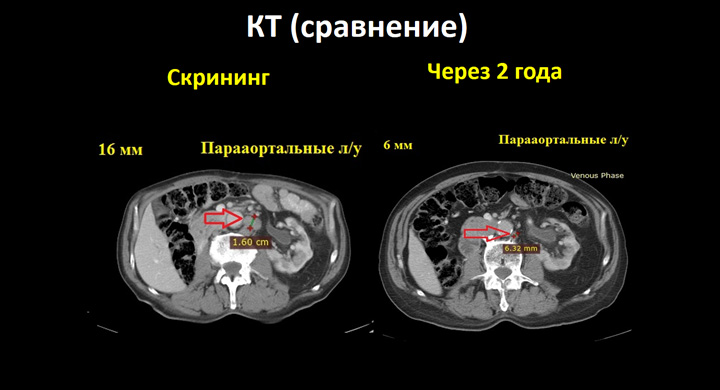
Рисунок 3. Результаты КТ от 26.03.2019.
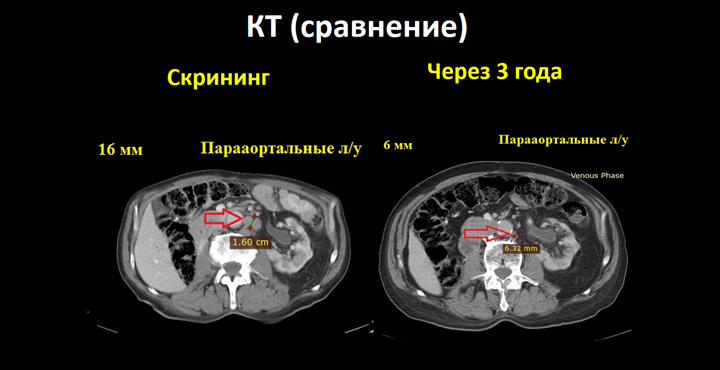
Рисунок 4. Результаты КТ от 06.05.2020.
Всего больной получил 54 курса препаратом атезолизумаб 1200 мг в период начиная с 2017-го года. При этом за время проводимой терапии из НЯ наблюдался только гипотериоз I степени, других нежелательных явлений выявлено не было. В настоящий момент больной продолжает терапию в рамках международного клинического протокола.
Ссылки
Статья предоставлена коммуникационным агентством AG Loyalty. При поддержке компании РОШ. Публикуется в редакции авторов.