15.06.2020

В данном разделе я бы выделил несколько исследований, результаты которых имеют крайне важное значение для практикующих онкологов.
Распространенный или метастатический уротелиальный рак
Результаты рандомизированного исследования фазы III Javelin Bladder 100 [1], по всей видимости, уже в ближайшее время изменят сложившиеся стандартные лечебные подходы. В данном исследовании 700 пациентов распространенным уротелиальным раком без признаков прогрессирования после завершения 4-6 курсов платиносодержащей химиотерапии первой линии были рандомизированы в две группы; в первой группе пациенты получали терапию авелумабом (анти-PD1-L1 антитело) в комбинации с наилучшей поддерживающей терапией по выбору врача, а во второй – только наилучшую поддерживающую терапию. Поддерживающая терапия проводилась до прогрессирования и/или неприемлемой токсичности. Первичной целью исследования была оценка общей выживаемости (ОВ), вторичные цели включали в себя выживаемость без прогрессирования (ВБП), частоту объективных ответов (ЧОО) в соответствии с критериями RECIST v. 1.1, безопасность и переносимость. При рандомизации пациентов стратификационными факторами являлись эффективность платиносодержащей химиотерапии (полный ответ, частичный ответ, стабилизация) и локализация метастазов (висцеральные/не висцеральные). На момент публикации результатов медиана наблюдения за пациентами составила около 19,6 мес.
Поддерживающая терапия авелумабом после завершения платиносодержащей химиотерапии способствовала существенному увеличению медианы общей выживаемости с 14,3 до 21.4 мес. (р<0,001) и 1,5-летней выживаемости с 44% до 61% соответственно (рис.1). Улучшение показателей общей выживаемости наблюдалось как в общей популяции пациентов, так и в подгруппе PD-L1+ пациентов. В подгруппе PD-L1 негативных пациентов также отмечено улучшение показателей выживаемости при данных сроках наблюдения. Более того, в процессе поддерживающей терапии авелумабом дополнительно у 10% пациентов была зарегистрирован объективный эффект (у 6% полная регрессия).
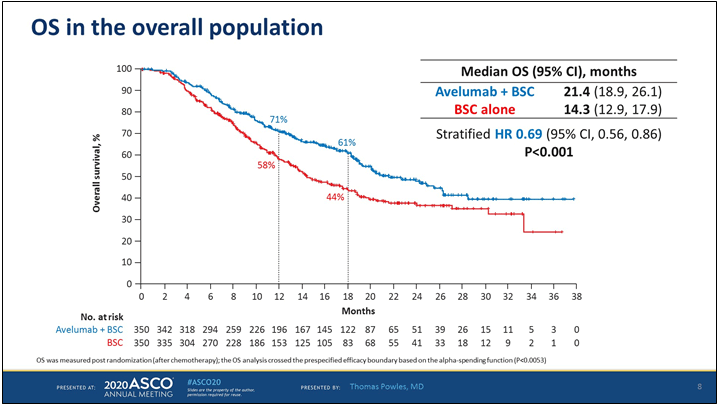
Рисунок 1. Общая выживаемость пациентов, получавших
поддерживающую терапию в исследовании Javelin Bladder 100.
В общей популяции пациентов 1-летняя выживаемость без прогрессирования в группе авелумаба составила 30%, в то время как в группе пациентов, получавших наилучшую поддерживающую терапию, данный показатель всего 13% (p<0,001). При этом 75% пациентов, не получавших поддерживающую терапию авелумабом, имели возможность в последующем получить различные варианты 2-й линии терапии после прогрессирования, в том числе с включением анти-PD1 антител. Частота иммуноопосредованных нежелательных явлений также была выше в группе авелумаба (29,4% vs 7,0%). В целом по профилю безопасности терапия авелумабом соответствовала ранее установленному в других клинических исследованиях профилю токсичности, который представляется благоприятным и управляемым. Таким образом, столь оптимистичные результаты исследования позволяют предположить, что поддерживающая терапия авелумабом будет рекомендована к клиническому использованию у пациентов с распространенным или метастатическим уротелиальным раком с отсутствием признаков прогрессирования после завершения 4-6 курсов индукционной терапии с включением платиновых производных.
В другом исследовании IMvigor110 изучалась эффективность адъювантной терапии другим анти-PD1-L1 ингибитором – атезолизумабом, у пациентов с мышечно-инвазивным раком мочевого пузыря с высоким риском прогрессирования (pT3-T4a или pN+ ст.) после радикальной цистэктомии и с наличием противопоказаний к назначению цисплатина [2]. Допускалось также включение пациентов (ypT3-T4a или ypN+ ст.), получавших неоадъювантную химиотерапию перед цистэктомией при наличии у них резидуальной опухоли после операции. В общей сложности 809 пациентов были рандомизированы 1:1 в группу наблюдения или адъювантной терапии атезолизумабом в течение 12 мес. после хирургического лечения. Из всех включенных пациентов неоадъювантную химиотерапию получили 48% больных.
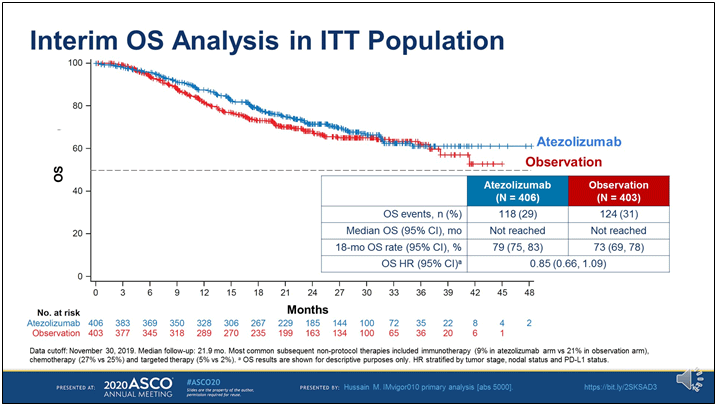
Рисунок 2. Общая выживаемость пациентов, получавших
адъювантную иммунотерапию в исследовании IMvigor110.
К сожалению, адъювантная иммунотерапия не смогла улучшить показатели беспрогрессивной выживаемости как в общей популяции больных, так и у пациентов с высоким уровнем экспрессии PD-L1 на иммунокомпетентных клетках. Показатель 18-месячной беспрогрессивной выживаемости в обеих группах составил приблизительно 50%. Таким образом, нео- или адъювантная химиотерапия с включением цисплатина продолжает оставаться стандартной опцией в отношении пациентов с высоким риском рецидива после радикальной цистэктомии. Если пациент не способен перенести данный вид терапии, то он подлежит динамическому наблюдению после радикальной цистэктомии.
Рак предстательной железы
Устные доклады, представленные на виртуальном конгрессе ASCO 2020 по теме рака предстательной железы, были посвящены в основном результатам 2 фазы клинических исследований, из которых можно было бы выделить 2 исследования.
В ходе рандомизированного исследования 2 фазы LACOG-0415 авторы тестировали гипотезу отказа от кастрационной терапии при проведении системного лечения больным местнораспространенным или метастатическим гормоночувствительным (некастрационно-резистентным) раком предстательной железы, не получавшим ранее кастрационной терапии по поводу распространенного процесса [3]. Идея заключалась в снижении частоты возможных осложнений, непосредственно связанных с проведением кастрационной терапии, – синдром вспышки, развитие остеопороза, слабости, увеличение веса, снижение либидо. В общей сложности 128 пациентов были рандомизированы в 3 группы: в первой группе проводилась стандартная терапия комбинацией абиратерон + преднизолон + агонисты ЛГРГ, во второй группе была использована комбинация апалутамид + абиратерон + преднизолон (без агонистов ЛГРГ), в третьей группе – монотерапия апалутамидом (антиандроген нового поколения). Эффективность комбинации апалутамид + абиратерон + преднизолон (без агонистов ЛГРГ) оказалась сопоставима со стандартным вариантом терапии комбинацией абиратерон + преднизолон + агонисты ЛГРГ с точки зрения биохимического контроля за заболеванием (снижение уровня ПСА <0,2 нг/мл). Снижение уровня ПСА (>80% от исходного значения) на 25 неделе лечения достоверно чаще наблюдалось в первых двух группах. Авторы сделали вывод, что отказ от кастрационной терапии агонистами ЛГРГ в пользу комбинации, направленной на максимальное подавление андроген-зависимого сигнального пути, возможен и в будущем может стать одной из лечебных опций у отдельной группы пациентов.
В другом исследовании изучалась возможность клинического использования неоадъювантной терапии перед радикальной простатэктомией у больных операбельным раком предстательной железы с высоким риском прогрессирования (ПСА >20 нг/мл, Глисон >7 или сT3-T4) [4]. Данный подход пока не стал стандартом лечения, но известно, что в случае достижения полного морфологического ответа (pCR) или при наличии минимальной резидуальной опухоли (MRD, объем жизнеспособной опухоли <5 мм) после неоадъювантной терапии вероятность биохимического рецидива у больных после радикальной простатэктомии приближается к нулю. По литературным данным pCR и MRD может быть достигнут в 17-30% случаев при длительной неоадъювантной терапии с включением агонистов ЛГРГ и антиандрогенов нового поколения. В исследовании 2 фазы пациенты с операбельным раком предстательной железы с высоким риском были рандомизированы в 2 группы. В первой группе больные перед операцией в течение 6 мес. получали комбинацию абиратерон + агонисты ЛГРГ, во второй – комбинацию абиретрон + апалутамид + агонисты ЛГРГ. Частота pCR и MRD оказалась сопоставимой в обеих группах – 20%. Авторы собираются продолжить поиск молекулярных маркеров, способных предсказать pCR и MRD, и выделить группу пациентов, которая могла бы избежать радикальной простатэктомии. В настоящее время проводится изучение данного подхода в рамках рандомизированного исследования 3 фазы.
Неметастатический кастрационно-резистентный рак предстательной железы
На ASCO 2020 в ходе постерной дискуссионной сессии были представлены обновленные данные по общей выживаемости больных неметастатическим кастрационно-резистентным раком предстательной железы, получавших терапию антиандрогенами нового поколения (даролутамид, энзалутамид, апалутамид) в комбинации с кастрационной терапией в рамках трех крупных рандомизированных клинических исследований 3 фазы – ARAMIS, PROSPER и SPARTAN. В эти исследования включались пациенты, у которых при относительно высокой скорости удвоения ПСА (<10 мес.) на фоне кастрационной терапии не смогли выявить метастазы с помощью рутинных рентгенологических методов обследования (КТ, МРТ, сцинтиграфия костей). Ранее все эти препараты уже были одобрены для клинического использования в этой популяции больных, т.к. их добавление к кастрационной терапии агонистами ЛГРГ способствовало существенному увеличению медианы времени до развития метастазов и удлиняло время до появления симптомов болезни по сравнению с контрольной группой, в которой больные продолжали получать только кастрационную терапию агонистами ЛГРГ.
В исследовании ARAMIS, в которое было включено 1509 пациентов нмКРРПЖ, ранее было продемонстрировано, что добавление даролутамида к кастрационной терапии в сравнении с плацебо + кастрационная терапия существенно увеличивало время до появления метастазов с 18 мес. до 40 мес. при минимальной частоте нежелательных явлений [5]. При медиане времени наблюдения за больными 29 мес. отмечено достоверное снижение относительного риска смерти на 31% и увеличение 3-летней общей выживаемости с 78% до 83% в пользу даролутамида (HR=0,69; p<0,003) (рис.3). Медиана времени до появления болевого синдрома также была значительно выше в группе даролутамида – 25,4 мес. и 40,3 мес.
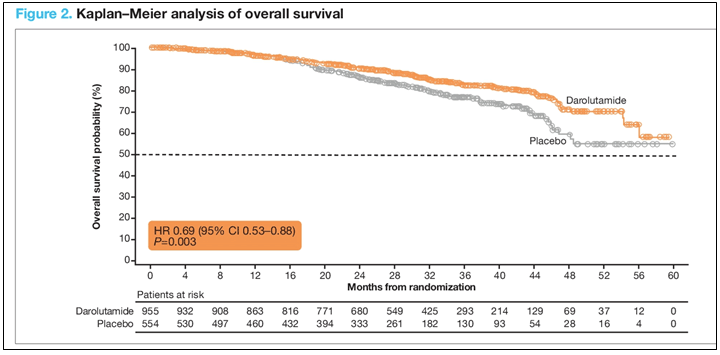
Рисунок 3. Общая выживаемость больных нмКРРПЖ, получавших комбинацию
даролутамид + кастрационная терапия в исследовании ARAMIS.
В схожем по дизайну исследовании PROSPER сравнение проводилось между комбинацией энзалутамид + кастрационная терапия и плацебо + кастрационная терапия [6]. В общей сложности 1400 пациентов с нмКРРПЖ были включены в это исследование. При медиане времени наблюдения 48 мес. отмечено достоверное увеличение медианы общей выживаемости на 11 мес. в группе энзалутамида (56 мес. vs 67 мес.) (HR 0,73; P=0,0011). Улучшение показателей общей выживаемости наблюдалось независимо от исходного уровня ПСА и индекса Глисона до начала терапии. В группе плацебо приблизительно 65% пациентов при прогрессировании болезни получали различные виды терапии в последующих линиях.
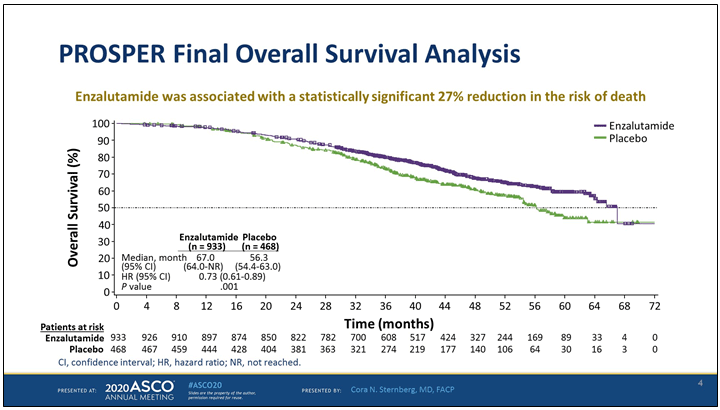
Рисунок 4. Общая выживаемость больных нмКРРПЖ, получавших комбинацию
энзалутамид + кастрационная терапия в исследовании PROSPER.
На виртуальном конгрессе ASCO 2020 также были представлены данные по общей выживаемости пациентов с нмКРРПЖ, получавших терапию в рамках исследования SPARTAN [7]. В данном исследовании 1207 пациентов были рандомизированы в 2 группы: в первой после развития кастрационно-резистентной формы неметастатического рака предстательной железы больные получали апалутамид 240 мг/день в комбинации с кастрационной терапией, во второй – плацебо + кастрационную терапию. При медиане времени наблюдения за больными 52 мес. отмечено достоверное увеличение медианы общей выживаемости с 59,9 до 73,9 мес. (HR=0,784; p=0,016). Ранее в 2018 г. было продемонстрировано значительное увеличение медианы времени до развития метастазов с 16,2 до 40 мес., а также времени до появления симптомов болезни и начала цитотоксической химиотерапии в группе пациентов, получавших апалутамид. Наиболее частым видом осложнений 3-4 ст. на фоне терапии являлась гипертензия (16%). Частота других видов нежелательных явлений (диарея, сыпь) была минимальной и не превышала 5%.
Таким образом, для больных неметастатическим КРРПЖ добавление антиандрогенов нового поколения к кастрационной терапии не только способствует клинически значимому удлинению времени до появления метастазов и увеличению времени до появления симптомов болезни, но и достоверно увеличивает продолжительность жизни этих пациентов при хорошей переносимости терапии. С внедрением новых методов диагностики (ПЭТ/КТ с ПСМА) следует ожидать сокращения популяции пациентов с неметастатическими формами КРРПЖ. По представленным ранее данным, у 55% пациентов с помощью данных методов удается выявить отдаленные метастазы и у 45% локорегионарный рецидив, что, безусловно, повысит значимость использования методов локального воздействия (лучевая терапия) в дополнение к лекарственным подходам [8].
Источники: