10.02.2020


Колоректальный рак входит в тройку самых частых опухолей в мире, в России в четверти случаев болезнь диагностируется уже в IV стадии [1]. Если при I-III стадиях хирургический метод лечения является основным, то при метастатическом колоректальном раке (мКРР) в ситуациях, когда отсутствуют угрожающие жизни симптомы (кишечная непроходимость, кровотечение, распад), а ведущим методом лечения является лекарственная терапия, возникает вопрос о необходимости удаления первичной опухоли (УПО). В годы невысокой эффективности химиотерапии при мКРР, когда единственным активным препаратом был фторурацил, УПО было, скорее, правилом. Так, в США по данным базы SEER в 1988-2000 годах УПО было выполнено 66% пациентам [2].
Апологеты необходимости УПО аргументируют свою позицию прежде всего важностью профилактики будущих осложнений. В эпоху фторурацила их частота составляла около 20%, но снижалась до 7-10% при использовании современной химиотерапии [3-4]. Выполнение на первом этапе УПО, к сожалению, не служило полной гарантией профилактики последующих осложнений. По данным одной из публикаций, 14% пациентов после УПО в последующем были вынуждены подвергнуться паллиативным хирургическим вмешательствам [5].
К настоящему времени было проведено большое число ретроспективных исследований, в которых изучались непосредственные и отдаленные результаты лечения пациентов, которым на первом этапе выполнялось УПО или проводилась химиотерапия. Самый большой их метаанализ был представлен в 2019 году, включивший 77 исследований и почти беспрецедентное число больных – 160 тыс. [6]. УПО ассоциировалось с достоверным улучшением общей выживаемости (ОВ) (HR 0,59; средние различия 7,27 мес.) и выживаемости без прогрессирования (ВБП) (HR 0,76; средние различия 1,67 мес.). Данный выигрыш отмечался и после стратификации групп по различным клиническим признакам, а также при оценке исследований, представивших propensity score analysis. Серьезные осложнения после УПО развились у 10,2% больных, а летальность составила 4,5%. У 15,8% пациентов, начавших лечение с химиотерапии, в дальнейшем потребовалось хирургическое вмешательство в связи с развитием непроходимости (14,4%) и перфорации (0,6%).
Казалось бы, столь серьезная доказательная база должна была повлиять на реальную клиническую практику. В то же время подавляющее число авторитетных клинических рекомендаций и экспертов продолжали отстаивать позицию, при которой бессимптомные больные мКРР не нуждаются в УПО на первом этапе. Ретроспективный характер исследований не позволял исключить влияния клинических факторов на выбор метода лечения. Так, пациентам с низким общим статусом, коморбидностью, старшего возраста, значимой распространенностью опухоли могли чаще отказывать в УПО. Тем не менее, с развитием статистических методов анализа в последние годы удалось нивелировать влияние данных прогностических факторов. Так, в исследовании Alawadi с соавторами проведенный анализ 15154 пациентов, которым в 57% наблюдений было выполнено УПО, первоначально показал значимое улучшение ОВ при комбинации химиотерапии с хирургией первичной опухоли (Cox model и propensity score analysis – HR 0,4 и HR 0,46 соответственно). Однако применение Landmark анализа с инструментальным анализом переменных определило отсутствие эффекта от УПО в отношении ОВ (HR 0,97; 95% ДИ 0,87-1,06) [7].
Кроме этого, если предположить, что в популяции пациентов имеется фактор, который значимо влияет на выживаемость больных (например, удаление первичной опухоли), то изменение его встречаемости в популяции будет приводить и к изменению продолжительности жизни больных. По данным базы SEER (США), из 64 157 больных РТК IV стадии 67,4 % перед началом ХТ была удалена первичная опухоль. C.Y. Hu и соавт., проанализировавшие эту базу, выявили признаки, ассоциированные с удалением первичной опухоли: молодой возраст, нахождение в браке, женский пол, высокая степень дифференцировки опухоли и локализация очага болезни в ободочной кишке. При этом за несколько десятилетий отмечено уменьшение числа случаев удаления первичной опухоли: с 74,5% в 1988 г. до 57,4% в 2010 г., тогда как отдаленная общая выживаемость пациентов неуклонно возрастала: с 8,6% в 1988 г. до 17,8% в 2009 г. [8]. Конечно, основной вклад в выживаемость таких больных вносит появление новых противоопухолевых препаратов. Однако мы видим, что вероятное прогностическое значение удаления первичной опухоли для всей популяции больных с метастатическим РТК, если оно конечно есть, является минимальным и нивелируется проведением современной ХТ.
Таким образом, к концу второго десятилетия 21 века научное сообщество располагало многими десятками противоречивых исследований и метаанализов, никак не проливающих ясный свет на важный вопрос о необходимости УПО при мКРР.
По этой причине все специалисты с воодушевлением восприняли результаты первого рандомизированного проспективного исследования, выполненного в Японии и представленного на симпозиуме ASCO GI в январе 2020 года.
Исследователи резонно исключили пациентов с крайне неблагоприятными факторами. В исследовании принимали участие пациенты с нерезектабельным мКРР без признаков симптомов со стороны первичной опухоли, статусом ECOG 0-1, с поражением от 1 до 3 анатомических областей, без асцита, метастазов в кости и головной мозг, ранее не получавшие химиотерапии и лучевой терапии, которые рандомизировались в группу первичной химиотерапии (FOLFOX/XELOX + бевацизумаб) и в группу УПО с последующей аналогичной лекарственной терапией [9]. Первоначально статистическая гипотеза планировала зафиксировать возможные различия в медиане ОВ 4 мес., однако в последующем в связи с медленным набором планируемые различия были увеличены до 8 мес., что потребовало участия 280 пациентов. Проведенный в 2019 году промежуточный анализ исследования выявил тенденцию к ухудшению ОВ в группе с УПО, в связи с чем исследование было остановлено, когда было включено 160 пациентов.
Показатели ОВ и ВБП были схожи в обеих группах: HR 1,10, 95% ДИ 0,76-1,59 и HR 1,08, 95% ДИ 0,77-1,50 соответственно (рис.1).
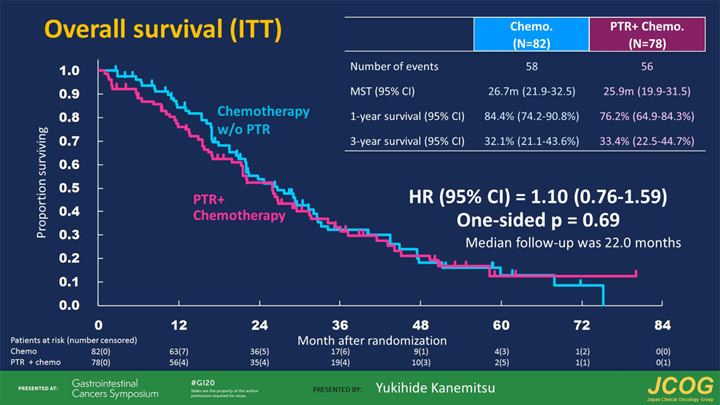
Рисунок 1. Общая выживаемость больных,
получавших одну химиотерапию или с предшествующим УПО.
УПО сопровождалось послеоперационными осложнениями 3-4 степени у 20% больных и привело к послеоперационной летальности 4%. Интересно, что в группе УПО отмечалась худшая переносимость последующей химиотерапии. Достоверно чаще встречались артериальная гипертензия, нейропатия и диарея. В то же время в группе первичной химиотерапии последующее паллиативное вмешательство в отношении первичной опухоли потребовалось только 13% больным.
Противоречат ли результаты данного исследования предыдущим ретроспективным анализам? На наш взгляд, нет. Послеоперационная летальность, частота отсроченных хирургических вмешательств на первичной опухоли соответствуют ранее сообщаемым. После устранения, благодаря рандомизации и стратификации, минимальных различий в прогностических факторах (о которых мы говорили выше) исчез и ранее обнаруживаемый «выигрыш» в ОВ после УПО.
В настоящее время проводится ряд аналогичных исследований (SYNCHRONOUS в Германии, CAIRO4 в Нидерландах, CCRe-IV в Испании, CLIMAT во Франции, PTR Trial в Южной Корее), которые, вероятно, закроют тему необходимости удаления первичной опухоли при мКРР, как это уже было сделано при раке желудка [10], молочной железы [11], раке почки [12].
Список литературы: