18.03.2019
Применение современных методов лечения позволило достичь значительного прогресса продлении жизни пациентов с HR+ HER2- метастатическим раком молочной железы (HR+ HER2- мРМЖ) с медианой общей выживаемости (ОВ), приближающейся к 4 годам [1, 2]. Несмотря на это, 30-50% пациентов прогрессируют на стандартных режимах эндокринной терапии (ЭТ). Появление ингибиторов CDK4/6 (палбоциклиба, рибоциклиба и абемациклиба) в клинической практике значимо изменило возможности и стандарты терапии больных HR+ HER2- мРМЖ. Удвоение показателей медианы выживаемости без прогрессирования (ВБП) по сравнению с применением стандартных режимов ЭТ в совокупности со временем до наступления ответа, сопоставимым с химиотерапией при сохранении качества жизни, в том числе за счет снижения болевого синдрома [5, 8-11], ставит применение комбинации ингибитора CDK4/6 с ингибиторами ароматазы (ИА)/фулвестрантом на место нового стандарта лечения пациентов с HR+ HER2- мРМЖ.
В декабре 2018 года на ежегодном симпозиуме, посвященном вопросам развития, диагностики и лечения рака молочной железы в Сан-Антонио – San Antonio Breast Cancer Symposium (SABCS) 2018, были представлены обновленные данные международных исследований MonaLEEsa-2/-3/-7 по изучению эффективности и безопасности ингибитора CDK4/6 рибоциклиба в сочетании с ингибиторами ароматазы (ИА) или фулвестрантом в 1 и 2 линиях терапии для женщин в пре-/пери-/пост-менопаузе с HR+ HER2- рРМЖ [5-7].
Подгрупповой анализ эффективности применения комбинаций рибоциклиб+ ИА/фулвестрант в подгруппе пациентов с висцеральными метастазами
(объединенные данные исследований MonaLEEsa-2, 3, 7)
По статистике, у ≈41% женщин, больных HR+ HER2- рРМЖ в постменопаузе, первые метастазы развиваются в висцеральных органах, что закономерно ассоциируется с неблагоприятным прогнозом заболевания [3,4].
В исследованиях MonaLEEsa группа пациентов с висцеральными метастазами составляла ≈60% [5].
Подгрупповой анализ эффективности терапии всех трех рандомизированных исследований III фаз MonaLEEsa показал абсолютный выигрыш комбинации рибоциклиба в сочетании с ИА или фулвестрантом независимо от наличия и количества висцеральных метастазов (≤3 или >3 очагов метастазирования) (рис.1) [5].
Медиана ВБП в группе пациентов с висцеральными метастазами и измеряемыми проявлениями заболевания была сопоставима с группой пациентов без висцеральных метастазов и значительно превосходила моно-режимы ЭТ (рис.1) [5]. Для пациентов, получающих комбинацию рибоциклиба в сочетании с фулвестрантом в 1 линии терапии, медиана ВБП на момент среза данных не была достигнута в обеих подгруппах (рис.1) и превышала 25 месяцев [5].
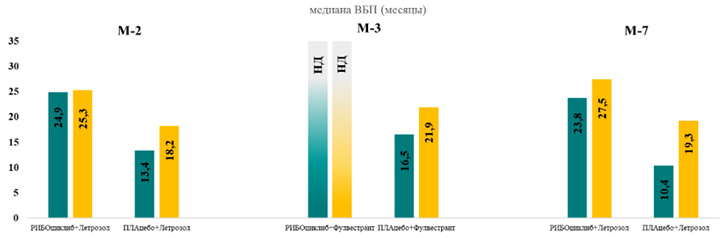
Рисунок 1. Медиана ВБП у пациентов с висцеральными и невисцеральными метастазами.
M-2 (MonaLEEsa-2, рибоциклиб+ИА) – пациенты в постменопаузе без предшествующей ЭТ по поводу HR+ HER2- мРМЖ;
M-3 (MonaLEEsa-3, рибоциклиб+фулвестрант) – включена только подгруппа пациентов в постменопаузе без предшествующей ЭТ по поводу HR+ HER2- мРМЖ; M-7 (MonaLEEsa-7, рибоциклиб+ИА) – пациенты в пременопаузе без предшествующей ЭТ и ≤1 линии ХТ по поводу HR+ HER2- мРМЖ; НД, не достигнута.
Частота объективного ответа (ЧОО) в группе исследуемой терапии (рибоциклиб+ИА/фулвестрант) была достоверно выше группы только ЭТ во всех трех исследованиях MonaLEEsa (табл.1) [5].
Таблица 1. Частота объективного ответа у пациентов с висцеральными
и невисцеральными метастазами исследований MonaLEEsa 2, 3 и 7.
| Частота объективного ответа (полный + частичный ответы) рибоциклиб в сравнении с плацебо, % | |||
|---|---|---|---|
| М-2 | М-3 | М-7 | |
| Висцеральные мтс | 53 vs 40 | 48 vs 31 | 50 vs 38 |
| БЕЗ висцеральных мтс | 59 vs 35 | 49 vs 39 | 52 vs 32 |
M-2 (MonaLEEsa-2, рибоциклиб+ИА) – пациенты в постменопаузе без предшествующей ЭТ по поводу HR+ HER2- мРМЖ;
M-3 (MonaLEEsa-3, рибоциклиб+фулвестрант) – пациенты в постменопаузе в 1 и 2 линии терапии по поводу HR+ HER2- мРМЖ;
M-7 (MonaLEEsa-7, рибоциклиб+ИА) – пациенты в пременопаузе без предшествующей ЭТ и ≤1 линии ХТ по поводу HR+ HER2- мРМЖ.
Уровень клинической пользы на фоне применения комбинации рибоциклиб+ИА был значительно выше в группе пациентов с более агрессивным течением заболевания – пациенты в пре- и перименопаузе (MonaLEEsa-7) в 1 линии ЭТ и группы пациентов в постменопаузе, принимающих комбинацию рибоциклиб+фулвестрант в 1 и 2 линиях терапии (MonaLEEsa-3) (табл.2) [5].
Таблица 2. Частота объективного ответа у пациентов с висцеральными
и невисцеральными метастазами исследований MonaLEEsa 2, 3 и 7.
| Уровень клинической пользы (стабилизация заболевания + частичный ответ + полный ответ) рибоциклиб в сравнении с плацебо, % | |||
|---|---|---|---|
| М-2 | М-3 | М-7 | |
| С висцеральными мтс | 78 vs 71 | 74 vs 59 | 79 vs 57 |
| БЕЗ висцеральных мтс | 85 vs 75 | 76 vs 79 | 89 vs 78 |
M-2 (MonaLEEsa-2, рибоциклиб+ИА) – пациенты в постменопаузе без предшествующей ЭТ по поводу HR+ HER2- мРМЖ;
M-3 (MonaLEEsa-3, рибоциклиб+фулвестрант) – пациенты в постменопаузе в 1 и 2 линии терапии по поводу HR+ HER2- мРМЖ;
M-7 (MonaLEEsa-7, рибоциклиб+ИА) – пациенты в пременопаузе без предшествующей ЭТ и ≤1 линии ХТ по поводу HR+ HER2- мРМЖ.
Обновленные данные по безопасности применения рибоциклиба в комбинации с ИА/фулвестрантом
(объединенные данные исследований MonaLEEsa) [7]
Согласно объединенным данным клинических исследований III фазы MonaLEEsa-2/-3/-7 (n=1000), нежелательные явления (НЯ) на фоне приема комбинаций ЭТ с рибоциклибом обладают предсказуемым и обратимым характером течения [7]. Большинство НЯ не превышали 1-2 степени тяжести и, как правило, наблюдались в течение первых 3 месяцев терапии [7].
Нежелательным явлением, представляющим особый интерес с клинической точки зрения, является нарушение лабораторных показателей функции печени. В таблице 3 приведены объединенные данные по частоте встречаемости этого НЯ. У небольшого числа пациентов отмечалось бессимптомное повышение уровней ALT и AST всех степеней тяжести как в группе терапии рибоциклибом, так и в группе принимающих моно-ЭТ (табл.3) [7].
Таблица 3. Повышение уровней ALT и AST среди всех пациентов исследований MonaLEEsa-2/-3/-7.
| НЯ | Все степени | 3 степень тяжести | 4 степень тяжести |
|---|---|---|---|
| Рибоциклиб+ЭТ vs Плацебо+ЭТ | Рибоциклиб+ЭТ vs Плацебо+ЭТ | Рибоциклиб+ЭТ vs Плацебо+ЭТ | |
| Повышение уровня ALT | 15% vs 6% | 7% vs 1% | 1% vs 0% |
| Повышение уровня AST | 14% vs 6% | 5% vs 1% | 5% vs 1% |
Удлинение интервала QTс ≥480 мсек, связанное с высокой специфичностью рибоциклиба к ингибированию циклин-зависимых киназ CDK4/6, было отмечено в исследованиях MonaLEEsa у небольшого числа пациентов (рис.2А). Прекращение терапии вследствие развития данного вида кардиотоксичности было диагностировано у ˂1% пациентов в каждой из групп (рибоциклиб+ЭТ vs плацебо+ЭТ) [7].
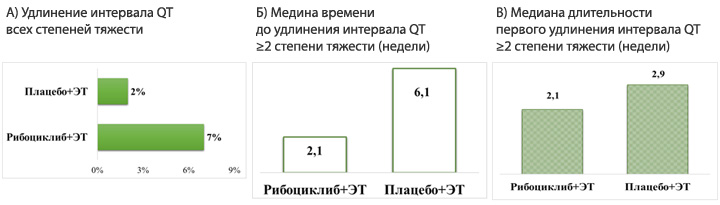
Рисунок 2. Объединенные данные исследований MonaLEEsa-2/-3/-7
по удлинению интервала QT, времени развития и длительности НЯ.
Коррекция дозы и эффективность терапии
(объединенные данные исследований MonaLEEsa) [6]
По объединенным данным трех исследований III фазы MonaLEEsa, ≥1 эпизод коррекции дозы рибоциклиба потребовался 37-61,2% пациентов в первые 2-3 месяца приема рибоциклиба, и с течением времени это число значительно снижалось. Большинству пациентов требовалась только однократная коррекция дозы препарата [6], при этом эффективность терапии комбинацией рибоциклиба с ИA/фулвестрантом не зависела от факта редукции дозы, вызванного развитием нежелательных явлений (табл.4) [6].
Таблица 4. Сравнение эффективности терапии у пациентов
с НЯ-опосредованной модификацией дозы рибоциклиба.
| ≥1 редукции дозы в сравнении с пациентами без модификации дозы | ||||||
|---|---|---|---|---|---|---|
| М-2 | М-3 | М-7 | ||||
| Редукция дозы | Без редукции дозы | Редукция дозы | Без редукции дозы | Редукция дозы | Без редукции дозы | |
| % пациентов с ≥1 редукцией дозы | 51 | – | 39 | – | 37 | – |
| мВБП (месяцы) | 25,3 | 27,7 | НД | НД | 27,5 | 23,8 |
M-2 (MonaLEEsa-2, рибоциклиб+ИА) – пациенты в постменопаузе без предшествующей ЭТ по поводу HR+ HER2- мРМЖ;
M-3 (MonaLEEsa-3, рибоциклиб+фулвестрант) – пациенты в постменопаузе в 1 и 2 линии терапии по поводу HR+ HER2- мРМЖ;
M-7 (MonaLEEsa-7, рибоциклиб+ИА) – пациенты в пременопаузе без предшествующей ЭТ и ≤1 линии ХТ по поводу HR+ HER2- мРМЖ.
Качество жизни [6]
Качество жизни – один из ключевых аспектов, который необходимо учитывать при планировании тактики лечения пациентов с рРМЖ. На SABCS’2018 были представлены объединенные данные анализа качества жизни пациентов из трех исследований III фазы MonaLEEsa. По результатам анкетирования были сделаны следующие выводы:
Таким образом, удвоение медианы ВБП по сравнению с терапией ИА в сочетании с поддержанием приемлемого качества жизни ставит комбинированную терапию ингибиторами CDK4/6 в сочетании с ИА или фулвестрантом на место нового «стандарта» в терапии HR+ HER2- рРМЖ, особенно подгруппы пациентов с висцеральными метастазами в качестве 1 (предпочтительно) или 2 линии терапии.
Литература:
1099990/onco/html/01.19/1