27.08.2018
Семиглазова Т.Ю.1,2, Бриш Н.А.1, Галунова Т.Ю.1, Бернацкий А.С.1, Семиглазов В.В.1,3, Балдуева И.А.1,2, Проценко С.А.1
1 ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России;
2 ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России;
3 ФГБОУ ВО «Первый СПбГМУ им. акад. И.П. Павлова» Минздрава России,
Санкт-Петербург
Современная концепция симбиотических взаимоотношений между макроорганизмом и микробиотой кишечника не вызывает сомнений. На состав микробиоты прежде всего влияют факторы окружающей среды, генетические и иммунные факторы организма хозяина. Дисбиоз кишечника может привести к доминированию некоторых видов бактерий, способствующих активации механизмов канцерогенеза и развитию злокачественных опухолей толстой кишки за счет хронического воспаления или местной иммуносупрессии. В эру иммуноонкологии роль кишечной микробиоты в формировании ответа на иммунотерапию злокачественных новообразований представляет большой интерес для медицинского сообщества. Учитывая, что состав кишечной микробиоты является индивидуальным для каждого человека, ее исследование как нельзя лучше вписывается в набирающую силу концепцию персонализированного медицинского подхода.
Ключевые слова: кишечная микробиота, иммунотерапия, checkpoint-ингибиторы, антибиотикотерапия.
ВВЕДЕНИЕ
Роль кишечной микробиоты в различных аспектах лечения онкологических заболеваний с каждым годом становится все более значимой темой для медицинского сообщества. Это имеет свое отражение в количестве научных публикаций: при поиске работ, содержащих указание на связь состава микробиома с онкологическими заболеваниями, представлено более 1500 статей. Разрабатываются новые методы использования микроорганизмов в диагностике, лечении и прогнозировании отдельных злокачественных новообразований. Изучением роли количественного и качественного состава микрофлоры в формировании ответа на различные терапевтические агенты в настоящее время занимаются исследователи во многих странах мира. Большой интерес представляют научные работы, посвященные области иммунотерапии онкологических заболеваний. Также определение состава кишечной микробиоты является одной из перспективных задач, которая в будущем позволит оценивать клинический ответ на применение таргетных препаратов.
 СИМБИОТИЧЕСКИЕ ВЗАИМООТНОШЕНИЯ
СИМБИОТИЧЕСКИЕ ВЗАИМООТНОШЕНИЯ
МАКРООРГАНИЗМА И МИКРОБИОТЫ КИШЕЧНИКА
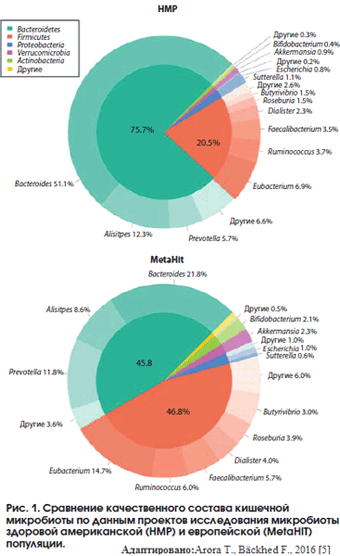
Микробиом желудочно-кишечного тракта в представлении современной науки рассматривается как гетерогенный набор разнообразных микроорганизмов, количественно и качественно отличающийся у каждого индивида и играющий значительную роль в биохимическом, метаболическом и иммунном гомеостазе макроорганизма, а также представляющий собой неспецифический барьер от экзогенных факторов агрессии. Условия среды в толстой кишке способствуют нормальной жизнедеятельности микроорганизмов, и численность 36000 видов бактерий достигает пиковых значений – 1010-1013 КОЕ/мл (1011 бактерий на грамм кишечного содержимого) именно в этом отделе кишечника [1-3]. Анаэробные бактерии преобладают над аэробами в соотношении 1000:1 [1-3]. На основании данных научных исследований общей популяции в Америке (клиническое исследование HMP) и в Европе (клиническое исследование MetaHIT) было показано, что доминантными типами микроорганизмов в составе микробиоты являются Bacteroidetes и Firmicutes [4-6].
Колонизация желудочно-кишечного тракта микроорганизмами начинается сразу же после рождения, а точнее уже при прохождении плода через родовые пути матери [7-9]. На разнообразие микробиома оказывает влияние большое количество факторов, таких как диета, половая и этническая принадлежность [10-14]. Способ родоразрешения при этом оказывается очень важным фактором, который обусловливает получение новорожденным первичной микробиоты. В нескольких зарубежных исследованиях доказана корреляция между кесаревым сечением и становлением иммунной системы [15-18]. Это означает, что состав комменсальной микрофлоры может играть роль в иммунном ответе и, таким образом, возможно, определяет уровень восприимчивости организма к различным заболеваниям [8, 19]. Дисбиоз кишечника, как проявление нарушения равновесия в бактериальной экосистеме, приводит к превалированию количества некоторых видов бактерий над другими. Это может с большой степенью вероятности способствовать активации механизмов канцерогенеза и, как следствие, возникновению злокачественных новообразований [20-24].
Следует учитывать, что кишечный микробиом – модифицируемая единица, что может быть залогом хороших результатов восстановления благоприятного микробиоценоза у онкологических больных. С началом развития методов иммунотерапии в последние годы стала рассматриваться также тема роли кишечной микробиоты в формировании ответа на воздействие различных классов противоопухолевых препаратов. Результаты достаточно большого количества исследований показывают, что при внесении бактериальных образцов от доноров в организм пациентов, страдающих от онкологических заболеваний, стимулируется рост собственной микробиоты у реципиентов, увеличение ее разнообразности, что в свою очередь повышает способность организма осуществлять контроль над механизмами канцерогенеза [25-31]. Это дает основание дальнейшему исследованию корреляции между использованием иммунотерапевтических методов лечения злокачественных новообразований и значением состава микрофлоры кишечника. Некоторые исследователи говорят о том, что микробиота кишечника оказывает влияние на распространенность опухоли и, следовательно, продолжительность жизни пациентов путем воздействия на процессы молекулярного окислительного стресса [32-33] и системную генотоксичность периферических лейкоцитов [31], что приводит к снижению активности процессов системного воспаления, играющего основную роль в развитии злокачественных новообразований.
Учитывая, что состав кишечной микробиоты индивидуален для каждого отдельного человека, можно говорить о том, что необходимость его изучения соответствует принципам персонализированной медицины.
КИШЕЧНАЯ МИКРОБИОТА КАК МОДУЛЯТОР ОТВЕТА
НА ИММУНОТЕРАПИЮ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Большинство работ, посвященных определению ключевой роли микробиома кишечника, были выполнены на мышиных моделях. В подавляющем большинстве исследований было показано, что ответ опухоли на терапию химиопрепаратами и check-point ингибиторами (ингибиторами иммунных «точек контроля») [25, 34-38] был обусловлен накоплением опухолеспецифических Т-клеток CD8+ [37, 39-41]. Также в некоторых исследованиях было освещено участие дендритных клеток в активации данных механизмов, при этом установлено увеличение накопления и прайминга CD8+ Т-лимфоцитов в микроокружении опухоли [37, 42].
Мнение о том, бактерии каких преимущественно типов могут опосредовать наилучший ответ на противоопухолевую иммунотерапию, до сих пор не стало единым. Имеются данные о том, что наиболее выраженную эффективность показывают анти-PD-1-препараты, применяющиеся для пациентов, у которых обнаруживается преобладание бактерий рода Ruminococcaceae в фекальных образцах [43]. Однако исследователи других крупных лабораторий сообщают о том, что относительное превалирование Clostridiales [38] связано с более высокой эффективностью проводимой терапии, а также есть сведения, говорящие, что у когорт пациентов с преобладанием Faecalibacterium значительно повышает показатель выживаемости без прогрессирования (PFS) [44]. При этом пациенты, в образцах которых отмечалось повышенное содержание Bacteroidales, имели меньшую PFS по сравнению с группой пациентов со сниженным количеством этих бактерий в образцах.
В противоположность вышеупомянутым результатам имеется мнение, что эффективность анти-CTLA-4-терапии взаимосвязано с наличием в составе кишечной нормобиоты различных представителей рода Bacteroidales. На базе мышиных моделей, для того чтобы убедиться в связи доминирования Bacteroidales spp. с противоопухолевым эффектом анти-CTLA-4-препаратов, были выполнены повторные колонизации желудочно-кишечного тракта фекальными образцами, полученными от доноров и содержащими изоляты представителей рода Bacteroidales. На основании полученных данных было установлено, что заселение кишечника сочетанием B. fragilis и Burkholderia cepacia было связано с более выраженной эффективностью анти-CTLA-4-препаратов, в отличие от всех других использованных изолятов [38]. По мнению авторов, формирование ответа на иммунотерапию могло быть обусловлено Akkermansia muciniphila, так как эти бактерии являются комменсалами, и их присутствие в фекальных образцах было чаще связано с наилучшим клиническим исходом заболевания [38].
В нескольких научных исследованиях было установлено, что повышение количества бактерий рода Bifidobacterium в составе кишечного микробиома формирует Т-клеточный противоопухолевый ответ [37, 39-40]. Также было показано, что обладание комменсальной флорой с превалированием рода Bifidobacterium может обусловливать повышение активности противоопухолевого иммунитета, что тем самым улучшает эффект анти-PD-L1-терапии [37].
И, конечно же, оценка взаимосвязи ответа на анти-CTLA-4-препараты с количественным и качественным составом микробиома кишечника в настоящее время также имеет большую ценность. Анализ ряда зарубежных исследований показал, что имеются веские доказательства наличия изменений на уровне рода микроорганизмов сразу же после инициации лечения злокачественных новообразований с применением CTLA-4-ингибиторов. Так, было зафиксировано быстрое уменьшение представительства как Bacteroidales, так и Burkholderiales, с относительным преобладанием содержания Clostridiales при использовании ипилимумаба [38, 46].
Из всего вышеизложенного можно сделать заключение, что CTLA-4-ингибиторы могут влиять на количественный состав рода Bacteroides spp. в кишечнике, обладающего иммуногенными свойствами, что, в свою очередь, влияет на эффективность препаратов данной группы.
Эффективность иммунотерапии онкологических заболеваний
в условиях предшествующей антибиотикотерапии
Из проанализированных данных следует, что наиболее выраженный эффект иммунотерапии злокачественных опухолей возможно ожидать у пациентов, имеющих более широкое представительство микроогранизмов в составе микробиома кишечника. Следовательно, встает вопрос о пользе изучения влияния антибиотиков, которое они оказывают на эффективность применения методов иммунотерапии онкологических заболеваний, например, checkpoint-ингибиторов. Тот факт, что использование антибактериальных препаратов влечет за собой резкое изменение количественного и качественного состава микробиоты, как патогенной, так и комменсальной, на настоящее время доказан во множестве исследований [47-49]. Антибиотики, независимо от пути введения их в организм, изменяют гомеостатическое равновесие бактериальной флоры кишечника [50-51], что существенно влияет на метаболизм всей совокупности микроорганизмов. В недавнем времени было установлено, что бактерии имеют значительное влияние на дифференцировку стволовых клеток. В свою очередь антимикробные препараты, изменяя состав микробиоценоза кишечника, приводят к различным модификациям путей развития клеток и, как следствие, к нарушениям физиологии на всех уровнях жизнедеятельности макроорганизма [52].
Кишечная микробиота играет важную роль в формировании иммунного ответа хозяина, поэтому необходимо учитывать то, что изменения ее состава могут приводить к негативным последствиям для макроорганизма [53]. Это было показано в ряде исследований, результаты которых говорят о том, что имеется определенная связь между составом микробиома и риском развития некоторых аутоиммунных заболеваний [53-55]. Согласно имеющимся данным нескольких доклинических исследований, микробиота влияет на активность ингибиторов иммунных контрольных точек, а применение антибактериальных препаратов широкого спектра действия приводит к снижению эффекта от их применения [56-57]. Существует мнение, что отрицательный эффект антибиотикотерапии на фоне использования checkpoint-ингибиторов связан исключительно с элиминацией комменсальной флоры.
На ежегодном международном урологическом симпозиуме (Орландо, Флорида), который был проведен в феврале 2017 года, были представлены результаты ретроспективного анализа данных 80 пациентов (Lisa Derosa et al., 2017) [56], установившие отчетливое снижение эффективности применения checkpoint-ингибиторов у больных почечно-клеточным раком, подвергшихся эмпирической или этиологической антибактериальной терапии за месяц до начала специального лечения.
Больным с диагнозом «метастатический почечно-клеточный рак» проводилась иммунотерапия ингибиторами иммунных «точек контроля»: монотерапия PD-1 или PD-L1 ингибиторами (n=67); комбинированная терапия PD-1 и CTLA-4 ингибиторами (n=10); комбинация PD-L1-ингибиторов и бевацизумаба (n=3). Из 80 пациентов почечно-клеточным раком (65% из которых являлись мужчинами) за месяц до начала иммунотерапии 16 больных (20%) получали антибактериальную терапию в основном антибиотиками широкого спектра действия (бета-лактамные антибиотики и фторхинолоны). Большинству больных ПКР (80%) была ранее выполнена нефрэктомия. В исследовании показано, что более агрессивное течение почечно-клеточного рака после лечения ингибиторами точек иммунного контроля наблюдается у больных, подвергшихся антибактериальной терапии, в сравнении с пациентами, не получавшими антибактериальные препараты (медиана времени до прогрессирования составила 2,3 и 8,1 месяца соответственно, p<0,001) [55, 56].
В марте 2018 года были представлены данные исследования о воздействии на показатель общей выживаемости больных почечно-клеточным раком (ПКР) и немелкоклеточным раком легкого (НМРЛ) антибиотикотерапии, начатой до иммунотерапии check-point-ингибиторами. Были проанализированы когорта пациентов с распространенной формой почечно-клеточной карциномы (n=121) и пациенты с НМРЛ (n=239). В когорте ПКР 88% пациентов получали монотерапию анти-PD-1 или анти-PD-L1-препаратами. Остальные пациенты получали анти-PD-1 или анти-PD-L1-терапию в комбинации с анти-CTLA-4-препаратами (8%) или бевацизумабом (4%). В когорте пациенты НМРЛ получали либо только анти-PD-1 или анти-PD-L1-терапию (86%), либо в комбинации с анти-CTLA-4-терапией (14%). Шестнадцать пациентов (13%) в группе ПКР и 48 (20%) в группе НМРЛ получали антибиотики в течение 30 дней после начала специального лечения. По сравнению с пациентами с ПКР, которые не получали антибиотики, пациенты, получившие курс антибиотикотерапии, имели более низкие показатели выживаемости: общей выживаемости (17,3 против 30,6 мес.; ОР 3,5 [95% ДИ 1,1-10,8]; р=0,03) и выживаемости без прогрессирования (1,9 против 7,4 мес.; ОР 3,1 [95% ДИ 1,4-6,9]; p<0,01) соответственно. В группе пациентов с НМРЛ, которые получали антибиотики, также отмечалась более низкая медиана общей выживаемости (7,9 против 24,6 мес.; ОР 4,4 [95% ДИ 2,6-7,7]; p<0,01), а также была низкой и медиана выживаемости без прогрессирования (1,9 против 3,8 мес.; ОР 1,5 [95% ДИ 1,0-2,2]; p=0,03) [56].
Бытует мнение о том, что отрицательное влияние антибиотиков на формирование ответа на иммунотерапию обусловлено их способностью подавлять «эссенциальную» микрофлору кишечника. Это также было подтверждено рядом работ, выполненных на мышиных моделях [53-55].
Именно поэтому подобные исследования являются очевидно перспективными и могут обосновать необходимость определения дефицитных энтеротипов и проведения фекальной микробной трансплантации для улучшения противоопухолевого ответа различных злокачественных заболеваний на иммунотерапию check-point ингибиторами.
РАЗРАБОТКА СТАНДАРТОВ ИЗУЧЕНИЯ
КИШЕЧНОЙ МИКРОБИОТЫ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Определение состава кишечной микробиоты у онкологических больных сопряженно с рядом нерешенных вопросов:
Существующие методы изучения толстокишечной микробиоты (табл. 1) также разнятся по точности, чувствительности, специфичности, трудоемкости, стоимости и доступности выполнения метода в рутинной клинической практике [58-62].
Таблица 1. Сравнительная оценка существующих методов изучения толстокишечной микробиоты [63].
| Метод | Достоинства | Недостатки |
|---|---|---|
| Культуральный [58-62] | Распространенность, относительная доступность, выделение чистой культуры | Трудоемкость, долговременность, изучаемый спектр 2-4% от общего количества микроорганизмов |
| ПЦР [58-62] | Высокая чувствительность и специфичность, автоматизация, быстрый результат | Высокая вероятность ложноположительных/ложноотрицательных результатов, констатация присутствия/отсутствия микробных тел |
| RT-Q-PCR [58-62] | Высокая точность, быстрый результат | Отсутствие полных баз данных для сравнения, дороговизна |
| Секвенирование 16S рРНК [58-62] | Простота выполнения, возможность проследить путь эволюции, наличие баз данных | Широкий разброс разнообразия видов, невозможность оценить биологические функции |
| Полногеномное секвенирование [58-62] | Определение биологических функций, качественно-количественное соотношение микроорганизмов | Высокая стоимость, сложность выполнения, отсутствие баз данных |
| Изучение метаболома [58] | Высокая чувствительность, быстрота | Высокая стоимость, многократные повторения, оценка только ранее секвенированных микроорганизмов |
ЗАКЛЮЧЕНИЕ
Кишечная микробиота является потенциально модифицируемой единицей, поэтому различного рода вмешательства для восстановления благоприятной микрофлоры у онкологических больных будут благоприятно сказываться на прогнозе заболевания. Для этого научному медицинскому сообществу предстоит разрешить ряд важных задач, в том числе:
Литература: