25.06.2018

Рандомизированное исследование 3 фазы PERSEPHONE при HER2-позитивном раннем раке молочной железы (РМЖ): 6 мес. адъювантной терапии трастузумабом не уступают по эффективности 12 мес. трастузумаба при значимо меньшей кардиотоксичности (abstr. 506).
Ранее по результатам исследований HERA, NSABPB-31, NCCTG-N9831 и BCIRG 006 адъювантная терапия трастузумабом стала неотъемлемой частью лечения раннего HER2+ РМЖ. Мета-анализ Cochrane 2012 г. показал, что адъювантная терапия трастузумабом на 40% снижает частоту возврата заболевания и на 34% снижает смертность в группе пациенток, получавших трастузумаб, в сравнении с теми, кому проводилась одна химиотерапия, и эти данные были подтверждены более поздними повторными анализами исследований HERA, NSABPB-31 и NCCTG-N9831. Стоит отметить, что режим применения препарата в течение 1 года после операции был вычислен по большей части эмпирически, а исследование HERA не показало дополнительных преимуществ при продлении адъювантной терапии до 2 лет. В 2006 году вышло исследование FinHer, в котором назначение трастузумаба всего лишь в течение 9 недель в комбинации с 3 циклами доцетаксела привело к увеличению ВБП и ОВ, сравнимому с одногодичным курсом терапии. Кроме того, больные ранним РМЖ потенциально могут быть излечены, поэтому на первый план, кроме эффективности, выходит проблема долгосрочной безопасности. С этой точки зрения особое внимание необходимо уделять возможной кардиотоксичности – одному из известных побочных эффектов трастузумаба. К сожалению, несколько попыток доказать, что сокращение длительности применения трастузумаба не ухудшает отдаленные результаты лечения, потерпели формальную неудачу, причем во многом из-за особенностей дизайна исследований и определенных недостатков исходных статистических гипотез. «Поэтому вопрос об оптимальной длительности адъювантной терапии трастузумабом все еще остается открытым и требует обсуждения», – подытожила первый автор исследования PERSEPHONE Helena Earl.
В представленном на ASCO 2018 рандомизированном исследовании 3 фазы PERSEPHONE с дизайном non-inferiority сравнили 6 и 12 мес. адъювантной терапии трастузумабом у больных с HER-2-позитивным РМЖ, которые получали нео- или адъювантную химиотерапию (ХТ) с антрациклинами (режимы FEC, EC, ECMF), таксанами (TC, TCH), антрациклинами и таксанами (FEC-T, EC-T) или только CMF. Включено 4088 пациенток, группы были стратифицированы в соответствии со статусом гормональных рецепторов, предшествующим режимом ХТ, временем ее начала (нео- или адъювантная), а также начала терапии трастузумабом (одновременно с ХТ или последовательно). Необходимо отметить, что значительная часть пациенток не имела метастазов в регионарные лимфоузлы (58% и 60% в группах 12 мес. и 6 мес. трастузумаба соответственно), кроме того, по 53% больных в каждой группе начали трастузумаб после окончания ХТ (известно, что такое последовательное назначение снижает выигрыш от его применения).
Первичной конечной точкой была выбрана 4-летняя безрецидивная выживаемость (БРВ). При медиане наблюдения 5,4 года показатель 4-летней БРВ в группе 6 месяцев трастузумаба составил 89,4%, в группе 12 месяцев – 89,8% (абсолютные различия 0,4%; отношение рисков (ОР) 1,05; 90% ДИ 0,93-1,24; non-inferiority р=0,01). Подгрупповой анализ БРВ показал преимущества более продолжительного 12-месячного курса трастузумаба при отрицательных гормональных рецепторах (ОР 1,26; 95% ДИ 0,97-1,64), ХТ только с таксанами (ОР 2,47; 95% ДИ 1,31-4,62), неоадъювантной ХТ (ОР 1,43; 95% ДИ 1,00-2,04) и конкурентном назначении ХТ и трастузумаба (ОР 1,53; 95% ДИ 1,16-2,01).
Показатель 4-летней общей выживаемости (ОВ) в группе 6 месяцев трастузумаба составил 93,8%, в группе 12 месяцев – 94,8% (абсолютные различия 1,0%; ОР 1,14; 90% ДИ 0,95-1,37; non-inferiority р=0,0006). Подгрупповой анализ ОВ показал преимущества более продолжительного 12-месячного курса трастузумаба в в тех же группах: при отрицательных гормональных рецепторах (ОР 1,51; 95% ДИ 1,10-2,06), ХТ только с таксанами (ОР 2,05; 95% ДИ 1,01-4,23), неоадъювантной ХТ (ОР 1,55; 95% ДИ 0,99-2,41) и конкурентном назначении ХТ и трастузумаба (ОР 1,61; 95% ДИ 1,13-2,29).
Сокращенный курс применения трастузумаба характеризовался значимо более низкой кардиотоксичностью: количество пациенток, которые прекратили лечение из-за развития серьезных сердечно-сосудистых осложнений, было в 2 раза меньшим – 4% против 8% в группах 6 и 12 месяцев соответственно.
Тем не менее, эксперты, не причастные к исследованию, настроены весьма осторожно. Президент ASCO Bruce Johnson из Dana-Farber Cancer Center (Бостон, США) считает, что, несмотря на значительное преимущество в отношении сердечно-сосудистых осложнений, полученных данных недостаточно для того, чтобы результаты исследования вошли в клинические рекомендации. «Нам нужно больше времени, чтобы данные созрели, – соглашается Richard Schilsky, главный медицинский специалист ASCO. – Например, еще не готовы зрелые сведения по общей выживаемости. К тому же результаты демонстрируют показатели для средней популяции, но определенно есть пациенты, которым сокращение длительности терапии вдвое не пойдет на пользу».
Авторы исследования планируют продолжить свою работу. В данный момент они собирают данные по качеству жизни пациентов и по финансово-экономическим затратам на лечение. На будущее запланирована работа по выделению из образцов опухоли и крови пациентов биомаркеров, которые помогут вычислить когорту больных, которым нужна более продолжительная терапия.
Рандомизированное исследование 3 фазы TAILORx (адъювантная химиотерапия (ХТ) и гормонотерапия (ГТ) по сравнению с одной ГТ у больных с гормонозависимым (ГР+) HER2-негативным РМЖ без метастазов в лимфоузлы (N0) и промежуточным прогнозом по данным анализа 21 гена (тест OncoTypeDx)): большинство больных ранним ГР+ РМЖ N0 не нуждаются в адъювантной химиотерапии.
Эти данные были представлены на ASCO 2018 (abstr. LBA1), параллельно вышла статья в New England Journal of Medicine.
Половину всех случаев РМЖ составляет гормонозависимый HER2-негативный подтип без поражения подмышечных лимфоузлов. Адъювантная ХТ снижает риск рецидива у молодых женщин с ГР+ HER2- РМЖ, статус лимфоузлов или степень злокачественности не оказывают значимого влияния. Однако различные панели экспертов включают в клинические рекомендации обязательную адъювантную ХТ для таких пациенток.
OncoType DX – это тест, который позволяет персонализированно оценить риск развития рецидива у больных гормонзависимым РМЖ. Генетическая панель из 21 гена определяет 3 группы риска. Низкий риск (0-10 баллов) оценивают как вероятность рецидива 2% в последующие 10 лет независимо от адъювантной химиотерапии. В группу высокого риска (26-31 баллов и выше, до 100 баллов) попадают пациентки, которым необходима адъювантная химиотерапия. Тактика лечения больных с промежуточным прогнозом (RS11-25, или так называемая «серая зона») до недавнего времени оставалась неясной.
В представленном на ASCO 2018 исследовании TAILORx израильские ученые оценили риск развития рецидива у 10 тысяч больных ранним (N0) гормонзависимым HER2-негативным РМЖ с помощью анализа экспрессии 21 опухолевого гена (тест OncoType Dx). Около 70% пациенток (6711 человек) попали в группу промежуточного прогноза. Эти пациентки были рандомизированы на две группы: адъювантной химио- и гормонотерапии или только гормонального лечения.
Исследование показало, что эффективность эндокринной терапии нисколько не уступает комбинированному лечению. Отношение рисков рецидива инвазивного РМЖ, повторного первичного РМЖ или летального исхода в группах ГТ/ХТ+ГТ составило 1,08; 95% ДИ 0,94-1,24, р=0,26. В течение 9 лет в обеих группах больных наблюдались примерно одинаковые показатели ВБП (83,3% в группе ГТ и 84,3% в группе ХТ-ГТ), отсутствия локорегионарного рецидивирования (92,2% против 92,9%) и отдаленного метастазирования (94,5% против 95,0%).
Подгрупповой анализ показал, что возраст моложе 50 лет является дополнительным фактором неблагоприятного прогноза, в результате чего удалось выделить когорту больных, которым, скорее всего, нужна профилактическая химиотерапия. Это женщины моложе 50 лет с риском развития рецидива 16-25 баллов по данным OncoType Dx (р=0,004). Если сумма баллов составляла 16-20, риск отдаленного рецидива у таких пациенток при проведении ХТ был ниже на 2%, если сумма 21-25 – ниже на 7%.
Charles L. Shapiro, профессор Tisch Cancer Institute (Нью-Йорк, США) и специалист по трансляционным исследованиям РМЖ, в комментарии порталу Medscape Medical News отметил, что результаты исследования способны перевернуть существующую клиническую практику. Около половины всех случаев РМЖ вполне соответствуют популяции исследования: это пациенты с гормонзависимым HER2-негативным раком N0. Треть больных неизбежно прогрессирует в течение 10 лет после лечения. Адъювантная химиотерапия призвана сократить риск рецидивирования, но, по словам профессора Shapiro, абсолютный выигрыш составляет всего 3-5%. «Это означает, что многих пациенток мы перелечиваем. Гормональной терапии в их случае будет достаточно», – поясняет он.
Следующий шаг – провести похожее исследование у больных, у которых опухоль распространилась на подмышечные лимфоузлы. В соответствующее исследование уже закончился набор женщин, у которых поражено от 1 до 3 аксиллярных лимфоузлов, а риск развития рецидива по результатам OncoType Dx менее 25. Профессор Shapiro полагает, что итоговые данные могут быть вполне похожи на результаты TAILORx.
Сразу в двух представленных на ASCO 2018 исследованиях оценили роль дополнительной овариальной супрессии у больных ранним ГР+ РМЖ в пременопаузе (abstr. 502, 503).
В одном из них были доложены обновленные результаты объединенного анализа рандомизированных исследований 3 фазы TEXT и SOFT.
Авторы оценили абсолютное увеличение выживаемости без отдаленных метастазов (ВБМ) при проведении адъювантной гормонотерапии (ГТ) у больных с гормонозависимым (ГР+) HER2-негативным РМЖ в пременопаузе. Показано, что в группе пациенток после адъювантной ХТ, которая назначалась в соответствии с известными клинико-морфологическими факторами риска, проведение адъювантной ГТ эксеместаном в комбинации с овариальной супрессией (ОС) увеличивает 8-летнюю ВБМ на 5% по сравнению с тамоксифеном + ОС или одним тамоксифеном. Различий в ВБМ между двумя последними подгруппами не выявлено. Также не различались показатели ВБМ в зависимости от назначенного вида ГТ у пациенток, которым не проводилась адъювантная ХТ (то есть в группе более низкого риска рецидива) (abstr. 503).
TEXT и SOFT – это рандомизированные клинические исследования III фазы, в которые в период с 11.2003 по 04.2011 было включено соответственно 2672 и 3066 женщин в пременопаузе с ранним ГР+ РМЖ. В обоих исследованиях суммарно 4690 пациенток были рандомизированы на группы адъювантной ГТ эксеместаном в комбинации с ОС или тамоксифеном + ОС. Для подавления функции яичников использовали ежемесячные инъекции агониста GnRH трипторелина в течение 5 лет (наиболее распространенный выбор в SOFT и TEXT), хирургическое удаление яичников или облучение яичников. В исследовании SOFT была также третья группа – 5 лет одного тамоксифена. В обоих исследованиях пациентки могли получать ХТ в качестве части адъювантного лечения так, как это было принято в клинической практике (около 55% включенных пациенток получали адъювантную ХТ, которая назначалась и проводилась до рандомизации на ГТ или ГТ+ОС в соответствии с общепринятыми клинико-морфологическими факторами риска).
Как было показано в первом анализе этих исследований, добавление ОС к терапии тамоксифеном статистически значимо увеличило бессобытийную (без рецидива РМЖ, инвазивного рака второй молочной железы и злокачественных опухолей других локализаций) и общую выживаемость. Замена тамоксифена на эксеместан в комбинации с ОС дополнительно снижала частоту рецидивов, включая отдаленные рецидивы, в особенности у женщин с HER2-негативным РМЖ. В то же время различий в общей выживаемости при замене тамоксифена на эксеместан не наблюдали.
На ASCO 2018 были отдельно проанализированы случаи с HER2-негативным гормон-рецептор-позитивным РМЖ (86% от всех пациенток). Исследователи изучили влияние режима адъювантной гормонотерапии на выживаемость без отдаленных рецидивов заболевания (то есть безметастатическую выживаемость) при медианах времени наблюдения 8 и 9 лет для исследований SOFT и TEXT соответственно. При этом все пациентки были разделены на группы в зависимости от исходного риска отдаленного рецидива. При оценке исходного риска рецидива учитывали возраст (с интервалом 5 лет), число пораженных регионарных лимфатических узлов (0, 1-3, ≥4), размер первичной опухоли (≤2 см, >2 см), экспрессию рецепторов эстрогенов (<50%, ≥50%), экспрессию рецепторов прогестерона (<20%, 20-49%, ≥50%), степень анаплазии (G1, G2, G3), экспрессию Ki-67 (<14%, 14-19%, 20-25%, ≥26%). Исходя из значений риска для каждого из указанных параметров (согласно модели пропорциональных рисков Кокса) рассчитывали суммарный риск для каждой пациентки. Различия между группами терапии изучали отдельно в каждом из исследований и в зависимости от того, получала ли пациентка адъювантную химиотерапию или нет.
По итогам анализа авторы пришли к заключению, что степень различий между изученными режимами гормонотерапии (ОС + эксеместан, ОС + тамоксифен или один тамоксифен) в значительной степени зависела от исходного риска рецидива. У больных с высоким риском применение эксеместана на фоне овариальной супрессии по сравнению с тамоксифеном на фоне овариальной супрессии или тамоксифеном в монотерапии увеличивало 8-летнюю выживаемость без отдаленных рецидивов на 10-15%. У пациенток промежуточного риска, большинство из которых получали адъювантную химиотерапию, различия составили 4-5%. У пациенток с низким риском рецидива потенциальный эффект исследуемой гормональной терапии (тамоксифен + ОС и эксеместан + ОС) по сравнению с монотерапией тамоксифеном может быть минимальным, так как даже в группе монотерапии тамоксифеном 8-летняя выживаемость без отдаленных рецидивов превысила 97%.
Во втором исследовании – рандомизированном исследовании 3 фазы ASTRRA – оценили роль добавления ОС к адъювантной ГТ тамоксифеном у молодых женщин с ГР+ РМЖ, которые после адъювантной ХТ остаются в пременопаузе или восстановили менструальную функцию. Показано, что добавление к тамоксифену ОС достоверно увеличивает 5-летнюю БРВ и ОВ (abstr. 502).
В отличие от предыдущих исследований SOFT и TEXT, в программу ASTRRA включались только пациентки после адъювантной ХТ (то есть высокого риска рецидива); 1293 пациентки были рандомизированы, 1282 – получали лечение по протоколу. Тамоксифен (Т) назначался на 5 лет, в экспериментальной группе добавляли ОС гозерелином в течение первых двух лет терапии (это более короткая продолжительность ОС по сравнению с исследованиями SOFT и TEXT, где ОС проводилась в течение всех 5 лет лечения). При медиане наблюдения 63 мес. 5-летняя БРВ составила 91,1% в группе T + ОС и 87,5% в группе одного тамоксифена (ОР=0,686; 95% ДИ 0,483 до 0,972; р=0,029); 5-летняя ОВ составила 99,4% в группе T + ОС и 97,8% в группе Т-только (ОР=0,310; 95% ДИ 0,102-0,941; р=0,029). Авторы делают вывод о том, что у больных ГР+ РМЖ, которые нуждались в назначении адъювантной ХТ и сохранили или восстановили менструальную функцию, добавление ОС в течение первых двух лет приема тамоксифена достоверно увеличивает показатели выживаемости.
Рибоциклиб + фулвестрант у женщин в постменопаузе с гормональным рецептор-положительным (ГР+) HER2-негативным (HER2-) прогрессирующим РМЖ: результаты рандомизированного исследования 3 фазы MONALEESA-3 (abstr. 1000). Добавление рибоциклиба достоверно увеличивало выживаемость без прогрессирования болезни (ВБП) по сравнению с одной гормонотерапией (ГТ).
На конференции ASCO 2018 проф. Dennis J. Slamon впервые представил анализ результатов исследования MONALLISA-3 – многоцентрового двойного слепого плацебо-контролируемого исследования по изучению эффективности и безопасности ингибитора CDK4/6 рибоциклиба в комбинации с фулвестрантом у женщин в постменопаузе и у мужчин с гормоночувствительным HER2-негативным мРМЖ. Включались две категории пациентов: так называемые treatment naive, которые не получали лечения по поводу метастатической формы заболевания (в анамнезе допускалось проведение адъювантной ГТ, но период от ее окончания до выявления прогрессирования болезни должен был превышать 12 мес.), либо получившие не более 1 линии лечения по поводу мРМЖ (или с прогрессированием на фоне адъювантной ГТ, а также в срок до 12 мес. от ее окончания).
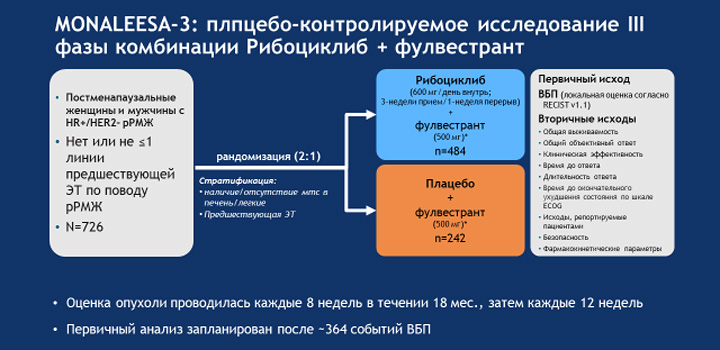
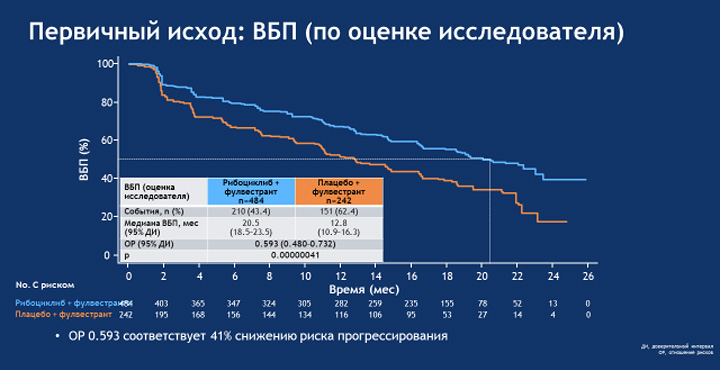
В исследование включено 726 пациентов с ≥1 измеряемым проявлением болезни (по шкале RECIST 1.1) либо ≥1 литического очага в костях, со статусом 0-1 по шкале ECOG. Добавление рибоциклиба привело к статистически достоверному и клинически значимому увеличению выживаемости без прогрессирования в сравнении с пациентами, получавшими плацебо и фулвестрант (медиана ВБП 20,5 мес. в группе рибоциклиб + фулвестрант в сравнении с 12,8 мес. в группе плацебо + фулвестрант; ОР 0,593; p=0,00000041; 41% снижение риска прогрессирования заболевания и смертельного исхода в сравнении с плацебо).
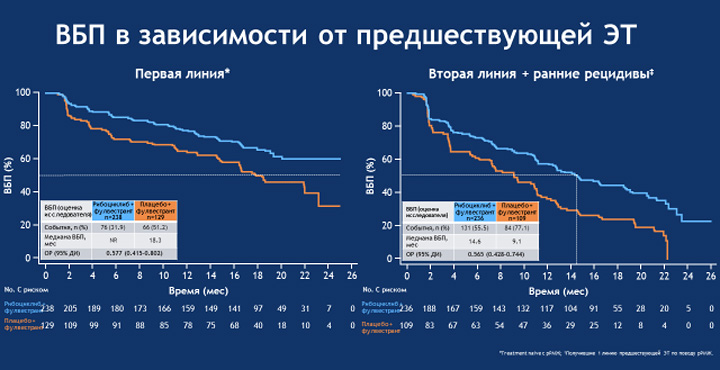
Подгрупповой анализ показал, что преимущества от добавления рибоциклиба к фулвестранту отмечались во всех подгруппах пациенток. Выигрыш также не зависел и от линии лечения: удлинение ВБП отмечалось как в первой линии терапии мРМЖ (медиана ВБП на момент анализа в группе рибоциклиб + фулвестрант не достигнута, в группе плацебо + фулвестрант составила 18,3 мес.; ОР 0,577; 95% ДИ 0,415-0,802), так и у больных, которые прогрессировали на предшествующей ГТ (медиана ВБП 14,6 мес. в сравнении с 9,1 мес. в группах рибоциклиб + фулвестрант и плацебо + фулвестрант соответственно; ОР 0,565; 95% ДИ 0,428-0,744).
Комбинация рибоциклиба с фулвестрантом продемонстрировала управляемый профиль безопасности, сравнимый с данными по безопасности в предыдущих исследованиях 3 фазы рибоциклиба.
Это исследование впервые показало, что комбинация ингибитора CDK4/6 и фулвестранта эффективна как при de novo мРМЖ, так и у пациентов с рецидивом более >12 месяцев после окончания предшествующей (нео)адъювантной эндокринотерапии. Таким образом, комбинация рибоциклиба с фулвестрантом может быть новой опцией первой и второй линий терапии для женщин в постменопаузе с гормоночувствительным HER2-негативным мРМЖ.
Анализ биомаркеров в исследовании MONALEESA-2 (abstr. 1022).
На конференции ASCO 2018 проф. GN Hortobagyi представил анализ данных ВБП из исследования MONALEESA-2 [3] в зависимости от уровня экспрессии различных генов. Результаты исследования MONALEESA-2 (NCT01958021) были опубликованы ранее [2]. Пациенты были рандомизированы в соотношении 1:1 на получавших рибоциклиб (600 мг/д; 3 недели прием / 1 неделя перерыв в течении 28-дневного цикла) + летрозол (2,5 мг/д; непрерывно) или плацебо + летрозол. Для оценки корреляции между уровнем экспрессии генов и ВБП пациенты были классифицированы на подгруппы с низким и высоким уровнем экспрессии мРНК с определением медианы экспрессии (50%) на момент анализа.
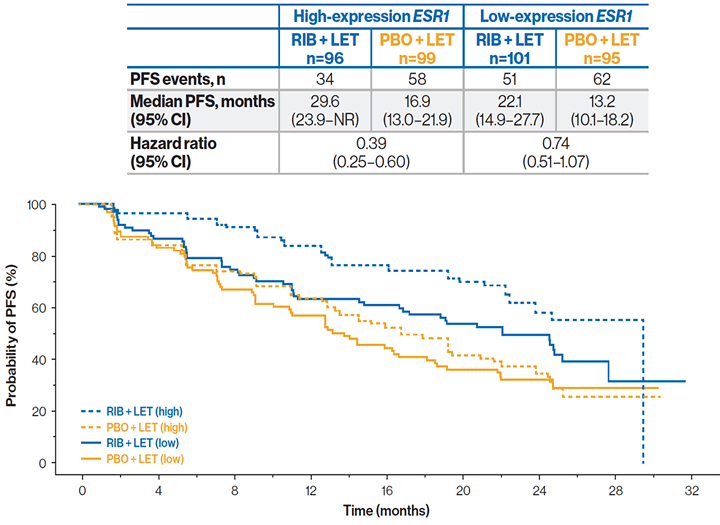
К моменту анализа данных 96 из 197 пациентов в группе рибоциклиба и 99 из 194 пациентов в группе плацебо имели высокий уровень экспрессии гена эстрогеновых рецепторов (ESR1). Отмечалась тенденция к увеличению ВБП у пациентов с высоким уровнем экспрессии ESR1 в обеих группах (рибоциклиб + летрозол и плацебо + летрозол). Преимущество добавления рибоциклиба было выше у пациентов с высоким уровнем экспрессии ESR1 (ОР 0,39) в сравнении с низким уровнем (ОР 0,74).
ВБП в зависимости от уровня экспрессии гена ESR1:
Комбинация рибоциклиб + летрозол увеличивала ВБП в сравнении с использованием плацебо + летрозол как для пациентов с высоким, так и с низким уровнем экспрессии гена E2F1 сигнального пути CDK. Отмечалась тенденция к удлинению ВБП у пациентов с низким уровнем экспрессии E2F1.
ВБП в зависимости от уровня экспрессии гена E2F1:
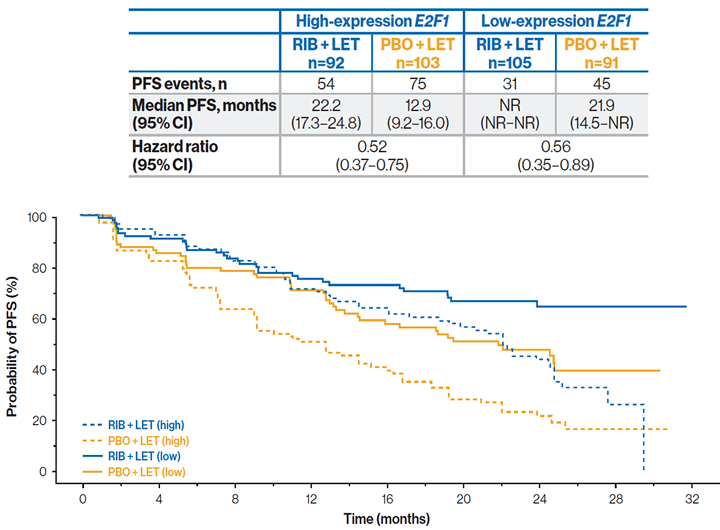
Добавление рибоциклиба к летрозолу в первой линии терапии гормоночувствительного HER2- мРМЖ обеспечивало увеличение ВБП во всех подгруппах экспрессии генов.
Подгрупповой анализ ВБП в зависимости от уровней экспрессии генов:
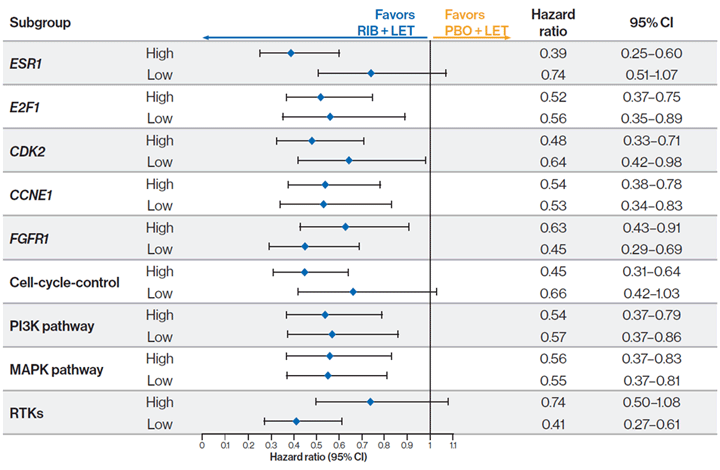
Выводы авторов: тенденция к большей эффективности рибоциклиба наблюдалась у пациентов с высокой экспрессией в сравнении с низкой экспрессией гена рецепторов эстрогена (ESR1), с высокой экспрессией в сравнении с низкой экспрессией гена, контролирующего клеточный цикл, и с низкой экспрессией в сравнении с высокой экспрессией гена рецепторов тирозинкиназы (RTK).
В заключении авторы отметили, что более короткая медиана ВБП для группы плацебо + летрозол у пациентов с высокой и низкой экспрессией генов, контролирующих клеточный цикл, указывает на то, что высокая экспрессия генов, контролирующих клеточный цикл, может вызывать резистентность к лечению одним только летрозолом. Гены, предположительно участвующие в механизмах резистентности к ингибиторам CDK 4/6, требуют дальнейшего изучения в более крупных клинических исследованиях с использованием дополнительных методов.
Литература: