18.06.2018

Мы переживаем очень интересный период развития онкологии: идет совершенствование подходов к терапии ингибиторами контрольных точек – углубление знаний о предикторах ответа, попытки комбинированного использования препаратов этой группы, комбинации ингибиторов контрольных точек с цитостатиками; внедрение новых таргетных препаратов для опухолей с активирующими мутациями. Конгресс ASCO 2018 года продемонстрировал эти подходы в полной мере.
Наиболее интересные исследования, представленные на ASCO 2018:
| Немелкоклеточный рак легкого (НМРЛ) | |||
|---|---|---|---|
| Иммунотерапия распространенного НМРЛ | Комбинации препаратов в терапии распространенного НМРЛ | Таргетная терапия | Терапия локализованных форм НМРЛ |
| KEYNOTE 042 KEYNOTE 407 |
NEJ026 NEJ009 LADIE IMP150 IMP131 CM227 |
ARCHER1050 KCSG-LU-15-09 |
8502 SAKK 16/14 |
| Мелкоклеточный рак легкого | Мезотелиома | ||
| TRINITY СМ032 |
DREAM | ||
Среди работ, посвященных совершенствованию подходов к терапии локализованных форм рака легкого, обращает на себя внимание исследование практического применения комплекта для сбора лимфатических узлов при проведении резекции при НМРЛ, представленного Raymond Osarogiagbon (абстракт 8502). Проспективное, популяционное, с пошаговым внедрением исследование, включающее всех пациентов, кому производилась резекция при НМРЛ с лечебной целью в 11 госпиталях, имеющих право на лечение (с ≥5 резекциями/год), в 4 прилегающих специализированных клиниках в восточном Арканзасе, северном Миссисипи, восточном Теннесси.
Хирургическая резекция является наилучшим лечебным методом для НМРЛ, но общая выживаемость (ОВ) варьирует в зависимости от качества патологоанатомического (p) стадирования поражения лимфатических узлов (LN). Было изучено влияние предварительно маркированного набора для сбора лимфатических узлов на качество стадирования pLN, оперативные (ОО) осложнения и ОВ.
По результатам исследования из 1171 операций, выполненных 32 хирургами в 2014-2017 гг., комплект для сбора лимфатических узлов использовали в 650 (56%) операциях у 20 хирургов. Возраст, раса, пол, распределение по клиническим стадиям были одинаковыми между группами.
Сравнивая пациентов, у которых использовали набор, и пациентов, у которых проводили стадирование без использования набора, среднее время операции составляло 124 против 144 мин. (p<0,0001), количество трансфузий – 9% против 5% (p=0,02), все другие периоперационные осложнения были сходными, неполные (не R0) резекции составили 3% против 4% (p=0,39).
Качество стадирования лимфоузлов: частота pNX – 0% против 7%; отсутствуют средостенные лимфоузлы – 2% против 18%; достижение критериев качества NCCN (R0 + анатомическая резекция + ≥1 N1 + ≥3 средостенных лимфатических узлов) – 77% против 31% (p<0,0001 для всех); повторная госпитализация в сроки до 60 дней – 15% в сравнении с 13% (p=0,35); смертность в сроки 60 дней после операции – 3% против 5% (p=0,02).
При медиане продолжительности наблюдения 20 месяцев 3-летняя ОВ составила 80% в группе с использованием набора и 73% в случаях без набора (p=0,005), отмечалось снижение отношения рисков >30% (0,67 [0,50-0,89]; p=0,005) в случаях с использованием набора.
При анализе чувствительности, исключая сублобарные резекции, 60-дневную летальность и хирургов, не использующих методику (для оценки возможного воздействия высокопроизводительных хирургов с использованием набора), HR варьировал от 0,54 до 0,61 (все p<0,013).
Таким образом, метод сбора лимфатических узлов улучшает качество стадирования и ОВ, не увеличивая смертность при радикальной резекции НМРЛ.
Продолжаются исследования по неоадъювантной терапии НМРЛ. Одно из наиболее интересных – многоцентровое одногрупповое исследование II фазы SAKK 16/14, в котором изучается добавление к стандартной неоадъювантной химиотерапии у пациентов с IIIA(N2) стадией НМРЛ анти-PD-L1 антитела дурвалумаб (MEDI4736).
Критериями включения были патоморфологически подтвержденный НМРЛ IIIA стадии (N2) (T1-3 N2 M0) в соответствии с 7-й версией классификации TNM, вне зависимости от гистологического подтипа, генетических нарушений или статуса экспрессии PD-L1. Пациенты с потенциально резектабельной опухолью получали 3 цикла химиотерапии цисплатином 100 мг/м2 и доцетакселом 85 мг/м2 каждые 3 недели с последующей терапией дурвалумабом 750 мг каждые 2 недели. После проведения хирургического лечения пациенты продолжали получать дурвалумаб в дозе 750 мг каждые 2 недели до года. Первичная конечная точка – 1-годичная бессобытийная выживаемость. Вторичные конечные точки включали ОВ, ЧОО, полноту резекций, варианты рецидивов и токсичность. Дополнительно реализуется исследовательская программа по поиску предиктивных биомаркеров для анти PD-L1 терапии. Согласно протоколу первый анализ по безопасности был проведен после хирургического вмешательства у первых 25 пациентов. Данный анализ демонстрирует 30-дневную послеоперационную летальность менее 10%. Исследование будет продолжено согласно протоколу.
В открытом исследовании 3 фазы KEYNOTE-042 изучалось применение пембролизумаба в сравнении с платиновыми дуплетами в качестве первой линии терапии при распространенном/метастатическом НМРЛ у пациентов с уровнем экспрессии PD-L1 (TPS) ≥1%.
Пациенты были рандомизированы 1:1 и получали пембролизумаб 200 мг каждые 3 недели ≤35 циклов или терапию по выбору врача ≤6 циклов паклитаксел+карбоплатин или пеметрексед+карбоплатин с возможностью поддерживающей терапии пеметрекседом (для пациентов с неплоскоклеточным НМРЛ).
1274 пациента были рандомизированы (по 637 в каждую группу); 599 пациентов (47,0%) имели TPS ≥50%, 818 (64,2%) имели TPS ≥20%. При медиане длительности наблюдения 12,8 мес. 13,7% пациентов продолжали получать терапию пембролизумабом и 4,9% получали поддерживающую терапию пеметрекседом.
| PD-L1 | ||||||
|---|---|---|---|---|---|---|
| ≥50% | ≥20% | ≥1% | ||||
| пембро N=299 |
х/т N=300 |
пембро N=413 |
х/т N=405 |
пембро N=637 |
х/т N=637 |
|
| ОВ | ||||||
| HR (95% ДИ) | 0,69 (0,56-0,85) | 0,77 (0,64-0,92) | 0,81 (0,71-0,93) | |||
| P | 0,0003 | 0,0020 | 0,0018 | |||
| Медиана (95% ДИ), мес. | 20,0 (15,4-24,9) |
12,2 (10,4-14,2) |
17,7 (15,3-22,1) |
13,0 (11,6-15,3) |
16,7 (13,9-19,7) |
12,1 (11,3-13,3) |
Таким образом, применение пембролизумаба значительно увеличило показатели ОВ по сравнению с химиотерапией среди пациентов с уровнем экспрессии PD-L1≥50% (HR 0,69): медиана ОВ составила 20 мес. против 12,2 мес. в группе химиотерапии, 17,7 мес. против 13,0 мес. при уровне экспрессии PD-L1 ≥20% (HR 0,77) и 16,7 мес. против 12,1 мес. при уровне экспрессии PD-L1 ≥1% (HR 0,81).
Эффективность и безопасность применения комбинации карбоплатина/паклитаксела или наб-паклитаксела с пембролизумабом или плацебо у пациентов с метастатическим плоскоклеточным раком легкого изучалось в рандомизированном, плацебо-контролируемом, международном исследовании III фазы KEYNOTE 407.
В исследование были включены 560 пациентов, не получавших ранее лечение по поводу метастатического плоскоклеточного НМРЛ, имеющих статус ECOG 0-1. Пациенты были стратифицированы по варианту получаемых таксанов, статусу экспрессии PD-L1 (<1% vs. >1%) и региону (Восточная Азия vs. другие регионы). Включенные пациенты были рандомизированы 1:1 в группу, получавшую карбоплатин 6 мг/мл/мин и паклитаксел 200 мг/м2 каждые 3 недели или наб-паклитаксел 100 мг/м2 еженедельно плюс пембролизумаб или плацебо в течение 4 циклов с последующим введением пембролизумаба или плацебо до 35 введений.
Первичные конечные точки – выживаемость без прогрессирования (ВБП) по независимой оценке, ОВ в общей популяции. Вторичные конечные точки – частота объективных ответов (ЧОО) по независимой оценке.
Первый промежуточный анализ выполнен для 204 пациентов (101 – в группе пембролизумаб+химиотерапия и 103 – в группе химиотерапии) с медианой длительности наблюдения 7,7 мес. (диапазон 0,4-13,9 мес.). 78% пациентов были мужчинами, 48% – младше 65 лет, 28% – имели статус ECOG 0. Уровень экспрессии PD-L1 у 35% был <1%. 32% больных получили наб-паклитаксел.
ЧОО по независимой оценке в группе пембролизумаб+химиотерапия составила 58,4% в сравнении с 35,0% в группе химиотерапии (p=0,0004). Длительность ответа на терапию более 6 мес. была достигнута у 65,8% больных в группе пембролизумаб+химиотерапия и 45,6% в группе химиотерапии. Нежелательные явления (НЯ) ≥3 степени наблюдались у 64,4% пациентов в группе пембролизумаб+химиотерапия и у 74,5% в группе химиотерапии.
В рандомизированном исследовании III фазы IMP150 сравнивалась эффективность комбинаций атезолизумаб+паклитаксел / карбоплатин±бевацизумаб и бевацизумаб+паклитаксел / карбоплатин в первой линии терапии неплоскоклеточного НМРЛ.
Пациенты были рандомизированы на 3 группы (N=1202):
Минимальная длительность наблюдения составила 13,5 мес. Эффективность (группа B по сравнению с группой С) в популяции пациентов без активирующих мутаций была:
Эффективность в группе А по сравнению с группой С:
Безопасность (группа В по сравнению с группой А и группой С):
| n | HR (95% ДИ) | Медиана ОВ (атезолизумаб + бевацизумаб + химиотерапия) |
Медиана ОВ (бевацизумаб + паклитаксел/карбоплатин) |
|
|---|---|---|---|---|
| Общая популяция пациентов (включая EGFR/ALK+) |
800 | 0,76 | 19,8 мес. | 14,9 мес. |
| Пациенты с отсутствием активирующих мутаций | 696 | 0,78 (0,64-0.96) | 19,2 мес. | 14,7 мес. |
| EGFR/ALK+ | 104 | 0,54 (0,29-1,03) | не достигнута | 17,5 мес. |
| Метастазы в печень | 94 | 0,54 (0,33-0,88) | 13,2 мес. | 9,1 мес. |
| Отсутствие метастазов в печень | 602 | 0,83 | 19,8 мес. | 16,7 мес. |
| Подгрупповой анализ среди пациентов без драйверных мутаций | ||||
| TC1/2/3 или IC1/2/3 | 357 | 0,77 (0,58-1,04) | 22,5 мес. | 16,4 мес. |
| TC3 или IC3 | 136 | 0,70 (0,43-1,13) | 25,2 мес. | 15,0 мес. |
| TC1/2 или IC1/2 | 226 | 0,80 (0,55-1,15) | 20,3 мес. | 16,4 мес. |
| TC0 и IC0 | 339 | 0,82 (0,62-1,08) | 17,1 мес. | 14,1 мес. |
Таким образом, исследование продемонстрировало разочаровывающие результаты в отношении общей выживаемости (HR 0,78 в общей популяции), но более заметные преимущества среди пациентов с EGFR/ALK+ (HR 0,54)
В исследовании III фазы IMpower 131, изучающем эффективность и безопасность комбинации атезолизумаб+карбоплатин+паклитаксел или наб-паклитаксел в сравнении с карбоплатином+паклитакселом или наб-паклитакселом в первой линии терапии распространенного плоскоклеточного НМРЛ, был проведен первичный анализ ВБП и безопасности.
Пациенты были рандомизированы в соотношении 1:1:1 в группу А (атезолизумаб 1200 мг каждые 3 недели + карбоплатин AUC 6 каждые 3 недели + паклитаксел 200 мг/м2 каждые 3 недели), группу В (атезолизумаб + карбоплатин + наб-паклитаксел 100 мг/м2 еженедельно) или группу С (карбоплатин + наб-паклитаксел). Пациенты получали 4-6 курсов химиотерапии и атезолизумаб до прогрессирования. Представлен первичный анализ ВБП по оценке исследователей в общей популяции для группы В в сравнении с группой С.
Результаты:
Минимальная длительность наблюдения составила 9,8 месяца. Медиана ВБП составила 6,3 мес. в группе В и 5,6 мес. в группе С (HR 0,715; 95% ДИ 0,603-0,848; P=0,0001). Преимущества по ВБП были достигнуты среди всех PD-L1-положительных подгрупп пациентов и было наибольшим у пациентов с высокой экспрессией PD-L1 на опухолевых (TC3) или иммунных (IC3) клетках.
Связанные с терапией НЯ были зарегистрированы у 91,3% (группа A), 94,6% (группа B) и 90,7% (группа C) пациентов; НЯ 3-4 степени наблюдались у 42,8% (группа A), 68,0% (группа B) и 56,9% (группа C). Серьезные НЯ наблюдались у 22,3% (группа A), 20,4% (группа B) и 10,5% (группа C).
| Группа B N=343 |
Группа C N=340 |
|
|---|---|---|
| Медиана ВБП (95% ДИ), мес. | 6,3 (5,7-7,1) | 5,6 (5,5-5,7) |
| HR (95% ДИ); P | 0,715 (0,603-0,848); 0,0001 | |
| 12-мес. ВБП, % | 24,7 | 12,0 |
| ЧОО, % | 59,4 | 51,3 |
| Медиана длительности ответа (95% ДИ), мес. | 6,6 (5,7-7,1) | 4,4 (4,2-5,2) |
| Продолжающиеся ответы, % | 27,1 | 14,9 |
4 июня 2018 года были представлены новые данные по применению комбинации ниволумаба с ипилимумабом в сравнении с платиносодержащей химиотерапией в первой линии PD-L1 отрицательных пациентов с НМРЛ (CheckMate 227).
В исследование было включено 550 пациентов.
Месяцем ранее на конгрессе AACR 2018 были показаны первые результаты этого исследования по применению комбинированного лечения ниволумабом и ипилимумабом в первой линии НМРЛ с высокой мутационной нагрузкой. Было показано, что назначение комбинированной иммунотерапии у пациентов с высокой мутационной нагрузкой (≥10 мутаций) позволяет значимо улучшить ВБП по сравнению со стандартной химиотерапией. Однолетняя ВБП в группе ниволумаб + ипилимумаб составила 46,2%, а в группе химиотерапии – 13,2% (относительный риск 0,58; P<0,001). Частота ответа составила 45,3% при использовании комбинированной иммунотерапии и 26,9% при назначении химиотерапии.
На конгрессе ASCO было показано, что комбинированное применение ниволумаба с химиотерапией у PD-L1 отрицательных пациентов позволяет увеличить ВБП до 26% по сравнению с химиотерапией – 14% (относительный риск 0,74). Также в группе комбинации ниволумаба с химиотерапией отмечено увеличение ЧОО (36,7% против 23,1%) и медианы длительности ответа (7,2 мес. против 4,7 мес.). Наиболее интересным в этом докладе был анализ эффективности комбинации двух ингибиторов контрольных точек или ниволумаба с химиотерапией по сравнению с химиотерапией у пациентов с высокой мутационной нагрузкой и отрицательной экспрессией PD-L1. Так, однолетняя ВБП в группе комбинации ниволумаба с ипилимумабом составила 45%, в группе ниволумаба с химиотерапией – 27% и в группе химиотерапии – 8%. НЯ 3-4 степени наблюдались в 25%, 52% и 35% случаев соответственно.
| Эффективность и безопасность | Ниволумаб + химиотерапия (n=177) | Химиотерапия (n=186) | Ниволумаб + ипилимумаб (n=38) |
|---|---|---|---|
| Медиана ВБП (общая популяция) HR (95% ДИ) 1-годичная ВБП |
5,6 мес. 0,74 (0,58-0,94) 26% |
4,7 мес. – 14% |
– |
| Медиана ВБП (TMB≥10mut/Mb) (PDL1<1%) HR (95% ДИ) 1-годичная ВБП |
6,2 мес. 0,56 (0,35-0,91) 27% |
5,3 мес. – 8% |
7,7 мес. 0,48 (0,27-0,85) 45% |
| Медиана ВБП (TMB<10mut/Mb) (PDL1<1%) HR (95% ДИ) 1-годичная ВБП |
4,7 мес. 0,87 (0,57-1,33) 18% |
4,7 мес. – 16% |
3,1 мес. 1,17 (0,76-1,81) 18% |
| Медиана длительности ответа на терапию (TMB<10mut/Mb) (PDL1<1%) ≥1-годичная длительность ответа на терапию |
7,4 мес. 33% |
4,4 мес. NC |
Не достигнута 93% |
| ЧОО (PDL1<1%) | 36,7% | 23,1% | – |
| Связанные с лечением НЯ 3-4 степени Прекращение терапии, вызванное НЯ |
52% 13% |
35% 14% |
25% 16% |
Таким образом, результаты исследования CheckMate 227 позволяют говорить о возможности улучшения эффективности терапии НМРЛ в первой линии при комбинированном назначении ниволумаба с ипилимумабом у пациентов в высокой мутационной нагрузкой, а ниволумаба и химиотерапии – у пациентов с отрицательной экспрессией PD-L1. Учитывая, что мутационная нагрузка и PD-L1 экспрессия являются независимыми биомаркерами, актуальным становится внедрение индивидуализированного подхода к подбору лечения в первой линии НМРЛ без активирующих мутаций.
Развитие терапии EGFR-мутированного НМРЛ ранее было сфокусировано на монотерапии гефитинибом, эрлотинибом, афатинибом и осимертинибом.
Комбинации ингибиторов EGFR с ингибиторами VEGF или цитостатиками являются одними из стратегических кандидатов на лечение EGFR-мутантной опухоли.
Исследование 3 фазы, сравнивающее бевацизумаб и эрлотиниб с эрлотинибом у пациентов с нелеченным НМРЛ с активирующими мутациями EGFR (NEJ026), было представлено на конгрессе.
Не получавшие химиотерапию пациенты с распространенным неплоскоклеточным НМРЛ с EGFR-мутацией были рандомизированы для приема либо комбинации с эрлотинибом (150 мг в день) + бевацизумаб (15 мг/кг внутривенно 1 раз в 3 недели), либо эрлотиниба (150 мг в день). Статус мутаций EGFR в образцах плазмы регулярно контролировали во время исследования и при проведении терапии второй линии. Первичной конечной точкой была ВБП. Вторичными конечными точками были ОВ, ЧОО, безопасность и качество жизни.
С 3 июня 2015 года по 31 августа 2016 года в исследование были включены 228 пациентов с мутациями EGFR. Был один отказ от участия в исследовании до начала терапии и одно изъятие согласия; остальные 226 пациентов были рандомизированы в группу бевацизумаб + эрлотиниб (n=112) или только эрлотиниб (n=114). Предварительный анализ проводился при достижении 117 событий ВБП с использованием полного набора анализов из 224 пациентов, за исключением как случая, не имеющего права на участие, так и случая, потерянного для последующего наблюдения в группе эрлотиниба. Медиана длительности наблюдения за пациентами составила 12,4 мес. Промежуточный анализ показал, что исследование достигло своей первичной конечной точки. При срезе данных на 21 сентября 2017 г. медиана ВБП составляла 16,9 месяца (95% ДИ 14,2-21,0) в группе бевацизумаб + эрлотиниб и 13,3 месяца (11,1-15,3) в группе эрлотиниба (p=0,0157) (отношение рисков 0,605; 95% ДИ 0,417-0,877). Хотя частота кровотечений, протеинурии и гипертонии значительно увеличились в группе бевацизумаб + эрлотиниб по сравнению с эрлотинибом, не было существенной разницы между другими НЯ в этих группах. У 5 пациентов, получавших эрлотиниб, был отмечен пневмонит; в группе бевацизумаб + эрлотиниб пневмониты отсутствовали. Смертей, связанных с лечением, не наблюдалось.
В этом исследовании комбинация бевацизумаба с эрлотинибом, как комбинация ингибитора EGFR и ингибитора VEGF, продемонстрировала стойкий ответ и хорошую переносимость. Эта комбинация рассматривается как новый стандарт терапии пациентов с EGFR мутированным НМРЛ.
Продолжается изучение комбинированного применения ингибиторов тирозинкиназы с цитостатиками. Японское исследование 3 фазы NEJ009, в котором изучается совместное применение гефитиниба+карбоплатин / пеметрексед в сравнении с монотерапией гефитинибом в 1 линии EGFR-мутированного НМРЛ, включало первичные конечные точки: ВБП, ВБП2 (ВБП2 был определен как ВБП1 в группе гефитиниб + карбоплатин / пеметрексед) и ОВ. 344 пациента, ранее не получавших терапию, с EGFR-мутированным (Del19 или L858R) НМРЛ были рандомизированы в соотношении 1:1 в указанные группы. Из них 60% больных имели ECOG 0, 35% были мужчинами и 26% имели метастазы в ЦНС.
Зрелость данных по ОВ составила ~53% (101 событие в группе гефитиниба и 83 – в комбинированной группе). 65,1% НЯ ≥3 степени были зарегистрированы на фоне терапии гефитинибом + карбоплатин /пеметрексед (против 31,4% с карбоплатином/пеметрекседом). Наиболее распространенными НЯ ≥3 степени были нейтропения (31,4% против 0,6%), анемия (21,3% против 20,3%), тромбоцитопения (17,2% против 0%) и дисфункция печени (11,8% против 21,5%). Частота прекращения терапии из-за развития НЯ составила 9,9% против 10,7%.
| Гефитиниб +карб/пем | Гефитиниб | Отношение рисков (95% ДИ) |
p | |
|---|---|---|---|---|
| Медиана ВБП (95% ДИ) | 20,9 мес. (18,0-24,2) |
11,2 мес. (9,0-13,4) |
ОР=0,493 (0,390-0,623) |
p<0,001 |
| Медиана ВПБ2 (95% ДИ) | 20,9 мес. (18,0-24,2) |
21,1 мес. (17,9-24,9) |
ОР=0,891 (0,708-1,122) |
p=0,806 |
| Медиана ОВ | 52,2 мес. | 38,8 мес. | ОР=0,695 | p=0,01 |
В опубликованных ранее исследованиях 2 фазы NEJ005 (параллельное назначение против последовательного гефитиниб + карб / пем в 1 линии EGFR-мутированного НМРЛ; n=80): медиана ВБП составила 17,5 мес. против 15,3 мес., медиана ОВ – 41,9 мес. против 30,7 мес., ЧОО – 90% против 82%; NEJ002 (гефитиниб против химиотерапии в 1 линии EGFR мутированного НМРЛ): медиана ОВ – 34,8 мес. против 22,6 мес. (p=0,003) у пациентов, получивших последующий пеметрексед или доцетаксел (n=131), по сравнению с теми, кто не получил этой терапии.
Обратите внимание, что медиана ОВ была выше, чем ожидалось в плече сравнения (медиана ОВ 38,8 месяца), потенциально из-за интенсивного использования химиотерапии (в среднем 16 циклов пеметрекседа в исследовании).
По данным предыдущих исследований, в первой линии терапии EGFR-мутированного НМРЛ медианы ОВ составляли 27,9 мес. против 24,5 мес. в исследовании LuxLung 7 (афатиниб против гефитиниба), 34,1 мес. против 26,8 мес. в ARCHER1050 (дакомитиниб против гефитиниба) и 27,7 мес. против 26,6 мес. в NEJ002 (гефитиниб против химиотерапии). В настоящем исследовании гефитиниб ± карбоплатин / пеметрексед) продемонстрирована медиана ОВ 52,2 месяца против 38,8 месяца в группе гефитиниба (ОВ, отношение рисков = 0,695; p=0,01), а медиана ВБП – 20,9 месяца против 11,2 месяца (ВПБ, отношение рисков = 0,493; p<0,001) в 1 линии терапии EGFR-мутированного НМРЛ. Токсичность соответствовала ожиданиям. Таким образом, данная стратегия вполне может быть оправдана в 1 линии EGFR-мутированного НМРЛ.
В последнее время описаны два важных механизма, участвующих в канцерогенезе рака легкого у женщин: вовлечение сигнального пути EGFR и потенциальное влияние гормональных факторов.
Ранее было показано взаимодействие между рецепторами эстрогенов и сигнальным каскадом от рецептора эпидермального фактора роста. Доклинические данные продемонстрировали, что комбинация ингибиторов тирозинкиназы EGFR с антиэстрогенами может способствовать преодолению резистентности. В рандомизированном исследовании 2 фазы IFCT-1003 LADIE оценивали эффективность терапии ингибиторами тирозинкиназы EGFR по сравнению с ингибиторами тирозинкиназы EGFR и антиэстрогенной терапией у женщин с распространенным неплоскоклеточным НМРЛ. Главной задачей исследования была оценка ВБП у пациенток с диким типом рецептора EGFR и пациенток с наличием активирующей мутации в гене EGFR, а также ОВ. Дизайн исследования представлен на схеме.
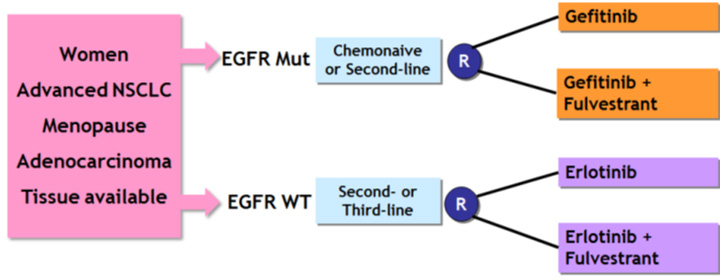
Медиана ВБП составила 10,9 мес. и 9,4 мес. в группах только гефитиниба и гефитиниба + фулвестранта соответственно. Медиана ОВ в этих группах была 29,9 мес. и 22,1 мес. Медиана ВБП в группе монотерапии эрлотинибом составила 2 мес. и в группе комбинации с фулвестрантом – 1,8 мес. Медиана ОВ в этих группах была 7,3 мес. и 10 мес.
Добавление фулвестранта к ингибиторам тирозинкиназы не способствует улучшению результатов терапии, и исследование 3 фазы проводиться не будет.
Было проведено открытое, многоцентровое, одногрупповое исследование 2 фазы, изучающее эффективность осимертиниба у пациентов с НМРЛ с редкими мутациями EGFR (KCSG-LU15-09).
В исследовании оценивали активность осимертиниба 80 мг у пациентов (n=36) с НМРЛ (из них получали осимертиниб в первой линии 61% пациентов), с активирующими мутациями EGFR, отличными от ex19del, L858R, T790M или ex20ins. Частота объективного ответа составила 50,0%, контроль над заболеванием – 88,9%, медиана ВПБ – 9,5 мес., средняя продолжительность ответа – 7,0 мес. Неожиданных данных по токсичности не было получено.
| Дакомитиниб | Гефитиниб | |||||
|---|---|---|---|---|---|---|
| n | Медиана ОВ (95% ДИ) |
n | Медиана ОВ (95% ДИ) |
HR (95% ДИ) | p (2-стороннее) |
|
| Общая популяция | 227 | 34,1 мес. (29,5-37,7) |
225 | 26,8 мес. (23,7-32,1) |
HR=0,76 (0,582-0,993) |
p=0,044 |
| Раса | ||||||
| Неазиаты | 57 | 29,5 мес. (20,7 – не достигнута) |
49 | 20,6 мес. (16,1-25,5) |
HR=0,721 (0,433-1,201) |
p=0,2073 |
Профессор Tony Mok на ASCO в этом году представил информацию о полученных недавно в исследовании ARCHER 1050 данных по ОВ дакомитиниба у пациентов с EGFR-положительным НМРЛ. Основные ключевые моменты:
| Азиаты | 170 | 34,2 мес. (30,1-NR) |
176 | 29,1 мес. (25,2-NR) |
HR=0,812 (0,595-1,108) |
p=0,1879 |
| Статус EGFR | ||||||
| Del19 | 134 | 34,1 мес. (30,1 – не достигнута) |
133 | NR (25,0 – не достигнута) |
HR=0,880 (0,613-1,262) |
p=0,4862 |
| L858R | 93 | 32,5 мес. (25,5-NR) |
92 | 23,2 мес. (19,6-28,6) |
HR=0,707 (0,478-1,045) |
p=0,0805 |
Выводы:
Дакомитиниб следует рассматривать как один из вариантов первой линии терапии пациентов с EGFR-положительным распространенным/метастатическим НМРЛ. Дакомитиниб еще не зарегистрирован в РФ.
МРЛ занимает около 15% всех случаев рака легкого. К сожалению, не существует стандартной одобренной терапии в трех и более линиях. Исторические данные демонстрируют медиану ОВ 4,7 мес. и наилучший общий ответ – 18%. Ровалпитузумаб тесирин – это конъюгат антитела, направленный на дельта-подобный протеин 3 (DLL3) – лиганд, высоко экспрессирующийся на опухолевых клетках при МРЛ, но не в нормальных тканях.
В исследовании 2 фазы TRINITY изучалась эффективность и безопасность ровалпитузумаба тесирина у пациентов с наличием экспрессии DLL3 в ≥3 линии терапии МРЛ. Пациенты должны были получить ранее не менее 2 линий системной терапии, включая не менее одной линии платиносодержащей химиотерапии. В промежуточный анализ было включено 199 пациентов. Наиболее частыми связанными с лечением НЯ были слабость (32%), фотосенсибилизация (31%), плевральныйй выпот (26%), периферические отеки (26%), тромбоцитопения (23%).
| n (%) | DLL3-высокий уровень | DLL3-положительный | ||
|---|---|---|---|---|
| 3 линия N=85 |
≥3 линии N=140 |
3 линия N=103 |
≥3 линии N=165 |
|
| Лучший общий ответ | ||||
| По оценке исследователей | 27 (32) | 39 (28) | 31 (30) | 45 (27) |
| По независимой оценке | 24 (28) | 32 (23) | 27 (26) | 36 (22) |
| ЧОО | ||||
| По оценке исследователей | 20 (24) | 30 (21) | 23 (22) | 35 (21) |
| По независимой оценке | 15 (18) | 20 (14) | 17 (17) | 23 (14) |
| Частота клинического ответа (ПО+ЧО+стабилизация) | ||||
| По оценке исследователей | 59 (69) | 100 (71) | 67 (65) | 111 (67) |
| По независимой оценке | 60 (71) | 105 (75) | 67 (65) | 117 (71) |
Таким образом, среди пациентов с высоким уровнем экспрессии DLL3 в 3 линии терапии медиана ВБП составила 4,1 мес., а медиана ОВ – 6,7 мес.
Значение мутационной нагрузки как биомаркера и эффективность комбинированного применения ниволумаба с ипилимумабом были показаны при МРЛ в исследовании I/II фазы CheckMate 032. Так, ЧОО при монотерапии ниволумабом во второй линии терапии МРЛ составила 11%, а при комбинации его с ипилимумабом – 22%. У пациентов с высокой мутационной нагрузкой, получавших комбинированное лечение, ЧОО составила 46% и однолетняя ОВ – 62%, а при средней и низкой мутационной нагрузке ЧОО достигла 16% и 22%, ОВ – 20% и 23% соответственно. Монотерапия ниволумабом оказалась менее эффективной – однолетняя ОВ составила 35% при высокой мутационной нагрузке, 26% и 22% – при средней и низкой соответственно. Таким образом, в исследовании CheckMate 032 впервые был продемонстрирован потенциал использования мутационной нагрузки для прогнозирования эффективности иммунотерапии при МРЛ.
Первые результаты исследования II фазы DREAM, изучающего эффективность и безопасность дурвалумаба в комбинации с химиотерапией в первой линии при мезотелиоме плевры, были представлены на конгрессе ASCO 2018.
Ранее не получавшие терапию пациенты всех гистологических подтипов мезотелиомы получали дурвалумаб (112 мг), цисплатин (75 мг/м2) и пеметрексед (500 мг/м2) 1 раз в 3 недели в течение максимум 6 циклов и затем монотерапию дурвалумабом в течение 1 года или до прогрессирования заболевания. 54 пациента были включены в данное исследование. Среди 31 пациента, для которого была возможность оценки результата, 6-месячная ВБП составила 71% согласно модифицированным критериям RECIST (mRECIST). ЧОО составила 61% (согласно mRECIST) и 53% (согласно iRECIST). Авторы сделали вывод, что на основании предварительных результатов добавление дурвалумаба к химиотерапии улучшает результаты ВБП и ЧОО у больных мезотелиомой плевры.