13.06.2018


На ежегодном конгрессе ASCO 2018, прошедшем 1-5 июня в Чикаго (США), как обычно, значительная часть научных работ была посвящена различным аспектам диагностики, лечения и молекулярной биологии колоректального рака. В данной публикации мы представили показавшиеся нам наиболее интересными исследования.
Объем лимфодиссекции при раке прямой кишки продолжает оставаться дискутабельным. Расширенная аорто-подвздошно-тазовая лимфаденэктомия, называемая в настоящее время латеральной лимфодиссекцией, была предложена для лечения рака прямой кишки еще несколько десятилетий назад. Поражение лимфоузлов латеральной группы (вдоль общих, внутренних и наружных подвздошных сосудов, обтураторной ямки) может достигать 18% при II-III стадии рака прямой кишки. Однако ее повсеместное применение было ограничено большим числом непосредственных и отдаленных осложнений, включая расстройство мочеиспускания. В 2016 году на ASCO были доложены первые отдаленные результаты рандомизированного исследования III фазы JCOG0212, выполненного в Японии. В исследовании принимали участие пациенты с раком прямой кишки II-III стадии, не получавшие предоперационной химио- или химиолучевой терапии. Дизайн исследования предполагал демонстрацию не меньшей безрецидивной выживаемости (БРВ) после обычной тотальной мезоректумэктомии (TME) по сравнению с TME + латеральная лимфодиссекция. В этом году были доложены отдаленные результаты данного исследования. Расширение объемов лимфодиссекции позволило снизить частоту местных рецидивов с 12,9% до 7,9% (р=0,03), а также погранично достоверно повысить БРВ (7 лет, с 70,7% до 71,1%; р=0,06; ОР 1,09; 95% ДИ 0,84-1,42) [1]. Учитывая, что верхняя граница доверительного интервала ОР превысила запланированную границу в 1,34, нельзя сделать вывод о не меньшей эффективности обычной TME по сравнению с TME + латеральная лимфодиссекция. Поданализ показал, что выигрыш от расширения объема лимфодиссекции наблюдался при клинической III стадии, опухолях, расположенных проксимальнее 5 см от анального канала. Остается неизвестной роль латеральной лимфодиссекции у больных раком прямой кишки после предоперационной химиолучевой терапии.
Также исследователями из Японии было проведено сравнение американского и японского подхода в лечении местно-распространенного рака прямой кишки (≥T3). В анализ было включено 836 больных из США, которым проводилась химиолучевая терапия с последующей TME, и 761 пациентов из Японии, которым выполнялась только TME с латеральной лимфодиссекцией. Пятилетний кумулятивный риск развития локального рецидива составил 4,6% в клинике США и 6,7% в клиниках Японии (ОРadjusted 0,58; 95% ДИ 0,30-1,13). При распределении больных по стадиям не обнаружено различий в БРВ ни при cII ни при (y)pII. Однако при стадии cIII БРВ была значимо выше при реализации подхода сочетания химиолучевой терапии и ТМЕ (ОРadjusted 2,54 [1,79-3,61]), но не при (y)pIII стадии (ОРadjusted 0,86 [0,61-1,21]) [2].
Также в хирургии рака ободочной кишки остается нерешенным вопрос о необходимости удаления апикальных лимфатических узлов в рамках выполнения тотальной мезоколической эксцизии (CME). Разработчики данного метода хирургии провели ретроспективный анализ результатов выполнения данной операции у 843 пациентов раком ободочной кишки. В зависимости от локализации лимфоузлы были разделены на 3 группы: L1 – параколические, L2 – промежуточные и L3 – вдоль основного сосудистого ствола. Из 843 пациентов метастазы в лимфоузлах были выявлены у 446 (52,9%), при этом поражение L3 уровня отмечено только у 25 больных (2,9%, или 5,6% от всех пациентов с N+). И если при однофакторном анализе БРВ была значимо ниже среди пациентов с L3 против L2 (ОР 2,00; 95% ДИ 1,05-3,75; p=0,034) и L1 (ОР 2,62 [1,45-4,71]; p=0,001), то при многофакторном анализе прогностическое значение уровня поражения лимфоузлов теряло свое независимое значение (p=0,42). Авторы пришли к выводу об отсутствии необходимости выполнения такой экстенсивной лимфодиссекции при раке ободочной кишки [3].
В настоящее время стандартным режимом ХЛТ остается монотерапия фторпиримидинами. По данным 4 из 5 рандомизированных исследований добавление оксалиплатина к фторпиримидинам во время лучевой терапии приводило лишь к усилению токсичности, не влияя на показатели БРВ. В этом году китайские ученые доложили обновленные результаты оригинального исследования FOWARC [4]. В нем пациенты c II-III стадиями резектабельного рака прямой кишки были рандомизированы на три группы предоперационного лечения:
После операции все пациенты получали адъювантную терапию режимом FOLFOX. Все группы продемонстрировали хорошую переносимость, свыше 90% пациентов смогли завершить весь запланированный предоперационный этап. Комбинация FOLFOX с лучевой терапией достоверно увеличила частоту полных лечебных патоморфозов (pCR), не оказав никакого влияния на БРВ и ОВ.
| Группа | pCR | Местные рецидивы |
БРВ (3 года) | ОВ (3 года) |
|---|---|---|---|---|
| FOLFOX | 6,9% | 8,7% | 75% | 92% |
| FOLFOX + ЛТ | 29,1% | 8,0% | 77% | 93% |
| DeGramont + ЛТ | 13,1% | 10,3% | 76% | 92% |
Данное исследование, таким образом, лишний раз подтвердило отсутствие целесообразности в добавлении оксалиплатина к фторпиримидинам в режимах ХЛТ. Больший интерес, на наш взгляд, представляет возможность отказа у части пациентов от проведения лучевой терапии, что приведет к уменьшению острых и отсроченных постлучевых осложнений. Данный подход в настоящее время тестируется в большом рандомизированном исследовании PROSPECT, результаты которого, надеемся, подтвердят вышеуказанные находки исследования FOWARC.
Роль адъювантной химиотерапии в лечении рака ободочной кишки хорошо известна. На прошедшем конгрессе подтвердились результаты исследования IDEA по сравнению 3 и 6 месяцев адъювантной терапии режимами FOFOX/XELOX при III стадии рака ободочной кишки независимо от пола, возраста и функционального статуса пациентов. Тем не менее, отмечены следующие наблюдения: не меньшая эффективность 3 месяцев режимом XELOX доказана в группе моложе 70 лет (HR 0,9), 6 месяцев терапии режимом FOLFOX, по-видимому, являются оптимальным подходом у пациентов в возрасте старше 70 лет (p=0,068; 3-wayinteractions), 3 месяца адъювантной химиотерапии являются достаточной опцией в группе благоприятного прогноза у мужчин (HR 0,94), но данный вывод не столь однозначен у женщин (HR 1,09). Тем не менее, как замечают авторы исследования, необходимо дальнейшее изучение выявленных тенденций [5].
Схожую эффективность демонстрирует химиотерапия на основе оксалиплатина и фторпиримидинов и у пациентов c раком прямой кишки, не получавших предоперационной химиолучевой терапии (ХЛТ). В то же время до сих пор оставалось неопределенным место адъювантной химиотерапии в лечении больных раком прямой кишки после неоадъювантной ХЛТ. Адъювантная терапия фторпиримидинами не улучшает показатели выживаемости, а единственное рандомизированное исследование с добавлением оксалиплатина было досрочно закрыто в связи с плохим набором (подробнее см. обзор [6]). При отсутствии достаточной доказательной базы клинические рекомендации предлагают экстраполировать подходы с опухолей ободочной кишки. В этом году были представлены обновленные результаты рандомизированного исследования II фазы из Южной Кореи ADORE. В нем больные раком прямой кишки на первом этапе получали предоперационную ХЛТ на основе фторпиримидинов, далее проводилось хирургическое лечение. 321 пациент с послеоперационной стадией ypT3-4N0M0 или ypTлюбоеN1-2M0 был рандомизирован на 8 курсов по программе FOLFOX или 4 курса режима Мейо. Добавление оксалиплатина привело к повышению 6-летней БРВ с 56,8% до 68,2% (HR 0,563; р=0,02) и снижению вдвое частоты местных рецидивов – с 9,3% до 4,4% [7]. Наибольший эффект отмечался у пациентов с отсутствием выраженного лечебного патоморфоза и поражением лимфоузлов >ypN1a. Таким образом, исследование ADORE явилось первым полноценным исследованием, показавшим, что пациенты c местнораспространенным раком прямой кишки, не достигшие существенного регресса опухоли на предоперационной ХЛТ (ypIII стадия), нуждаются в проведении адъювантной химиотерапии режимом с включением оксалиплатина. В этой связи для полноценного стадирования следует подчеркнуть и необходимость тщательного изучения состояния лимфатических лимфоузлов в патоморфологическом препарате даже после предоперационной химиолучевой терапии. По результатам исследования китайских авторов только изучение не менее 12 лимфоузлов оказалось независимым позитивным прогностическим фактором в данной популяции пациентов [8].
Продолжают изучаться и биомаркеры прогрессирования болезни после радикального лечения ранних стадий как рака прямой кишки, так и рака ободочной кишки. К настоящему времени мы знаем о роли циркулирующей опухолевой ДНК при раке толстой кишки II стадии, определение которой в крови пациентов после оперативного лечения определяло увеличение риска прогрессирования болезни более чем в 18 раз. Эта же группа авторов представила работу по изучению прогностической роли цДНК при III стадии рака толстой кишки. Среди 98 пациентов, включенных в исследование, которым проводилась адъювантная химиотерапия, у 20% развилось прогрессирование заболевания при медиане наблюдения 21,1 месяца. Также у 20% больных после хирургического лечения цДНК продолжала определяться в крови, выживаемость таких пациентов была значимо хуже (ОР 3,52; p=0,004). В случае если после завершения адъювантной химиотерапии в крови пациентов определялась цДНК, риск прогрессирования болезни был в 7 раз выше в сравнении с пациентами с отрицательной цДНК (ОР 7,14; p<0,001) [9].
В другом исследовании также подтверждена прогностическая роль цДНК при резектабельных стадиях рака толстой кишки, однако не для опухолей с микросателлитной нестабильностью. В этой группе пациентов в 5 из 8 (62,5%) наблюдений определялась цДНК после операции, и только у 1 пациента было зарегистрировано прогрессирование болезни [10].
На ASCO 2018 были представлены результаты исследования роли цДНК у больных раком прямой кишки, которым проводилась предоперационная химиолучевая терапия. Оказалось, что уровень цДНК перед началом ХЛТ не помогает предсказать ответ, однако определение цДНК в плазме крови после завершения химиолучевой терапии значимо предсказывало высокий риск прогрессирования болезни [11].
Метастатическое поражение брюшины при колоректальном раке является крайне неблагоприятным прогностическим признаком. Обычно такие больные являются кандидатами для паллиативной химиотерапии. Более агрессивным подходом является выполнение циторедуктивных вмешательств с добавлением гипертермической интраперитонеальной химиотерапии (HIPEC). Небольшие исследования сообщали о преимуществе HIPEC с перитонэктомией по сравнению с историческим контролем (системная химиотерапия). Эти данные были ранее подтверждены в единственном небольшом рандомизированном исследовании, где в качестве группы контроля применялся малоэффективный режим Мейо [12]. В этом году были представлены результаты рандомизированного исследования PRODIGE 7. 265 пациентов с изолированными метастазами по брюшине, индексом PCI<25 после выполнения циторедуктивного вмешательства c максимальным размером резидуальной опухоли менее 1 мм были рандомизированы в группу интраоперационной HIPEC (оксалиплатин 360-460 мг/м2 в/брюшинно, лейковорин и фторурацил внутривенно) с последующей системной химиотерапией на протяжении не менее полугода либо в группу одной системной химиотерапии [13]. Добавление HIPEC сопровождалось большей частотой осложнений, но не привело к улучшению ни БРВ, ни общей выживаемости. Таким образом, данное исследование показало важность выполнения оптимальной циторедукции с последующей системной химиотерапией, что позволило достичь высоких отдаленных результатов: 5-летняя БРВ – 13-14%, 5-летняя ОВ – 37-39%.
ПЭТ-КТ все больше входит в нашу жизнь, расширяя возможности стадирования, определяет ранний метаболический ответ опухоли на фоне терапии или наличие жизнеспособной резидуальной опухоли после ранее проведенного лечения. При колоректальном раке, в отличие от многих других опухолей, ПЭТ-КТ не показала своего значения ни по одному из вышеуказанных показаний. Наиболее очевидным, казалось бы, ее местом при КРР являются пациенты с изолированными метастазами в печень – кандидаты для локальных методов лечения, когда обнаружение внепеченочных метастазов значимо меняет тактику лечения. На ASCO 2018 был представлен мета-анализ исследований, посвященных роли ПЭТ-КТ перед планируемой резекцией печени. Оказалось, что по данным рандомизированных исследований лечебный подход изменился лишь в 8% случаев, что не отразилось ни на частоте эксплоративных лапаротомий, ни на БРВ, ни на общей выживаемости [14].
Анти-EGFR антитела (цетуксимаб, панитумумаб) прочно вошли в лечение метастатического КРР, увеличивая продолжительность жизни пациентов в первой-третьей линиях терапии. Тем не менее, ряд аспектов до последнего времени оставался неизвестным. В частности, как долго лечить анти-EGFR антителами? Если применять их в качестве поддерживающей терапии, то в монотерапии или в комбинации с химиотерапией? Ранее в небольшом рандомизированном исследовании COIN-B было показано, что полные перерывы в лечении после 3 месяцев терапии приводят к некоторому ухудшению показателей выживаемости до прогрессирования (ВДП) и общей выживаемости [15]. В другом небольшом исследовании MACRO-2 пациенты после 16 недель терапии FOLFOX+цетуксимаб продолжали данную комбинацию или монотерапию [16]. Была отмечена некоторая тенденция к ухудшению ВДП в последней группе, однако интерпретация результатов затруднительна из-за недостаточного числа больных. На ASCO 2018 было доложено многоцентровое исследование VALENTINO из Италии, в котором 229 пациентов после 8 курсов FOLFOX+панитумумаб рандомизировались в группу монотерапии панитумумабом либо в комбинированную группу (режим DeGramont + панитумумаб каждые 2 недели). Исследование имело non-inferiority дизайн, целью которого была демонстрация не большей частоты прогрессирования болезни к 10-му месяцу лечения в группе монотерапии. Оказалось, что добавление в качестве поддерживающей терапии к панитумумабу инфузий фторурацила привело к достоверному увеличению ВДП с 10,2 до 13,0 мес. (ОР 1,55; р=0,011). Выигрыш отмечался во всех подгруппах пациентов. Данные по общей выживаемости еще не доступны из-за малого срока наблюдения за больными.
Таким образом, сегодня мы получили убедительные данные, свидетельствующие о возможности ранней деэскалации индукционного режима (отмена оксалиплатина после 8 недель) и продолжении поддерживающей анти-EGFR терапии в комбинации с химиотерапией в виде режима DeGramont (но не болюсных режимов фторурацила или капецитабина!).
Одним из механизмов резистентности к анти-EGFR антителам является гиперэкспрессия HER-2/neu на опухолевых клетках, изучение данного маркера становится все более актуальным в связи с позитивными результатами применения комбинаций трастузумаба с лапатинибом или трастузумаба с пертузумабом в данной группе пациентов с колоректальным раком. Однако частота встречаемости гиперэкспрессии данного рецептора в популяции больных метастатическим колоректальным раком невелика и составляет порядка 4-5%. Тем более актуальным видится выявление клинических факторов, ассоциированных с данным молекулярным нарушением. При анализе 40 образцов первичной опухоли пациентов с метастазами колоректального рака в головном мозге амплификацию данного гена удалось выявить у 20% больных [17].
Еще со школьной скамьи мы помним постулат, что от перестановки мест слагаемых сумма не изменяется. Верность этого принципа мы видели и при проведении паллиативной химиотерапии: для достижения наибольшей продолжительности жизни неважна последовательность режимов, главное, чтобы пациент их все получил. Однако в последнее время стало появляться все больше данных, говорящих о том, что последовательность таргетной терапии в лечении колоректального рака имеет значение. Так, применение анти-EGFR антител во второй линии сразу после прогрессирования на бевацизумабе малоэффективно и не лучше опции продолжения бевацизумаба и во второй линии терапии [18-19]. При этом если использование анти-EGFR антитела перенести со второй линии терапии на третью (назначив, например, во второй линии одну химиотерапию), то это приводит к повышению показателей ВДП [20]. В этом году было представлено рандомизированное исследовании II фазы REVERCE из Японии, в котором пациентам, ранее получившим оксалиплатин, иринотекан и фторпирмидины, назначался один из вариантов лечения: регорафениб с переходом на цетуксимаб (+иринотекан) при прогрессировании (группа Р-Ц) либо их обратная последовательность (группа Ц-Р). ВДП на первом этапе в обеих группах не различались, однако после перехода при прогрессировании на другой препарат оказалось, что преимущество имеет цетуксимаб (группа Р-Ц). Это привело к достоверному увеличению общей выживаемости (рис. 1). Небольшое число пациентов не позволяет сделать однозначных выводов, однако напрашивается гипотеза о том, что регорафениб способен восстанавливать чувствительность опухоли к лекарственной терапии.
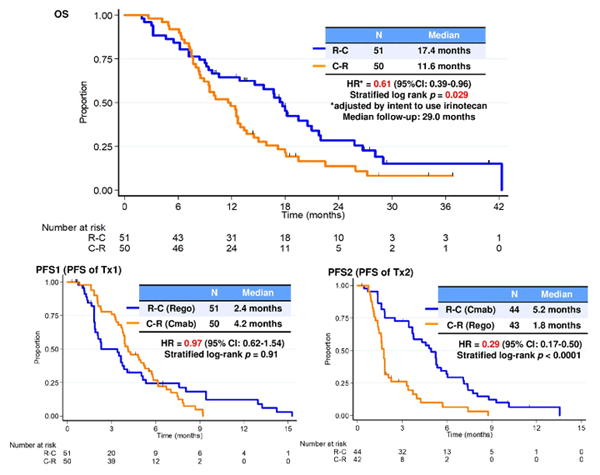
Рисунок 1. Показатели ВДП и общей выживаемости в исследовании REVERCE.
В заключении хочется отметить, что с каждым годом, с одной стороны, все чётче вырисовывается алгоритм выбора терапии как при ранних стадиях, так и при метастатическом раке толстой кишки, что улучшает выживаемость наших пациентов и облегчает работу онколога. Однако, с другой стороны, выделение небольших подтипов опухоли, внедрение новых методов диагностики, биомаркеров и препаратов требует от онколога необходимости постоянных усилий, чтобы продолжать оставаться на острие знаний науки.
Литература: