14.05.2018

Вряд ли кто-то сегодня поспорит с тем, что ингибиторы контрольных точек иммунитета (check-point inhibitors) совершили революцию в онкологии. Основными отличиями этой группы препаратов от «предшествующей революции» – таргетной терапии – является то, что при использовании ингибиторов контрольных точек иммунитета (ИКТИ):
Последнее отличие и является ключевым прорывом, которого мы не видели со времен первых (и, увы, последних) успехов химиотерапии при диссеминированных опухолях (герминогенные опухоли, лейкозы, лимфомы), когда ограниченное по времени лечение приводило к неограниченному по продолжительности эффекту (излечению).
Однако для всех очевидной является и обратная сторона, казалось бы, «универсальности» действия ИКТИ (опухоль-неспецифичный эффект) – в пределах «одной болезни» (меланомы, рака легкого, почки, мочевого пузыря и т.д.) ответа добиться удается не у всех. Далеко не у всех… Именно малая частота эффектов, особенно длительных, на первых порах «смазывала» радость от достигнутых результатов при использовании ипилимумаба при меланоме. Безусловно, длительные эффекты (скорее всего даже излечение) достигались у некоторых больных с ранее абсолютно фатальной опухолью, однако ситуацию, когда на очень дорогую и весьма токсичную терапию отвечает лишь 15-20% пациентов, а остальные получают ее без эффекта, трудно считать однозначным успехом.
Препараты из следующего поколения ИКТИ (анти-PD-1 и PD-L1 антитела) оказались более эффективны и менее токсичны, чем ипилимумаб (анти-CTLA4), однако и при их применении более чем у половины больных ответ на лечение отсутствовал. Более того, очевидным стало и то, что подобная ситуация – с одной стороны возможность достижения сверхдолгих ответов при большинстве опухолей, с другой – редкость этих ответов, характерна для всего класса препаратов. Подобная ситуация привела к началу активного поиска факторов предсказания эффекта ИКТИ, позволяющих проводить лечение только больным с высоким шансом его достижения.
Увы, находка оказалась далеко не идеальной – высокая экспрессия PD-L1 позволила выявить больных с высоким шансом на ответ, но… Даже при высокой планке отсечения в 50% экспрессирующих клеток на лечение отвечали далеко не все, и даже при низкой <1% экспрессирующих клеток «за бортом» оставались некоторые пациенты, которые выигрывали от лечения. Это значимо отличается от уже привычных нам предиктивных маркеров, при «негативном» уровне которых эффект от лечения либо крайне маловероятен, либо вообще невозможен, а при их «позитивном» уровне достигается у большинства больных (HER2, РЭ, мутация ALK, EGFR, c-kit и т.д.). Таким образом, экспрессия PD-L в качестве маркера эффективности ингибиторов контрольных точек носит в большей степени «экономический» (снижение нагрузки на бюджет, пусть даже ценой отказа в лечении больным с меньшим, но не нулевым шансом на эффект), чем медицинский характер. Пожалуй, лишь наличие микросателлитной нестабильности можно назвать удачным «позитивным» предсказательным фактором – частота достижения эффекта у больных с MSHI очень велика, и подобные больные однозначно нуждаются в терапии ИКТИ. Беда в том, что частота встречаемости микросателлитной нестабильности невелика, а ее отсутствие не свидетельствует об отсутствии шанса на успех от применения ингибиторов контрольных точек (как маркер негативной селекции больных на терапию ИКТИ микросателлитная нестабильность использоваться не может).
Таким образом, несмотря на вынужденное внедрение использования уровня экспрессии PD-L1 для селекции больных на проведение лечения ИКТИ, достигнуть «таргетизации», а значит и выраженного нарастания частоты ответов на препараты из этой группы, не удалось.
Однако параллельно ведется и поиск способов повысить эффективность препаратов из этой группы – т.е. попытки добиться эффектов у тех, у кого их пока не наблюдается, преодолеть первичную и вторичную резистентность к ИКТИ. Новых прорывов в отношении усовершенствования препаратов из класса ИКТИ пока на горизонте не видно: все, что выходит на рынок или находится в разработке из PD-1 и PD-L1 ингибиторов, представляется классическими препаратами me-too (я тоже), т.е. хоть и оригинальными (не воспроизведенными), но препаратами того же класса, практически не отличающимися от предшественников в отношении эффективности и токсичности. Подобная ситуация уже была пройдена неоднократно – разные ингибиторы ароматазы, антиангиогенные препараты при раке почки, ингибиторы циклин-зависимой киназы практически неотличимы друг от друга и требуют огромных усилий маркетологов, чтобы хоть как-то «развести» их между собой и найти отличия там, где их практически нет. Скорее всего, основной задачей регуляторов рынка, регистрирующих до поры до времени все новые препараты в пределах класса (без сравнения между собой), является насыщение рынка, стимуляция конкуренции с целью снижения цены.
В связи с этим в настоящее время исследователи и фармацевтические компании, уже имеющие в своем арсенале ИКТИ, в основном сосредоточились на поиске препаратов-партнеров, которые при совместном использовании способны увеличить их эффективность. И этих компаньонов для ИКТИ абсолютно логично в основном ищут среди препаратов с иммунным механизмом действия. Как уже известных, так и новых. Ведь если упрощенно взглянуть на механизм действия препаратов из группы ИКТИ, то они не «запускают» иммунную реакцию «с нуля». Они лишь «растормаживают» уже начавшуюся, но «споткнувшуюся» о контрольную точку реакцию. Без более ранних этапов иммунного ответа – распознавания опухолевого антигена, активации (хотя и незаконченной) иммунных клеток – ИКТИ сработать не смогут, им просто нечего будет «растормаживать». Ровно так же «расторможенная» при помощи ИКТИ иммунная реакция может «заглохнуть», если не будет подпитываться другими компонентами иммунной системы, и первоначально достигнутый эффект будет утерян. Именно поэтому сейчас идет масса клинических (и предклинических) испытаний разных фаз по добавлению к ИТКИ вакцин, лизатов, цитокинов, костимуляторных молекул, различных вариантов клеточной терапии и т.д. Происходит ренессанс иммунных препаратов, которые ранее были признаны неэффективными, в надежде на то, что в комбинации с ИКТИ они смогут увеличить ее эффективность за счет воздействия на дополнительные звенья иммунитета. Однако настораживает то, что пока (несмотря на уже длительное время, прошедшее с начала исследований комбинаторного подхода) обнадеживающих данных, позволяющих надеяться на вторую революцию, не видно. Кроме того, увы, большинство из новых потенциальных партнеров, скорее всего, приведут к еще большему удорожанию и без того недешевой терапии.
На этом фоне сообщения о том, что дешевые и относительно безопасные препараты – неселективные бета-блокаторы – могут значимо потенцировать эффект ИКТИ, выглядят более чем обнадеживающе. Как показали исследователи из Roswell Park [1], больные метастатической меланомой, получающие терапию с использованием ИКТИ, могут значимо выигрывать в случае параллельного приема неселективных бета-блокаторов.
Теоретические предпосылки о возможном негативном влиянии адренергической системы на иммунитет существуют достаточно давно и подкрепляются ранними исследованиями в области физиологии иммунной системы в условиях стресса, свидетельствующими о том, что возбуждение адренергических рецепторов может приводить к увеличению числа клеток, отвечающих за иммуносупрессию. Кроме того, адренергические сигналы приводят к снижению экспрессии Т-клетками активирующих цитокинов, снижению Т-клеточной цитотоксичности.
Основываясь на этих данных, исследователи проанализировали результаты лечения 195 больных меланомой, получавших иммунотерапию с использованием интерлейкина-2, анти-CTLA4 и/или анти-PD-1 ингибиторов в интервале между 2000 и 2015 годами. Среди них 62 больных одновременно получали селективные и неселективные бета-блокаторы по различным показаниям, не связанным с основным заболеванием. Магнитуда эффекта оказалась обескураживающе большой: 5-летняя выживаемость больных, получавших неселективные бета-блокаторы, составила 67% против 25% для больных, не получавших бета-блокаторы или использовавших селективные бета-1-блокаторы (рисунок 1).
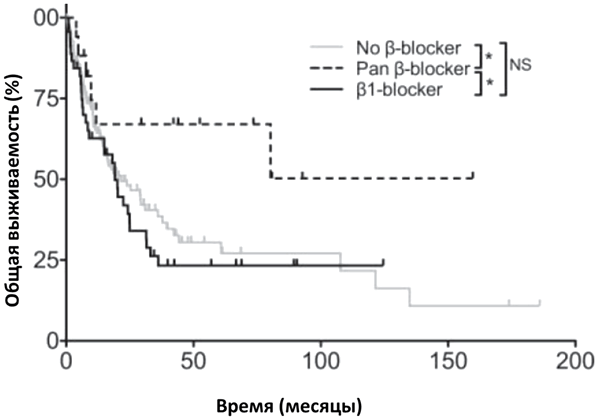
В параллельном исследовании in vivo на мышиных моделях авторам удалось воспроизвести это наблюдение: добавление неселективных бета-блокаторов к иммунотерапии приводило к замедлению прогрессии опухоли и увеличению выживаемости лабораторных животных, чего не наблюдалось при использовании селективных блокаторов. Несмотря на то, что авторы пока не представили данных о точных механизмах, за счет которых удается добиться потенциации эффекта иммунотерапии, а исследование носит ретроспективный характер и отмечалась определенная диспропорция в отношении использованных вариантов иммунотерапии между группами (таблица 1), результаты его представляются весьма обнадеживающими и заслуживающими дальнейшего изучения. Кроме того, это, пожалуй, можно назвать первым исследованием, хоть и косвенно, но подтверждающим связь стресса и рака…
| Вариант иммунотерапии | Без β-блокаторов | Селективные β1-блокаторы |
Неселективные β-блокаторы |
|---|---|---|---|
| Только анти-PD-1 | 8 (6,0%) | 0 (0%) | 1 (5,9%) |
| Только анти-CTLA-4 | 39 (29,3%) | 17 (37,8%) | 4 (23,5%) |
| Только IL-2 | 44 (33,1%) | 12 (26,7%) | 4 (23,5%) |
| Анти-PD-1 + анти-CTLA-4 | 26 (19,5%) | 3 (6,7%) | 4 (23,5%) |
| Анти-PD-1 + IL-2 | 1 (0,007%) | 1 (2,2%) | 0 (0%) |
| IL-2 + анти-CTLA-4 | 11 (8,3%) | 7 (15,6%) | 1 (5,9%) |
| Анти-PD-1 + IL-2 + анти-CTLA-4 | 4 (3,0%) | 5 (11,1%) | 3 (17,6%) |
В целом, пока можно заключить, что ожидаемые шаги в области «улучшения» эффективности ИКТИ – поиск факторов предсказания, использование иммунных комбинаций – пока не принесли ожидаемого успеха. Однако, с учетом того, как мало мы знаем на самом деле о противоопухолевом иммунитете в целом и механизме действия ИКТИ в частности, нас, возможно, ожидают и приятные неожиданные сюрпризы в дальнейшем.
Источник: Kokolus KM, et al. Beta blocker use correlates with better overall survival in metastatic melanoma patients and improves the efficacy of immunotherapies in mice. OncoImmunology. 2018. https://doi.org/10.1080/2162402X.2017.1405205.