22.01.2018
ФАКТОРЫ РИСКА РАЗВИТИЯ МЕТАСТАТИЧЕСКОГО ПОРАЖЕНИЯ ГОЛОВНОГО МОЗГА
В США рак молочной железы (РМЖ) является вторым по частоте онкологическим заболеванием после рака легкого, осложняющимся развитием метастатического поражения головного мозга [1]. В последние годы отмечается рост числа пациентов с метастазами в головной мозг, что в том числе связано с увеличением продолжительности жизни больных распространенным РМЖ. В зависимости от молекулярно-генетического варианта риск их возникновения у больных I/II стадиями инвазивного РМЖ следующий: люминальный А – 0,1%, люминальный В – 3,3%, люминальный HER2 – 3,2%, HER2 – 3,7% и тройной негативный – 7,4% [2]. Несмотря на то, что эти показатели невелики, у 30-50% больных, имеющих распространенный процесс, с течением времени возникают метастазы в головной мозг [2-5]. Среди факторов риска их развития выделяют молодой возраст, поражение лимфатических узлов, высокую степень злокачественности опухоли, отрицательный гормональный статус, наличие экспрессии HER2, а также время от выявления заболевания до появления первых метастазов [6]. Помимо этого на время развития метастатического поражения головного мозга после постановки диагноза первичного РМЖ напрямую влияет молекулярно-генетический подтип опухоли. Наиболее коротким данный интервал является у больных с тройным негативным фенотипом (27 мес.), тогда как у больных гормонозависимым HER2-положительным РМЖ он самый длинный (54 мес.) [7].
ПРОГНОСТИЧЕСКИЕ И ПРЕДИКТИВНЫЕ ФАКТОРЫ ВЫЖИВАЕМОСТИ
В настоящее время прогностические и предиктивные факторы у больных с метастатическим поражением головного мозга являются специфичными для заболевания (таблица 1). Одной из шкал, которая может быть использована для их оценки, является «специфичная для заболевания шкала прогностической оценки» – Disease-Specific Graded Prognostic Assessment (DS-GPA) [8]. Прогностические факторы, специфичные для РМЖ, представлены в таблице 2. В связи с тем, что время от постановки первичного диагноза до развития метастатического поражения головного мозга не являлось независимым значимым фактором прогноза по данной шкале, оно в ней не представлено [7].
Таблица 1. Медиана выживаемости, шкала DS-GPA (месяцы) [8].
| Медиана выживаемости (месяцы) |
GPA 1 (0-1) |
GPA 2 (1,5-2,0) |
GPA 3 (2,5-3,0) |
GPA 4 (3,5-4,0) |
|
|---|---|---|---|---|---|
| Немелкоклеточный рак легкого | 7 | 3,02 | 5,49 | 9,43 | 14,78 |
| Мелкоклеточный рак легкого | 4,9 | 2,79 | 4,90 | 7,67 | 17,05 |
| Меланома | 6,74 | 3,38 | 4,70 | 8,77 | 13,23 |
| Рак почки | 9,63 | 3,27 | 7,29 | 11,27 | 14,77 |
| Рак молочной железы | 13,8 | 3,35 | 7,70 | 15,07 | 25,3 |
Таблица 2. Прогностические факторы, специфичные для РМЖ [8].
| Прогностический фактор | 0 | 0.5 | 1.0 | 1.5 | 2.0 |
|---|---|---|---|---|---|
| Статус по шкале Карновского | ≤50 | 60 | 70-80 | 90-100 | Нет данных |
| Молекулярный подтип | Базальный | Нет данных | Люминальный A | HER2 | Люминальный B |
| Возраст, годы | ≥60 | <60 | Нет данных | Нет данных | Нет данных |
Шкала DS-GPA была разработана в процессе наблюдения за больными с метастатическим поражением головного мозга, которым были выполнены лучевая терапия (в том числе на весь объем головного мозга), стереотаксическая радиохирургия, оперативное вмешательство или сочетание всех перечисленных методов лечения. Лишь у 6% пациенток прогностический индекс по этой шкале составляет 1, тогда как у большинства больных он равномерно распределен между 2, 3 и 4. Ее нельзя использовать для оценки исхода в зависимости от проводимого лечения. Шкалу применяют в качестве стратификационной модели при проведении клинических исследований, а также при сравнении результатов клинических исследований между собой. Помимо этого она позволяет онкологу принять решение о необходимости получения пациентом помощи в хосписе.
Проблема метастатического поражения головного мозга требует дальнейшего изучения. В первую очередь это связано с высокой частотой возникновения метастазов и относительно коротким интервалом до их развития у больных с тройным негативным фенотипом, а также высокой частотой их встречаемости у больных HER2-положительным РМЖ.
ЛОКАЛЬНАЯ ТЕРАПИЯ
Роль хирургического метода лечения у больных с метастатическим поражением головного мозга
Оперативное лечение, как один из возможных вариантов местной терапии, занимает значимое место в отдельных подгруппах больных. В трех клинических исследованиях III фазы было выполнено сравнение между хирургическим вмешательством с последующим проведением лучевой терапии на весь объем головного мозга и назначением только лучевой терапии (рисунок 1) [9-11].

Рисунок 1. Алгоритм терапии больных РМЖ с метастатическим поражением головного мозга.
В первых двух исследованиях была доказана более высокая выживаемость больных, получающих комбинированную терапию (медиана выживаемости составила 10 мес. vs 4-6 мес.) В исследовании, проведенном Patchell и соавторами, у тех участников, кому было выполнено хирургическое вмешательство, была ниже частота местного рецидива (20% и 52% соответственно). Третье исследование, в котором приняли участие больные с более агрессивным заболеванием (80% и 30-40% соответственно) и низким общесоматическим статусом, не выявило никакого преимущества в комбинации хирургического метода лечения с облучением всего объема головного мозга. Таким образом, эффективность хирургического вмешательства, выполненного в дополнении к облучению всего объема головного мозга, ограничено больными, чье заболевание хорошо контролируется и кто имеет высокий общесоматический статус [12]. Результаты хирургического вмешательства у тщательно отобранных больных с 2-3 метастазами в головном мозге, находящихся в хорошем неврологическом статусе и имеющих контролируемое заболевание, были сопоставимы с результатами, полученными у больных с одиночными метастазами [13]. Единственным недостатком данных исследований, а также доступной литературы по местной терапии является то, что в них проанализированы больные с разными первичными нозологиями, тогда как число больных РМЖ является относительно небольшим (10-20%). Таким образом, большая часть рекомендаций сделана на пациентах, преимущественно имеющих немелкоклеточный рак легкого.
Для большинства больных хирургическое вмешательство позволяет мгновенно уменьшить симптомы, обусловленные внутричерепной гипертензией, а также снизить проявления неврологического дефицита и судорог, уменьшить прием стероидов. На сегодняшний день выполнение полной резекции метастазов возможно с использованием современных технологий, таких как предоперационная функциональная МРТ, внутриоперационная нейронавигация и другие [14]. Раннее выполнение МРТ после операции позволяет обнаружить остаточную опухоль у 20% больных. К сожалению, ее наличие является причиной высокого риска местного рецидива [15].
Не так давно был опубликован анализ, в котором у больных, имеющих единичные очаги в головном мозге, сравнивались различные методы хирургического подхода. Оценивались риск развития осложнений и функциональный исход операции, а также частота возникновения местного рецидива. Авторы исследования пришли к выводу о том, что при наличии опухолей больших размеров риск развития послеоперационных осложнений не возрастает в случае удаления всего объема опухоли одномоментно. Сравнение было выполнено с удалением опухоли фрагментарно [16]. Одним из возможных осложнений хирургического лечения является лептоменингеальная диссеминация опухоли (канцероматоз мозговых оболочек). В частности, у больных с наличием метастазов в задней черепной ямке, перенесших фрагментарное удаление опухоли, частота ее развития составляет 13,8%, тогда как после одномоментного удаления всего объема опухоли она развивается у 5-6% пациентов [17].
Наконец, хирургический метод лечения позволяет получить материал для последующего проведения молекулярного анализа, что является важным для подбора таргетной терапии.
Сравнение облучения всего объема головного мозга со стереотаксической радиохирургией, выполненной после оперативного вмешательства
В рандомизированном исследовании, проведенном Patchell и соавторами [18], было показано, что у больных с единичными очагами метастатического поражения в головном мозге, перенесших хирургическую резекцию с последующим облучением всего объема головного мозга, реже возникает рецидив заболевания в ЦНС. Более того, у них реже летальный исход обусловлен неврологическими причинами. Сравнение было выполнено с пациентами, перенесшими только хирургическое лечение. Несмотря на данное исследование, роль облучения всего объема головного мозга остается крайне противоречивой. Последнее послужило поводом инициации исследования N107C/CEC.3, в котором больным после резекции метастазов в головном мозге была проведена лучевая терапия на область всего головного мозга или выполнена стереотаксическая радиохирургия. В обеих группах участникам с нерезецированными метастазами возможно было проведение стереотаксической радиохирургии. Стратификация больных была выполнена с учетом наличия первичного рака легкого, радиорезистентных опухолей или новообразований других гистологий. Результаты данного исследования были представлены на пленарной сессии конгресса Американского общества лучевых онкологов в 2016 г. [19]. Около 30% больных, принявших участие в исследовании, вошли в группу новообразований других гистологий. В соответствии с полученными результатами разницы в общей выживаемости (ОВ) между двумя сравниваемыми группами выявлено не было (11-12 мес.) При проведении подгруппового анализа в зависимости от возраста, наличия экстракраниальных очагов, числа очагов в головном мозге, гистологии или размера резекционной полости разницы также не было. Тем не менее, было выявлено небольшое, но статистически значимое различие во времени до ухудшения когнитивных способностей (2,8 мес. при облучении всего объема головного мозга и 3,3 мес. при проведении стереотаксической радиохирургии; p<0,0001). Лишь у 5,4% больных в первой группе не было ухудшения когнитивных функций через 6 мес. Аналогичный показатель в группе стереотаксической радиохирургии составил 22,9%.
Стереотаксическая радиохирургия ± облучение всего объема головного мозга
В больших рандомизированных исследованиях, проведенных за последнее время, была выполнена оценка роли стереотаксической радиохирургии с последующим облучением всего объема головного мозга или без него [20-23]. Одним из них было рандомизированное исследование JROSG 99-1, которое было опубликовано в 2006 г. Aoyama и соавторами. В нем приняли участие 132 больных, имеющих не более 4 очагов метастатического поражения в головном мозге. Всем участникам была выполнена стереотаксическая радиохирургия. Основным критерием эффективности была ОВ. Помимо этого оценивали частоту местного рецидива, варианты последующей терапии, функциональную сохранность, токсичность и причину смерти. Исследование было завершено ранее запланированного срока, когда при получении результатов промежуточного анализа было выявлено, что для достижения первичной конечной точки необходимо выявление значительной разницы у 800 больных. Лишь у 7% участников исследования был РМЖ, тогда как у большинства пациентов был немелкоклеточный рак легкого. В группе больных, кому была проведена только стереотаксическая радиохирургия, разница в медиане выживаемости и показателе однолетней выживаемости не была значимой. Тем не менее, в группе, получившей стереотаксическую радиохирургию и облучение всего объема головного мозга, реже возникал интракраниальный рецидив (47% vs. 77% в течение года; p<0,001). Помимо этого, в отличие от больных, получивших только стереотаксическую хирургию, в этой группе реже проводилась дополнительная терапия.
В другом крупном исследовании, в котором приняли участие 359 больных (12% из них имели РМЖ), участники, имевшие до 4 очагов метастатического поражения в головном мозге, получали локальную терапию (хирургическое лечение или стереотаксическая радиохирургия) ± облучение всего объема головного мозга [23]. Несмотря на то, что выживаемость была сопоставима между сравниваемыми группами (p=0,89), контроль над заболеванием был выше в группе облучения всего объема головного мозга (хирургия vs хирургия + облучение всего объема головного мозга: 59% и 27%, p<0,001; стереотаксическая радиохирургия vs. стереотаксическая радиохирургия + облучение всего объема головного мозга: 31% vs. 19%, p=0,04). Необходимость в дополнительной терапии была также ниже в группе облучения всего объема головного мозга (51% vs 16%, p – неизвестно).
По данным метаанализа, опубликованного Sahgal и соавторами в 2015 г. [24], было выявлено, что значительный выигрыш в выживаемости получают больные ≤50 лет при выполнении им только стереотаксической радиохирургии. Сделанный вывод относился как к больным раком легкого, так и к больным РМЖ. Несмотря на то, что число больных в сравниваемых группах было небольшим, авторы делают вывод о том, что проведение только стереотаксической радиохирургии может быть рекомендовано в качестве первичной терапии больным ≤50 лет, имеющим не более 4 метастазов в головном мозге [22, 25].
Качество жизни и нарушение когнитивных функций после облучения всего объема головного мозга
Снижение когнитивных способностей является одним из серьезных осложнений, возникающих после облучения всего объема головного мозга. В литературе были описаны случаи развития деменции с атаксией и недержанием мочи, которые возникали у 30% больных в течение года после облучения всего объема головного мозга крупными фракциями (6-8,5 Гр; на сегодняшний день такой подход больше не используется) [26]. На КТ/МРТ снимках была картина лейкоэнцефалопатии и гидроцефалии. При применении менее крупных фракций (разовая доза до 3-4 Гр) сохраняется риск развития когнитивных нарушений легкой степени, заключающихся преимущественно в способности к восприятию и запоминанию.
В последние годы было проведено несколько рандомизированных исследований, в которых было изучено влияние облучения всего объема головного мозга на нейрокогнитивные функции и качество жизни пациентов. В исследовании, проведенном Aoyama и соавторами, нейрокогнитивные расстройства сравнивались у больных, которым была выполнена только стереотаксическая радиохирургия или в дополнении к ней проведено облучение всего объема головного мозга [27]. По данным обследования, выполненного в течение 2-3 месяцев после завершения терапии, улучшение когнитивных функций на 3 и более пункта было выявлено у равного числа больных в каждой группе (p=0,85). Несмотря на это при последующем наблюдении вплоть до 36 месяцев было выявлено ухудшение нейрокогнитивных функций. В небольшом рандомизированном исследовании, разработанном Chang и соавторами, было показано, что у больных, которым была проведена стереотаксическая хирургия и облучение всего объема головного мозга, к 4-му месяцу был выше риск снижения способности к восприятию информации и запоминанию. Сравнение было проведено с больными, получившими только стереотаксическую радиохирургию [21]. В рандомизированном исследовании III фазы (Alliance) было выполнено сравнение между стереотаксической радиохирургией и ее сочетанием с облучением всего головного мозга. Исследование было проведено у больных, у которых число очагов в головном мозге не превышало 3. Основным критерием эффективности было изменение нейрокогнитивных функций через 3 месяца от начала терапии [28]. В соответствии с полученными результатами нейрокогнитивные расстройства значительно чаще встречались в группе больных, получавших стереотаксическую хирургию в сочетании с облучением всего объема головного мозга (91,7% и 63,5% соответственно, p<0,001). Из них наибольшие различия были выявлены в кратковременной памяти (30,4% vs. 8,2%, p=0,004), долговременной памяти (51,1% vs. 19,7%, p<0,001) и темпе вербального общения (18,6% vs. 1,9%, p=0,01). В исследовании EORTC 22952-26001 показано, что спустя год наблюдения не было выявлено значительной разницы в качестве жизни больных, получивших облучение всего объема головного мозга в адъювантном режиме или находящихся на динамическом наблюдении. Тем не менее, в первой группе был ниже уровень физического функционирования, и участники чаще предъявляли жалобы на усталость [22].
У больных с артериальной гипертензией, сахарным диабетом или другой сосудистой патологией риск развития когнитивных нарушений выше. Патогенез лучевого поражения заключается в повреждении эндотелия мелких сосудов, которое впоследствии приводит к атеросклерозу и хронической ишемии. Возникающая при этом картина схожа с поражением мелких сосудов при сосудистой деменции. Актуально при этом проведение исследований препаратов, используемых при сосудистой деменции, которые позволяют предотвратить или уменьшить проявления когнитивных расстройств, вызванных лучевой терапией. Одним из возможных подходов является применение мемантина в сочетании с облучением всего объема головного мозга. Мемантин представляет собой селективный блокатор N-метил-D-аспартат (NMDA) глутаматных рецепторов. Его механизм действия связан с модулированием глутаматергической передачи, которая опосредует кортико-кортикальные и кортико-субкортикальные взаимосвязи в головном мозге. В серии контролируемых исследований была доказана способность мемантина улучшать и стабилизировать когнитивные функции. В частности, в рандомизированном двойном слепом плацебо-контролируемом исследовании II фазы (RTOG 0614) применение мемантина во время и после облучения головного мозга в полном объеме способствовало с течением времени незначительному улучшению когнитивных функций [29]. Использование другого препарата – донепезила – также способствовало незначительному улучшению когнитивных функций, особенно у пациентов, имевших значимые нарушения их до начала лечения [30].
Возникновение когнитивных расстройств после лучевой терапии может быть также обусловлено поражением клеток в субгранулярной зоне гиппокампа [31]. Эти клетки отвечают за поддержание нейрогенеза, что имеет большое значение для сохранения в первую очередь эпизодической памяти. Проведение лучевой терапии в низкой дозе грызунам вызывало блокаду нейрогенеза и нарушение микроокружения нейронов, что приводило к значительному краткосрочному расстройству памяти. В связи с этим было высказано предположение о том, что не проводя лучевую терапию на область гиппокампа можно предотвратить поражение клеток и сохранить функции памяти [32]. В частности, в исследовании II фазы RTOG 0933 у тех больных, кому она не проводилась на область гиппокампа, ухудшение памяти через 4 месяца от начала лечения было значительно меньше (7% и 30% соответственно) [33]. Необходимо отметить, что у 4,5% пациентов с интракраниальным прогрессированием заболевания в метастатический процесс была вовлечена также область гиппокампа. На основании данных, полученных в исследованиях RTOG 0933 и RTOG 0614, было инициировано исследование III фазы NRG-CC001. Его целью была оценка комбинированного нейропротективного эффекта: отсутствие лучевой терапии на область гиппокампа в комбинации с назначением мемантина во время облучения всего объема головного мозга [34].
Клинические трудности: прогрессирование заболевания, лучевой некроз и псевдопрогрессия
В отдельных случаях встает вопрос о том, являются ли выявленные изменения последствиями проведенной терапии или обусловлены прогрессированием заболевания. Зачастую после выполнения стереотаксической радиохирургии возникает повышенное накопление контраста, некроз и отек, которые сложно интерпретировать. В этих случаях в дополнении к МРТ рекомендовано выполнение ПЭТ с 18F-дезоксиглюкозой, аминокислотами или 18F-дезокситимидином, перфузионной МРТ или магнитно-резонансной спектроскопии [35-38]. Чаще всего проводится тщательное мониторирование с помощью МРТ, продолжающееся иногда в течение нескольких месяцев. Лечение лучевого некроза проводят с помощью стероидов. В том случае, когда их назначение неэффективно, используют гипербарическую оксигенацию и/или назначают анти-VEGF препарат бевацизумаб, которые стабилизируют/нормализуют проницаемость сосудов [39]. В ряде случаев показано выполнение хирургического вмешательства.
У пациентов, получающих иммунотерапию, первоначальное увеличение количества и размеров метастазов может сопровождаться последующей стабилизацией или регрессией лучевой картины. Последнее обусловлено механизмом действия иммунопрепаратов [40, 41].
СИСТЕМНАЯ ТЕРАПИЯ
Доказательства эффективности существующих режимов гормоно- и химиотерапии
На сегодняшний день ни один из препаратов системной терапии не одобрен в лечении больных РМЖ с метастатическим поражением головного мозга. Несмотря на это, в ряде клинических случаев или в небольших проспективных исследованиях их эффективность была представлена (таблица 3). Например, в исследовании I фазы, проведенном Rivera и соавторами, была изучена эффективность комбинации капецитабина и темозоломида у 24 больных РМЖ, имеющих метастазы в головной мозг (14 пациенток были с впервые выявленным заболеванием, у 10 участниц прогрессирование в головной мозг развилось после предшествующей местной терапии). В соответствии с полученными результатами показатель частоты объективного ответа (ЧОО) со стороны ЦНС составил 18%, медиана времени до прогрессирования была 12 недель [42]. Принимая во внимание невысокую эффективность темозоломида в лечении больных РМЖ, исследователи сделали вывод о роли капецитабина в терапии данных пациентов. Клинические случаи, представленные Мемориальным онкологическим центром им. Слоуна-Кеттеринга, подтвердили эффективность капецитабина в лечении больных с метастазами в ЦНС [43].
Таблица 3. Клинические случаи и исследования по изучению цитотоксической химиотерапии
у больных РМЖ с метастатическим поражением головного мозга.
| Препарат | Режим | Вид исследования | Количество больных РМЖ, получивших исследуемый режим |
Частота объективного ответа со стороны очагов в головном мозге |
Ссылка |
|---|---|---|---|---|---|
| Капецитабин | Капецитабин + темозоломид | I фаза | 24 | 18% | Rivera et al [42] |
| Капецитабин | Ряд клинических случаев | 7 | 43% | Ekenel et al [43] | |
| Антрациклин | Доксорубицин, циклофосфамид | Ряд клинических случаев | 6 | 17% | Rosner et al [44] |
| Пегилированный липосомальный доксорубицин | II фаза | 8 | 62% | Caraglia et al [45] | |
| Липосомальный доксорубицин + циклофосфамид | Ретроспективное | 29 | 41% | Linot et al [46] | |
| Платина | Цисплатин + этопозид | Проспективное | 56 | 38% | Franciosi et al [47] |
| Цисплатин + этопозид | Ряд клинических случаев | 22 | 55% | Cocconi et al [48] | |
| Цисплатин + темозоломид | II фаза | 15 | 40% | Christodoulou et al [49] | |
| Иринотекан | Иринотекан + инипариб | II фаза | 37 | 12% | Anders er al [50] |
| Темозоломид | Темозоломид | II фаза | 19 | 0% | Trudeau et al [51] |
| Темозоломид | II фаза | 4 | 0% | Christodoulou et al [52] | |
| Темозоломид | II фаза | 10 | 0% | Abrey et al [53] | |
| Темозоломид | II фаза | 51 | 4% | Siena et al [54] | |
| Темозоломид + винорельбин | II фаза | 11 | 0% | Iwamoto et al [55] |
Терапия антрациклинами также способствует получению ответа со стороны метастатических очагов в головном мозге. По данным ряда исследований она варьирует от 17% до 62%. Темозоломид в монорежиме обладает минимальной эффективностью в лечении больных РМЖ [51, 53].
Эффективность солей платины, описанная ранее в литературе, позволяла получить ответ у 38-55% пациенток, которые были гораздо менее предлечены, чем сегодня [47, 48]. В исследовании TNT терапия таксанами сравнивалась с препаратами платины в первой линии терапии больных метастатическим тройным негативным РМЖ. Пациентки с клиническими проявлениями метастатического поражения головного мозга не принимали участие в исследовании. В соответствии с полученными результатами ответ со стороны экстракраниальных очагов был значительно выше у больных, имеющих мутации генов BRCA1/2 и получавших карбоплатин, чем доцетаксел [56].
В литературе представлены клинические случаи, в которых показан ответ со стороны метастатических очагов в головном мозге у больных, получавших тамоксифен и ингибиторы ароматазы. Несмотря на это, известно, что метастатическое поражение головного мозга у эстроген-позитивных больных зачастую развивается в конце заболевания, когда оно становится рефрактерным к гормонотерапии [57-60].
В целом при назначении системной терапии off-label в лечении больных РМЖ с метастатическим поражением головного мозга необходимо руководствоваться молекулярным подтипом опухоли, объемом и видом предшествующей терапии, общесоматическим статусом пациентки и сопутствующими заболеваниями. Необходимо учитывать руководства по лечению метастатического РМЖ, как местные, так и международные (рисунок 2). При назначении цитотоксической химиотерапии больным с экстракраниальными метастазами выбор должен быть сделан в пользу последовательного применения препаратов в монорежиме, нежели при сочетании нескольких цитостатиков.
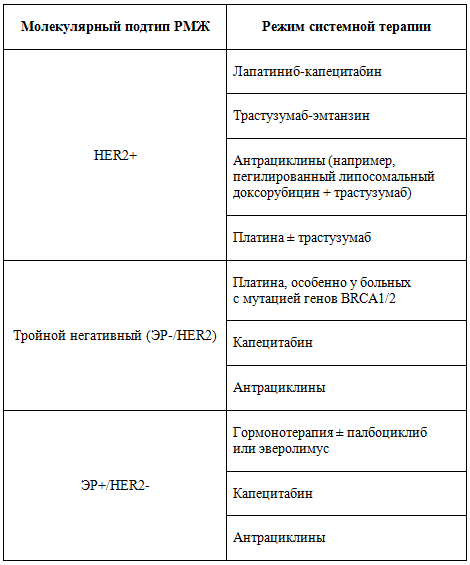
Рисунок 2. Варианты системной терапии больных РМЖ
с метастатическим поражением головного мозга.
Исследуемые режимы цитотоксической терапии
На сегодняшний день основной целью цитотоксической химиотерапии в лечении больных с метастазами в головной мозг является разработка препаратов, максимально проникающих через гематоэнцефалический барьер (таблица 4). На данный момент такие препараты, как этиринотекан пеголь (NKTR-102) и ANG1005, являются наиболее перспективными. NKTR-102 представляет собой ингибитор топоизомеразы-1 длительного действия, продлевающий активность SN38, являющегося активным метаболитом иринотекана [50]. При проведении доклинических исследований (MDA-MB-231Br), сравнивающих иринотекан с NKTR-102, назначение последнего способствовало увеличению выживаемости [61]. Недавно были представлены результаты исследования III фазы, проведенного у больных РМЖ, ранее получавших лечение. Все пациентки, принявшие в нем участие, не имели метастазов в головной мозг или при их наличии находились в стабильном состоянии на момент начала исследования [62]. Несмотря на то, что в целом результаты исследования были отрицательными, незначительное преимущество было выявлено у больных, имевших метастазы в головной мозг и находившихся в стабильном состоянии. Это послужило поводом инициации дополнительного исследования. ANG1005 является новым производным таксанов, обладающим высокой степенью проникновения через гематоэнцефалический барьер [63]. Положительные результаты исследований I фазы послужили поводом инициации последующих исследований, которые сейчас продолжаются [64, 65].
Анти-HER2-терапия
Появление анти-HER2-препаратов значительным образом повлияло на ОВ больных HER2-положительным РМЖ, находящихся как на ранних стадиях заболевания, так и имеющих распространенный процесс. Несмотря на это у половины больных распространенным HER2-положительным РМЖ возникает метастатическое поражение головного мозга.
Во многих проспективных исследованиях изучался лапатиниб, низкомолекулярный ингибитор тирозинкиназы, как в монорежиме, так и в комбинации с химиопрепаратами. В монорежиме его эффективность оказалась небольшой, и частота ответа со стороны метастатических очагов в головном мозге у предлеченных больных не превышала 6% [66]. При комбинации лапатиниба с капецитабином удалось добиться большей эффективности: частота ответа со стороны метастатических очагов в головном мозге составляла 18-38% у предлеченных больных. У больных, ранее не получавших лечение, она составляла 66% [66-70]. В большинстве случаев ответы были устойчивыми. Полученные результаты свидетельствуют о необходимости изучения ингибиторов тирозинкиназы в терапии больных с метастатическим поражением головного мозга.
Помимо лапатиниба среди других ингибиторов тирозинкиназы активно изучаются нератиниб, афатиниб, тукатиниб и многие другие (таблица 4).
Таблица 4. Продолжающиеся исследования по системной терапии
больных РМЖ с метастатическим поражением головного мозга.
| Режим | Фаза исследования | Включение больных с лептоменингеальными метастазами | Молекулярный подтип РМЖ | Клиническое исследование |
|---|---|---|---|---|
| Нератиниб + капецитабин | II | Да, но только при наличии измеряемых метастазов в паренхиме | HER2+ | NCT01494662 |
| Трастузумаб/капецитабин ± тукатиниб (ONT-380) | II | Нет | HER2+ | NCT02614794 |
| Высокодозный трастузумаб + пертузумаб | II | Нет | HER2+ | NCT02536339 |
| Интратекальный трастузумаб + пертузумаб | I | Не оговорено | HER2+ | NCT02598427 |
| Высокодозный лапатиниб + капецитабин | I | Да | HER2+ | NCT02650752 |
| Трастузумаб + винорельбин + эверолимус | II | Больные с диффузными лептоменингеальными метастазами исключены | HER2+ | NCT01305941 |
| Абемациклиб | II | Да, отдельная подгруппа | ЭР+ | NCT02308020 |
| Палбоциклиб | II | Нет | HER2+ или тройной негативный РМЖ |
NCT02774681 |
| Палбоциклиб | II | Нет | Любой подтип, но необходима информация о поражении специфических путей в тканях головного мозга | NCT02896335 |
| Кабозантиниб | II | Да, но только при наличии измеряемых метастазов в паренхиме | ЭР+ или HER2+ | NCT02260531 |
| Пембролизумаб | II | Да, отдельная подгруппа | Любой | NCT02886585 |
| Дурвалумаб | II | Нет | Любой | NCT02669914 |
| Этиринотекан пеголь | II | Нет | Любой | NCT02312622 |
| Этиринотекан пеголь | III | Нет | Любой | NCT02915744 |
| Кабазитаксел | II | Нет | Любой | NCT02166658 |
Нератиниб, необратимый ингибитор EGFR и HER2, проходит завершающие фазы клинического изучения (исследование NALA: сравнение нератиниба в комбинации с капецитабином против лапатиниба в комбинации с капецитабином у больных HER2-положительным метастатическим РМЖ, получивших 2 и более режима предшествующей анти-HER2-терапии по поводу метастатического процесса, NCT01808573). Тем не менее, критерием исключения в продолжающемся исследовании III фазы являются больные, имеющие клинические проявления метастатического поражения головного мозга. В настоящее время проводится исследование II фазы, целью которого является оценка эффективности терапии нератинибом у больных с клиническими проявлениями метастазов в головной мозг. В соответствии с полученными результатами ЧОО в группе больных, получавших нератиниб в монорежиме, составила 8% [71]. Результаты в группе участников, получающих нератиниб/капецитабин, ожидаются. Также как нератиниб, афатиниб является ингибитором EGFR и HER2. Несмотря на то, что препарат был одобрен в лечении больных раком легкого, его изучение у больных РМЖ было приостановлено. Последнее связано с отрицательными результатами, полученными в рандомизированных исследованиях LUX-Breast 1 и LUX-Breast 3 [72, 73]. В частности, в исследовании LUX-Breast 3 комбинация винорельбина и афатиниба сравнивалась с терапией, выбранной на усмотрение исследователя. Оказалось, что она не была эффективной у больных HER2-положительным РМЖ, имеющих метастатическое поражение головного мозга [72].
В отличие от нератиниба или афатиниба, тукатиниб (ONT-380; ARRY-380) селективно воздействует на HER2 и обладает минимальной активностью по отношению к EGFR. Препарат обладает более благоприятным профилем токсичности с меньшей частотой развития диареи и кожной сыпи. Активный метаболит тукатиниба проникает через гематоэнцефалический барьер. Доклинические исследования продемонстрировали эффективность данного препарата при метастазировании РМЖ в головной мозг. В клиническом исследовании I фазы комбинация тукатиниба и трастузумаба позволила получить ответ у 7% больных. У 1/3 участников стабилизация заболевания сохранялась ≥16 недель [74]. В исследовании IB фазы изучалась комбинация трастузумаба-капецитабина-тукатиниба у больных рефрактерным HER2-положительным метастатическим РМЖ. Объективный ответ со стороны головного мозга был получен у 61% больных, в том числе у 42% пациентов, имеющих измеряемые очаги на момент начала лечения [75]. В настоящее время данный подход изучается в проходящих рандомизированных исследованиях, которые включают в себя как больных с поражением головного мозга, так и без специфического поражения.
Долгое время считалось, что такие моноклональные антитела, как трастузумаб, пертузумаб или трастузумаб-эмтанзин, являются слишком крупными, чтобы проникнуть через гематоэнцефалический барьер. Несмотря на это в исследованиях с использованием трастузумаба, меченого 89Zr, было предположено, что возможно частичное проникновение препарата через поврежденный барьер [76]. Последнее подтверждено рядом клинических случаев, свидетельствующих об активности трастузумаба-эмтанзина (TDM1) [77-79]. В США планируется проведение проспективного исследования с целью подтверждения/опровержения данной информации. Еще одним подходом в поиске метода лечения больных с метастазами в головной мозг является исследование PATRICIA. В нем изучается комбинация высокодозного трастузумаба (6 мг/кг в/в еженедельно) со стандартной дозой пертузумаба (вводимой каждые 3 недели).
Возможно ли предотвратить развитие метастатического поражения головного мозга с помощью химиотерапии?
Вопрос первичной профилактики (предотвращение возникновения) и вторичной профилактики (увеличение времени до последующего прогрессирования у больных, получивших первичную местную терапию) метастатического поражения головного мозга вызывает большой интерес. Насколько необходимо изменять системную терапию после проведения стереотаксической радиохирургии и включать в нее «ЦНС-активный» режим? В настоящее время недостаточно данных, которые бы свидетельствовали в пользу данного подхода.
В исследовании EMILIA был проведен подгрупповой анализ среди участниц, имеющих на момент рандомизации метастатическое поражение головного мозга. Его целью было оценить в данной группе преимущество терапии трастузумабом-эмтанзином (по отношению к лапатинибу-капецитабину) [80]. В соответствии с полученными результатами в данной подгруппе было выявлено аналогичное с общей популяцией преимущество терапии трастузумабом-эмтанзином. Кроме того, не было выявлено явных различий в частоте возникновения новых метастатических очагов в головном мозге у больных, не имеющих их на момент начала исследования (2% в группе трастузумаба-эмтанзина; 0,7% в группе лапатиниба-капецитабина; p – статистически не значимо). Данный анализ имеет ряд ограничений. В первую очередь это связано с тем, что исследование головного мозга не предусматривалось в рамках протокола. Во вторую очередь это связано с возрастающим числом клинических случаев, свидетельствующих об активности трастузумаба-эмтанзина в отношении метастазов в головной мозг.
В настоящее время подход в терапии данных больных остается следующим: в условиях контроля над заболеванием – продолжение проведения системной терапии после выполнения стереотаксической хирургии [81].
Дополнительные возможности таргетной терапии
Среди других вариантов таргетной терапии в лечении больных РМЖ с метастатическим поражением головного мозга активно изучаются ингибиторы CDK4/6, ингибиторы PARP и ингибиторы контрольных точек (таблица 4).
В сравнении только с эндокринотерапией комбинация ингибиторов CDK4/6 палбоциклиба и рибоциклиба с гормонами способствует увеличению выживаемости без прогрессирования (ВБП) больных распространенным РМЖ [82-84]. Среди всех ингибиторов CDK4/6 наибольшей активностью при метастатическом поражении головного мозга обладает абемациклиб. Его эффективность была доказана при проведении доклинических исследований. В ряде клинических исследований при назначении этого препарата до хирургического лечения его концентрация достигала терапевтического уровня [85, 86]. В настоящее время проводятся клинические исследования II фазы по изучению палбоциклиба и абемациклиба у больных, имеющих метастатическое поражение головного мозга.
Терапия больных тройным негативным РМЖ имеет большое значение и представляет значительный научный интерес, что связано в том числе с высокой частотой метастазирования заболевания в головной мозг. Известно, что ингибиторы PARP эффективны при экстракраниальном метастазировании у носительниц мутаций генов BRCA1/2. Тем не менее, у больных спорадическим (ненаследственным) тройным негативным РМЖ их назначение в монорежиме не было эффективным [87]. В настоящее время продолжаются 3 крупных рандомизированных исследования III фазы, целью которых является сравнение ингибиторов PARP с режимами стандартной химиотерапии у больных метастатическим РМЖ, являющихся носительницами мутаций генов BRCA1/2. Ни в одном из них не принимают участие пациентки с клиническими проявлениями метастатического поражения головного мозга. Отдельный интерес вызывает комбинированный подход в лечении больных РМЖ, не имеющих мутаций генов BRCA1/2. Он включает в себя в том числе одновременное назначение с ингибиторами PARP солей платины. В США планируется проведение рандомизированного исследования (S1416), целью которого будет изучение цисплатина ± ингибитора PARP велипариба (ABT-888). Принимая во внимание то, что в доклинических исследованиях велипариб проникал через гематоэнцефалический барьер, в исследование войдет отдельная когорта больных, имеющих специфическое поражение головного мозга. Основным критерием эффективности является показатель ВБП [88].
Существующие на сегодняшний день данные доклинических и клинических исследований позволяют предположить, что на исход заболевания у больных РМЖ большое влияние оказывает иммунная система. В частности, это касается больных с тройным негативным и HER2-позитивным подтипами [89, 90]. Более того, у больных РМЖ, имеющих метастазы в головной мозг, чаще встречается экспрессия PD-L1 [91]. Результаты исследований, проведенных у больных меланомой и раком легкого, свидетельствуют о потенциальной эффективности ингибиторов иммунных контрольных точек у больных с поражением ЦНС [92]. Помимо ингибиторов CTLA-4 и PD-1/PD-L1, изучаются агонисты STING и GITR, а также ингибиторы IDO, TIM3 и LAG3. К сожалению, критерием исключения большинства идущих исследований по иммунотерапии РМЖ являются больные с клиническими проявлениями метастатического поражения головного мозга. Тем не менее, есть ряд открытых, а также запланированных исследований, которые включают данную когорту больных (таблица 4).
ЛЕЧЕНИЕ БОЛЬНЫХ С ЛЕПТОМЕНИНГЕАЛЬНЫМИ МЕТАСТАЗАМИ
Риск развития лептоменингеальных метастазов варьирует от 2% до 40%. Они могут сопровождаться метастатическим поражением паренхимы или быть самостоятельными. По данным, предоставленным Мемориальным онкологическим центром им. Слоуна-Кеттеринга в 1998-2013 гг., среди пациентов с лептоменингеальными метастазами чаще всего были зарегистрированы больные HER2-положительным (26%) и тройным негативным (25%) РМЖ. Последнее позволяет предположить большую частоту их встречаемости в данных группах [93]. Помимо этого лептоменингеальные метастазы чаще возникают у больных инвазивным дольковым раком [94]. Прогноз таких пациентов неблагоприятный – медиана выживаемости составляет 3,5-6 месяцев. Показатель однолетней выживаемости составляет 20% [93, 95]. К благоприятным факторам прогноза относятся HER2-положительный рак, сохранный общесоматический статус и вовлечение только ЦНС. К неблагоприятным факторам прогноза относятся низкий общесоматический статус, прогрессирование/рефрактерность к лечению экстракраниальных очагов и наличие грубого неврологического дефицита.
Чаще всего лечение больных с лептоменингеальными метастазами заключается в проведении лучевой терапии на наиболее крупные очаги с последующим назначением локальной и/или системной химиотерапии. Проведение лучевой терапии, в том числе на область всего головного мозга, позволяет быстро облегчить симптомы заболевания и может быть рекомендовано в первую очередь у больных с прогрессирующим неврологическим дефицитом. С целью облегчения неврологических симптомов больным с большим объемом опухолевой массы рекомендовано проведение локальной химиотерапии [96]. Препаратами выбора в данном случае являются метотрексат, липосомальный цитарабин и тиотепа. В ряде исследований было рекомендовано до постановки катетера и введения препаратов в субарахноидальное пространство определять наличие субарахноидального блока. Выявление последнего может служить препятствием для равномерного распространения препарата и увеличивать риск развития лейкоэнцефалопатии [97-100]. Ряд клинических случаев описывают эффективность проведения системной химиотерапии больным с лептоменингеальными метастазами. Тем не менее, на сегодняшний день данное показание официально не зарегистрировано. Известны случаи эффективного применения таких препаратов, как тамоксифен, ингибиторы ароматазы, внутривенная форма высокодозного метотрексата, капецитабин, лапатиниб/капецитабин и соли платины.
Зачастую больные с лептоменингеальными метастазами исключаются для участия в клинических исследованиях. Тем не менее, в небольшом числе проходящих исследований они принимают участие (таблица 4). В частности, недавно был завершен набор в исследование I/II фазы по изучению интратекального введения трастузумаба. В исследовании была определена рекомендуемая для последующего изучения доза препарата [101]. Тем не менее, на сегодняшний день использование интратекального трастузумаба не рекомендовано в повседневной клинической практике.
ВЫВОДЫ
Лечение больных РМЖ с метастатическим поражением головного мозга (поражение паренхимы или менингеальный канцероматоз) требует мультидисциплинарного подхода, обоснованного распространенностью процесса в ЦНС и экстракраниально предшествующей терапией, общесоматическим статусом, сопутствующими заболеваниями, доступными вариантами терапии. Хирургическое лечение показано больным, имеющим солитарные очаги в головном мозге или большие симптоматические новообразования. Большое значение при этом имеют хороший общесоматический статус и контроль над экстракраниальными очагами. Тем пациентам, у кого ожидается большая выживаемость и число метастатических очагов в головном мозге ограничено, показано выполнение стереотаксической хирургии. Напротив, облучение всего объема головного мозга у данных пациентов стараются избегать. Несмотря на то, что на сегодняшний день не существует режима системной терапии, одобренного для лечения больных РМЖ с метастатическим поражением головного мозга, ряд схем продемонстрировали свою эффективность в проспективных исследованиях. На данный момент системная терапия является вариантом лечения тех пациентов, у кого прогрессирование заболевания развилось после проведения стандартной местной терапии. При ряде обстоятельств подобный подход применим у больных с впервые выявленным заболеванием (например, у асимптоматических пациентов или больных с минимальной симптоматикой). Проводятся исследования с целью поиска новых препаратов, результаты которых ожидают нас в будущем.
Литература:
Узнать больше о лечении рака молочной железы можно на
Большой конференции RUSSCO «Рак молочной железы»
(25-26 января 2018, Лотте Отель Москва)