25.04.2016
Рак легкого (РЛ) является основной причиной смерти от злокачественных новообразований во всем мире [1]. Около 85% всех случаев РЛ приходится на долю немелкоклеточного РЛ (НМРЛ), наиболее распространенным гистологическим вариантом которого является аденокарцинома [2]. Значительный прогресс в лечении метастатической формы НМРЛ (мНМРЛ) связан с выявлением мутации в структуре гена рецептора эпидермального фактора роста (EGFR) и появлением таких ингибиторов тирозинкиназ (ТКИ) 1-го поколения, как эрлотиниб (Тарцева, OSI Pharmaceuticals) и гефитиниб (Иресса, AstraZeneca). Рекомендуемая доза эрлотиниба соответствует максимально переносимой дозе и составляет 150 мг/день, тогда как максимально переносимая доза гефитиниба в 3 раза выше его стандартной рекомендуемой дозы (250 мг/день).
Исследования по изучению эффективности терапии ТКИ EGFR начались около десяти лет назад. Постепенно появились данные о том, что больные аденокарциномой, женщины, ранее не курящие пациенты и больные азиатского происхождения являются более чувствительными к данным препаратам [3, 4]. Ряд последующих исследований позволил выявить, что больные с мутацией в структуре гена EGFR имеют более выраженный противоопухолевый эффект при приеме гефитиниба или эрлотиниба [5, 6]. Таким образом, на сегодняшний день ТКИ EGFR являются основой терапии больных НМРЛ с мутацией EGFR.
В исследовании 2 фазы IDEAL 1 (изучение эффективности двух дозовых режимов гефитиниба у больных мНМРЛ) было выявлено, что частота объективного ответа (ЧОО) у больных азиатской расы (японцы) составляет 27,5%, что превосходит ЧОО у пациентов неазиатского происхождения [3]. Результатом полученных данных явилось одобрение гефитиниба в Японии в 2002 г. в качестве препарата второй и последующих линий химиотерапии. Четыре года спустя в исследовании 3 фазы ISEL (сравнение эффективности гефитиниба и плацебо в качестве второй и третьей линии терапии больных мНМРЛ) было показано, что терапия гефитинибом не обладает преимуществом перед плацебо в отношении показателей общей выживаемости (ОВ) больных (5,6 мес. и 5,1 мес. соответственно; HR 0,89; p=0,087) [7]. Напротив, в схожем по дизайну исследовании 3 фазы BR.21 (прямое сравнение между эрлотинибом и плацебо у больных мНМРЛ, ранее получавших одну или две линии химиотерапии с платиновыми производными) медиана ОВ была достоверно выше в группе больных, получавших эрлотиниб (6,7 мес. и 4,7 мес. соответственно; HR 0,70; p=0,001) [8]. На основании полученных результатов эрлотиниб был одобрен в Японии в 2007 г. у больных мНМРЛ, рефрактерных к химиотерапии первой или второй линии.
Несмотря на то, что в 2008-2009 гг. оба препарата широко использовались в Японии, прямых проспективных исследований 3 фазы, сравнивающих между собой гефитиниб и эрлотиниб в лечении мНМРЛ, не было. В связи с этим группой японских исследователей во главе с проф. Urata Y. было инициировано мультицентровое рандомизированное исследование 3 фазы, целью которого было показать, что терапия гефитинибом не хуже по сравнению с терапией эрлотинибом. Результаты данной работы были опубликованы недавно в Journal of Clinical Oncology [9].
В исследовании приняли участие больные с гистологически или цитологически подтвержденным диагнозом аденокарциномы легкого IIIB или IV стадии или с рецидивом заболевания после выполненного оперативного вмешательства. Все пациенты получили не менее одной линии химиотерапии по поводу метастатического процесса и никогда не находились на терапии ТКИ EGFR. Возраст участников исследования был ≥20 лет, статус по шкале ECOG 0-2. Все пациенты, вошедшие в исследование, имели измеряемые очаги заболевания; нормальное функционирование всех жизненно важных органов. У участников исследования определяли мутацию в структуре гена EGFR.
Все пациенты были рандомизированы в соотношении 1:1 в две группы, одна из которых получала эрлотиниб (150 мг/день), а вторая – гефитиниб (250 мг/день). Терапия продолжалась до прогрессирования заболевания или развития признаков непереносимой токсичности или отказа пациента от участия в исследовании. При развитии нежелательных явлений доза эрлотиниба могла быть снижена до 100 мг в день и 50 мг в день, а доза гефитиниба – до 250 мг каждые два или три дня [10-12].
Основным критерием эффективности был показатель выживаемости без прогрессирования (ВБП). Помимо этого проводилась оценка ОВ, ЧОО, токсичности, времени до неудачи лечения (time to treatment failure, TTF). Оценка терапии (КТ грудной и брюшной полости) выполнялась каждые 4 недели.
С июля 2009 г. по октябрь 2012 г. в исследование был включен 561 пациент из 63 клиник Японии. Из них у 401 (71,7%) больного была выявлена мутация в структуре гена EGFR. Анализ полученных результатов был выполнен на данных 551 участника исследования (276 – из группы, получившей гефитиниб, и 275 – из группы, находившейся на терапии эрлотинибом). Все характеристики больных на момент начала терапии, за исключением общесоматического статуса по шкале ECOG, были сопоставимы между сравниваемыми группами. Медиана наблюдения составила 25,1 мес. (95% CI 22,1-30,1 мес.) в группе, получавшей гефитиниб, и 26,5 мес. (95% CI 21,9-35,1 мес.) в группе, получавшей эрлотиниб. Основной причиной прекращения лечения было прогрессирование заболевания.
По результатам данного исследования медиана ВБП в группе больных, получавших гефитиниб, и в группе, находившейся на терапии эрлотинибом, составила 6,5 мес. и 7,5 мес. соответственно (HR 1,125; 95% CI 0,940-1,347; p=0,257). Медиана времени до неудачи лечения составила 5,6 и 5,3 мес. соответственно (HR 1,032; 95% CI 0,866-1.231). Медиана ОВ между сравниваемыми группами составила 22,8 мес. (гефитиниб) и 24,5 мес. (эрлотиниб) (HR 1,038; 95% CI 0,833-1.294; p=0,768). Показатель ЧОО составил 45,9% и 44,1% соответственно. Результаты по ВБП и ОВ между сравниваемыми группами представлены на рис.1.
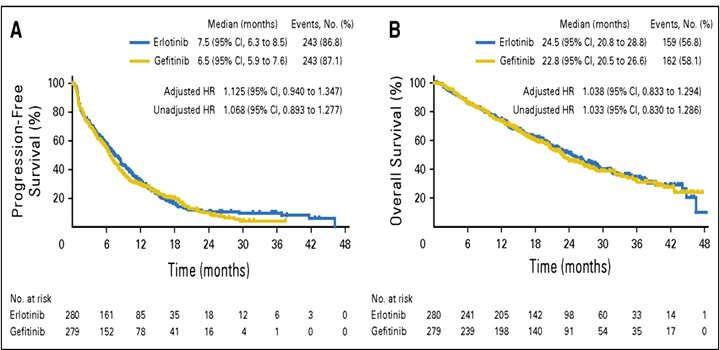
Рисунок 1. Выживаемость без прогрессирования и общая выживаемость
в группах больных, получавших гефитиниб/эрлотиниб.
Медиана ВБП у больных, имевших мутацию в структуре гена EGFR, составила 8,3 мес. (гефитиниб) и 10,0 мес. (эрлотиниб) (HR 1,093; 95% CI 0,879-1,358; p=0,424). Результаты по ВБП у больных, имевших мутацию EGFR, а также мутацию Ex 19de в гене EGFR, мутацию L858R и не имеющих мутацию в структуре гена EGFR, представлены на рис.2.
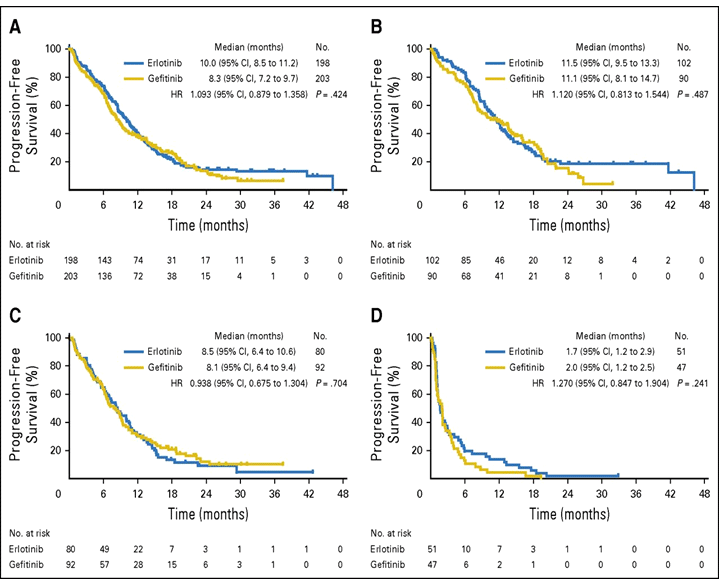
Рисунок 2. Выживаемость без прогрессирования в группах больных, получавших гефитиниб/эрлотиниб,
в зависимости от мутационного статуса опухоли: A – имевшие мутацию EGFR, B – имевшие мутацию Ex 19de в гене EGFR,
С – имевшие мутацию L858R, D – не имеющие мутацию в структуре гена EGFR.
Среди нежелательных явлений 3-4 степени в обеих группах преобладали кожная сыпь (2,2% в группе гефитиниба и 18,1% в группе эрлотиниба) и подъем уровня трансаминаз (АЛТ, АСТ) в сыворотке крови (6,1% и 13,0% в группе гефитиниба и 2,2% и 3,3% в группе эрлотиниба).
Таким образом, проведенное исследование явилось первым проспективным рандомизированным исследованием 3 фазы, напрямую сравнивающим между собой два ТКИ EGFR первого поколения (гефитиниб и эрлотиниб) в лечении больных метастатической аденокарциномой легкого. На основании полученных результатов авторы сделали вывод о том, что при оценке показателя ВБП терапия гефитинибом не уступает терапии эрлотинибом в данной группе пациентов.
Литература: