Новости онкологии
16.03.2016
Пеметрексед-цисплатин или этопозид-цисплатин в комбинации с лучевой терапией и консолидирующей химиотерапией в лечении местно-распространенного неплоскоклеточного немелкоклеточного рака легкого (результаты исследования 3 фазы PROCLAIM)
Немелкоклеточный рак легкого (НМРЛ) – самый распространенный вариант рака легкого, встречающийся в 85% случаев заболевания [1] и имеющий более чем в 25% случаев местно-распространенную форму болезни [2]. Стандартом терапии больных неоперабельной III стадией НМРЛ, находящихся в удовлетворительном общем состоянии, является сочетанное проведение химиотерапии на основе препаратов платины и лучевой терапии [3,4]. Общепризнанного режима сочетанной химиолучевой терапии на сегодняшний день не существует [4]. Среди режимов химиотерапии чаще всего используются комбинации этопозид-цисплатин или карбоплатин-паклитаксел [5,6]. Оптимальная доза лучевой терапии варьирует в диапазоне от 60 до 66 Гр [3,7,8].
Несмотря на прогресс в лечении данного заболевания, отразившийся в улучшениях показателей локорегионального контроля и общей выживаемости (ОВ), данные одного из метаанализов продемонстрировали, что сочетанное проведение химиолучевой терапии в лечении местно-распространенного НМРЛ не снижает риск развития отдаленных метастазов (сравнение проводилось с химиолучевой терапией, проведенной последовательно) [9]. Напротив, при сочетанной химиолучевой терапии отдаленные метастазы развиваются у более чем 50% пациентов [3], а у 40% больных может возникнуть местный рецидив [6,7]. Помимо этого, консолидирующая терапия доцетакселом оказалась неэффективной [10]. В связи с этим вопрос о создании более эффективных и менее токсичных режимов химиотерапии у данной группы больных стал как нельзя более актуальным.
Пеметрексед, многоцелевой антифолат, активно используется в терапии неплоскоклеточного НМРЛ, в том числе и в сочетании с лучевой терапией [11,12]. В отличие от многих комбинаций химиотерапевтических препаратов комбинация пеметрексед-цисплатин, являющаяся на сегодняшний день стандартом терапии метастатического неплоскоклеточного НМРЛ, в сочетании с лучевой терапией обладает относительно хорошо переносимым профилем токсичности [13-21]. В лечении метастатического неплоскоклеточного НМРЛ проведение поддерживающей терапии пеметрекседом после 4-х курсов первой линии терапии продемонстрировало преимущество в ОВ [22,23]. Помимо этого, пеметрексед активно изучался в терапии местно-распространенного НМРЛ в качестве препарата консолидирующей терапии после режимов химиолучевой терапии с включением пеметрекседа-платины. Полученные результаты [13,15,18,19] позволяют предположить, что этот режим может оказывать системный эффект и снижает в том числе риск развития отдаленных метастазов.
Знание данной информации послужило основой для проведения настоящего исследования 3 фазы PROCLAIM [22]. Целью исследования явилась оценка преимущества сочетанного проведения терапии с включением пеметрекседа-цисплатина и лучевой терапии с последующим проведением поддерживающей терапии пеметрекседом над режимом с включением этопозида-цисплатина и лучевой терапии с последующим проведением поддерживающей терапии любыми препаратами, помимо пеметрекседа, в лечении больных IIIA/B стадиями НМРЛ.
В исследовании приняли участие больные ≥18 лет с гистологически/цитологически подтвержденным диагнозом неплоскоклеточного НМРЛ, IIIA/B стадии, имевшие статус по шкале ECOG 0-1 балл. В исследование не включались пациенты, получившие системную химиотерапию по поводу НМРЛ. Пациенты были рандомизированы в соотношении 1:1 в две группы. Группа A получала пеметрексед (500 мг/м2 в/в) и цисплатин (75 мг/м2 в/в) каждые 3 недели 3 курса и одновременно лучевую терапию (60-66 Гр) с последующим проведением 4-х курсов консолидирующей терапии пеметрекседом (500 мг/м2 в/в) каждые 3 недели. Группа B получала этопозид (50 мг/м2 в/в 1-5 дни) и цисплатин (50 мг/м2 в/в 1, 8 дни) каждые 4 недели 2 курса и одновременно лучевую терапию (60-66 Гр) с последующим проведением 2-х курсов консолидирующей терапии на основе цисплатина (на усмотрение исследователя – этопозид-цисплатин или винорельбин-цисплатин или паклитаксел-карбоплатин).
Основным критерием эффективности был показатель ОВ.
С октября 2008 г. по август 2012 г. в исследование было включено 555 пациентов (283 в группу A и 272 в группу B). По результатам данного исследования медиана ОВ в группе A составил 26,8 мес., тогда как в группе B – 25,0 мес. (ОР 0.98; 95% ДИ 0.79–1.20; p=0.831). Показатели одно, двух- и трехлетней выживаемости в группах A и B составили 76% и 77%, 52% и 52%, 40% и 37% соответственно. Результаты представлены на рис.1A.
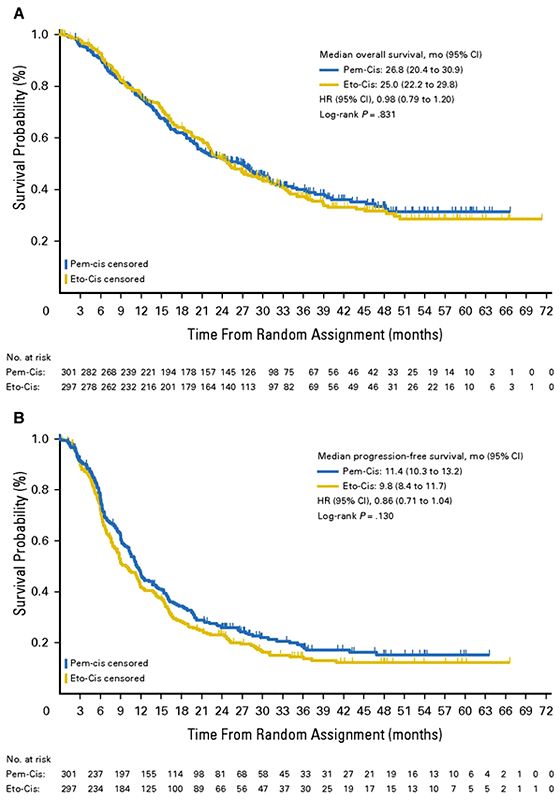
Рисунок 1. Общая выживаемость (A) и выживаемость без прогрессирования (В) в исследовании PROCLAIM.
Медиана выживаемости без прогрессирования в группе A составила 11,4 мес., в то время как в группе B – 9,8 мес. (ОР 0.86; 95% ДИ 0.71–1.04; p=0.130). Результаты представлены на рис.1B. Частота объективного ответа значительным образом не отличалась между сравниваемыми группами – 35,9% в группе A и 33,0% в группе B.
При оценке профиля безопасности оказалось, что у участников исследования, составивших группу А, за весь период лечения реже встречались какие-либо нежелательные явления 3-4 ст., связанные с проводимым лечением (64.0% и 76.8% соответственно; p=0.001), в том числе это касалось и нейтропении (24.4% и 44.5%; p<0.001).
На основании результатов данного исследования авторы сделали вывод, что комбинация пеметрекседа-цисплатина с одновременным проведением лучевой терапии и последующим проведением консолидирующей терапии пеметрекседом не обладает преимуществом по отношению к стандартному режиму химиолучевой терапии в лечении III стадии неоперабельного неплоскоклеточного НМРЛ.
Литература:
- Molina JR, Yang P, Cassivi SD, et al. Non-small cell lung cancer: Epidemiology, risk factors, treatment, and survivorship. Mayo Clin Proc. 2008, 83: 584-594.
- Morgensztern D, Ng SH, Gao F, et al. Trends in stage distribution for patients with non-small cell lung cancer: A National Cancer Database survey. J Thorac Oncol. 2010. 5: 29-33.
- Bezjak A, Temin S, Franklin G, et al. Definitive and adjuvant radiotherapy in locally advanced non-small-cell lung cancer: American Society of Clinical Oncology clinical practice guideline endorsement of the American Society for Radiation Oncology evidence-based clinical practice guideline. J Clin Oncol. 2015. 33: 2100-2105.
- Vansteenkiste J, De Ruysscher D, Eberhardt WE, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013. 24: vi89-vi98.
- Santana-Davila R, Devisetty K, Szabo A, et al. Cisplatin and etoposide versus carboplatin and paclitaxel with concurrent radiotherapy for stage III non-small-cell lung cancer: an analysis of Veterans Health Administration data. J Clin Oncol. 2015. 33: 567-574.
- Steuer CE, Behera M, Higgins KA, et al. Comparison of concurrent use of carboplatin-paclitaxel versus cisplatin-etoposide with thoracic radiation for stage III NSCLC patients: A systematic review. J Clin Oncol. 2015. 33:409s (suppl; abstr 7536).
- Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): A randomised, two-by-two factorial phase 3 study. Lancet Oncol. 2015. 16: 187-199.
- Eberhardt WE, De Ruysscher D, Weder W, et al. Panel Members. 2nd ESMO Consensus Conference in Lung Cancer: Locally advanced stage III non-small-cell lung cancer. Ann Oncol. 2015. 26: 1573-1588.
- Aupérin A, Le Péchoux C, Rolland E, et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol. 2010. 28: 2181-2190.
- Hanna N, Neubauer M, Yiannoutsos C, et al., Hoosier Oncology Group, US Oncology. Phase III study of cisplatin, etoposide, and concurrent chestradiation with or without consolidation docetaxel in patients with inoperable stage III non-small-cell lung cancer: The Hoosier Oncology Group and U.S. Oncology. J Clin Oncol. 2008. 26: 5755-5760.
- Scagliotti G, Brodowicz T, Shepherd FA, et al. Treatment-by-histology interaction analyses in three phase III trials show superiority of pemetrexed in nonsquamous non-small cell lung cancer. J Thorac Oncol. 2011. 6: 64-70.
- Bischof M, Weber KJ, Blatter J, et al. Interaction of pemetrexed disodium (ALIMTA, multitargeted antifolate) and irradiation in vitro. Int J Radiat Oncol Biol Phys. 2002. 52: 1381-1388.
- Cardenal F, Arnaiz MD, Morán T, et al. Phase I study of concurrent chemoradiation with pemetrexed and cisplatin followed by consolidation pemetrexed for patients with unresectable stage III non-small cell lung cancer. Lung Cancer. 2011. 74: 69-74.
- Gadgeel SM, Ruckdeschel JC, Patel BB, et al. Phase II study of pemetrexed and cisplatin, with chest radiotherapy followed by docetaxel in patients with stage III non-small cell lung cancer. J Thorac Oncol. 2011. 6: 927-933.
- Brade A, Bezjak A, MacRae R, et al. Phase I trial of radiation with concurrent and consolidation pemetrexed and cisplatin in patients with unresectable stage IIIA/B non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 2011. 79: 1395-1401.
- Li BS, Gong HY, Huang W, et al. Phase I study of pemetrexed, cisplatin, and concurrent radiotherapy in patients with locally advanced non-small cell lung cancer. Am J Clin Oncol. 2012. 35: 115-119.
- Brade AM, Bezjak A, MacRae R, et al. A phase II study of concurrent pemetrexed/cisplatin/radiation (RT) for unresectable stage IIIA/B non-small cell lung cancer (NSCLC). J Clin Oncol. 2010. 28:15s, (abstr 7087).
- Niho S, Kubota K, Nihei K, et al. Dose-escalation study of thoracic radiotherapy in combination with pemetrexed plus Cisplatin followed bypemetrexed consolidation therapy in Japanese patients with locally advancednonsquamous non-small-cell lung cancer. Clin Lung Cancer. 2013. 14: 62-69.
- Choy H, Schwartzberg LS, Dakhil SR, et al. Phase 2 study ofpemetrexed plus carboplatin, or pemetrexed plus cisplatin with concurrentradiation therapy followed by pemetrexed consolidation in patients with favorable-prognosis inoperable stage IIIA/B non-small-cell lung cancer. J Thorac Oncol. 2013. 8: 1308-1316.
- Heinzerling JH, Choy H, Hughes RS, et al. Toxicity and response of pemetrexed plus carboplatin or cisplatin with concurrent chest radiation therapy for patients with locally advanced non-small cell lung cancer: A phase I trial. J Thorac Oncol. 2010. 5: 1391-1396.
- Mornex F, Peignaux K, Germain T, et al. Phase I study of pemetrexed and cisplatin with concurrent high-dose thoracic radiation afterinduction chemotherapy in patients with unresectable locally advanced non-small cell lung cancer. Lung Cancer. 2013. 80: 68-74.
- Senan S, Brade A, Wang L, et al. PROCLAIM: randomized phase III trial of pemetrexed-cisplatin or etoposide-cisplatin plus thoracic radiation therapy followed by consolidation chemotherapy in locally advanced nonsquamous non-small-cell lung cancer. J Clin Oncol. Published online before print January 25, 2016, doi:10.1200/JCO.2015.64.8824.
