Новости онкологии Уголок радиотерапевта
04.12.2023
Интерес онкологического сообщества к проблеме применения протонного излучения в терапии больных с опухолями различных локализаций велик. Теоретически метод имеет преимущества перед традиционным фотонным излучением в плане снижения нагрузки на критических здоровых тканях с концентрацией максимума дозы на вовлеченных в опухолевый процесс зонах, это обусловлено физическими особенностями протонного излучения – и пока это основное предназначение протонов. Однако пока подтверждений тому, что это имеет клинический выигрыш в сравнении с фотонами, практически нет. Сравнительных исследований 3 фазы очень мало, опираться на имеющиеся данные в основном небольших работ довольно сложно. Несмотря на постепенное увеличение числа центров протонной терапии в мире, говорить о широком применении метода у онкологических больных, которым требуется лучевая терапия, пока рано, не только в силу чрезвычайно высокой стоимости протонной терапии, но и ввиду недоказанности клинических преимуществ.
Немалый интерес вызвала недавняя публикация голландских и итальянских авторов в «Зеленом журнале» – Radiotherapy & Oncology – датируемая уже 2024 годом [1] и касающаяся лечения больных местнораспространенным немелкоклеточным раком легкого III стадии. Стандартом лечения для большинства подобных пациентов является одновременная химиолучевая терапия (ХЛТ) с последующей консолидацией дурвалумабом. При наличии массивного опухолевого процесса ХЛТ, несмотря на эффективность, чревата развитием острых и отсроченных токсических эффектов, которые могут негативно повлиять на дальнейшую судьбу пациентов, в том числе из-за невозможности проведения консолидирующей иммунотерапии по причине развития лучевых пневмонитов, эзофагитов и т.д. Кроме того, лучевая/
С июня 2016 года по декабрь 2022 года в 4 центрах Нидерландов и Италии проспективно отслежены результаты лечения 271 пациента с НМРЛ III стадии, которые получали стандартную ХЛТ на основе препаратов платины; более трети имели плоскоклеточный рак (36%). Из них 200 больных получали облучение фотонной терапией методикой IMRT, а 71 – протонами (IMPT). Лимфопения ≥3 степени в процессе проведения ХЛТ была отмечена значительно чаще в группе больных, получавших фотонную терапию, в сравнении с протонной: 67% против 47% (отношение рисков 2,2; 95% ДИ 1,0-4,9; P=0,032), при этом выбор режима ХТ (еженедельное введение или 1 раз в 3 недели) не влиял на частоту и выраженность лимфопении. Анемия 3 степени и выше также наблюдалась чаще в группе фотонов (отношение рисков 3,8; 95% ДИ 1,6-9,3; P=0,003) (рис.1А), причем наиболее часто это осложнение встречалось при выборе режима ХТ с введением 1 раз в 3 недели и было достоверно ассоциировано с худшей общей выживаемостью. Протонная терапия в два раза реже приводила к ухудшению общего состояния пациента (статусу по ECOG ≥2) на отрезке 21 день после начала ХЛТ (13% против 26%; OR=0,44; 95% ДИ 0,2-0,96; P=0,04) и через 42 дня (24% против 39%, OR=0,49; 95% ДИ 0,26-0,91; P=0,024) (рис.1В).
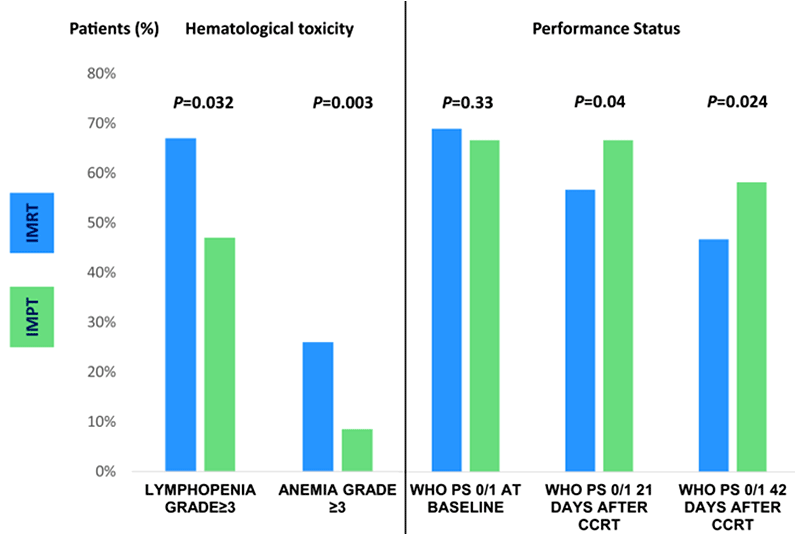
Рисунок 1. Рисунок 1. А – частота анемии и лимфопении ≥3 степени в процессе ХЛТ при применении IMRT и IMPT; В – объективный статус пациентов до начала лечения, через 21 и 42 дня после начала ХЛТ при использовании IMRT и IMPT.
Применение протонной терапии позволило уменьшить облучаемые объемы и сократить дозы на критических органах – костном мозге (для определения которого оконтуривались костные структуры, в которых преимущественно содержатся очаги кроветворения – грудина, ребра, лопатки, ключицы и тела позвонков Th1-12), легких, сердце (рис.2).
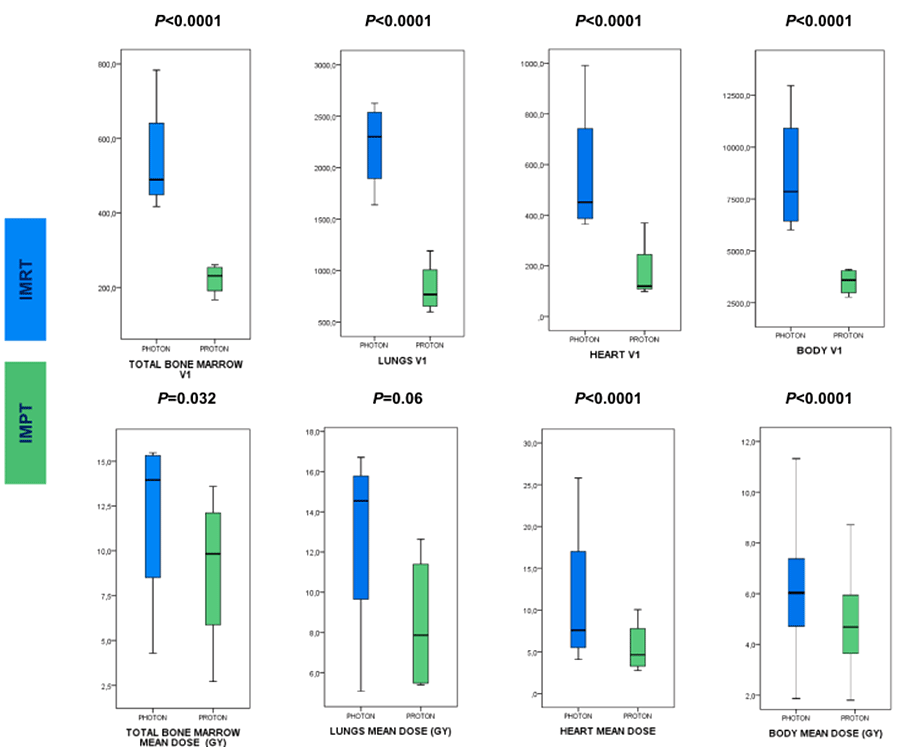
Рисунок 2. Сравнение облучаемых объемов при применении IMRT и IMPT.
В итоге в процентном соотношении большее количество пациентов в группе IMPT начали получать консолидирующую терапию дурвалумабом (74% против 52%), причем в более ранние сроки (в пределах 42 дней после окончания ХЛТ), чем в группе IMRT (72% против 51%).
Дальнейшее отслеживание результатов лечения этих пациентов продемонстрирует, будут ли эти различия транслироваться в лучшие показатели выживаемости без прогрессирования или общей выживаемости, пока авторы не сообщают о подобных планах. Однако эти результаты можно рассматривать как уверенный шаг в сторону подтверждения возможных преимуществ протонной терапии, в частности, снижения токсичности стандартного химиолучевого лечения больных с местнораспространенным раком легкого.
Источник: Francesco Cortiula, et al. Proton and photon radiotherapy in stage III NSCLC: Effects on hematological toxicity and adjuvant immune therapy. Radiotherapy and Oncology. 2024; 190: 110019.