28.11.2023

Неоадъювантная терапия
Начало лечения неметастатического рака поджелудочной железы строится вокруг рентгенологической классификации резектабельности. Неоадъювантная терапия погранично резектабельного рака поджелудочной железы давно является стандартом [6]. Неоадъювантная стратегия исходно резектабельного рака поджелудочной железы до этого года развивалась в исследованиях II фазы, достаточно уверенно и прямолинейно демонстрируя свои успехи по сравнению с традиционным стартом лечения с хирургического этапа. Проведенные исследования PREOPANC1, PACT-15, NEONAX и Prep-02/JSAP-05 указывали на высокие перспективы этого направления [7-10]. Действительно, высокая частота R1 резекций, pN+ статуса и редкая 5-летняя выживаемость этих пациентов за счет отдаленного метастазирования в сочетании с невозможностью провести FOLFIRINOX большинству больных в адъюванте даже в сниженных дозах, указывают на необходимость максимальных усилий для достижения системного контроля роста опухоли на дооперационном этапе.
Однако сначала на ASCO 2023 исследование II фазы NORPACT-1 [11], а затем на ESMO 2023 исследование PREOPANC-2 [12] заставили усомниться, что неоадъювант при исходно резектабельном раке работает так, как это необходимо. Исследование NORPACT-1 предусматривало рандомизацию пациентов с исходно резектабельным РПЖ либо на 4 курса неоадъювантного FOLFIRINOX, либо на операцию на первом этапе, еще до разгрузки желтухи и морфологической верификации опухоли, которые, справедливости ради, необязательны при начале лечения с хирургического этапа. В итоге 17% выбыли из группы неоадъюванта по причине неудачи этих процедур. Несмотря на более высокую частоту R0-резекций, группа неоадъювантного лечения несколько проиграла в общей выживаемости группе исходно хирургического лечения: медианы составили 25 и 38 месяцев соответственно (HR=1,5; p=0,10). Много вопросов и дискуссий в зале на конгрессе ASCO вызвала реализация исследования: почему только 52% пациентов завершили 4 запланированных курса неоадъювантной химиотерапии FOLFIRINOX, почему при заявленном в дизайне продолжении лечении mFOLFIRINOX в адъюванте в обеих группах в реальности пациенты в 73% случаев получали гемцитабин-содержащие режимы, а mFOLFIRINOX получили только 25% в группе с неоадъювантом и 40% в группе хирургии? В итоге все решили дождаться хорошо спланированных исследований III фазы.
И дождались на ESMO 2023 исследования III фазы PREOPANC-2. Исследователи из Нидерландов признались, что PREOPANC-1 настолько убедил их в необходимости неоадъюванта, что группы с хирургическим началом лечения даже не было запланировано. Напомню, что исследование II фазы PREOPANC-1 доказало преимущество неоадъювантной химиолучевой терапии (ХЛТ) по сравнению с операцией на первом этапе только в когорте погранично резектабельного рака, тогда как в когорте исходно резектабельных карцином был отмечен только тренд к положительному влиянию неоадъювантной терапии [13]. В итоге в исследование PREOPANC-2 отбирались пациенты с исходно резектабельным и погранично резектабельным РПЖ при условии охвата опухолью вены <270° и артерии <90°. Пациенты рандомизированы на группу восьми курсов неоадъювантного лечения FOLFIRINOX или группу контроля, получавшую неоадъювантную терапию гемцитабином в сочетании с ХЛТ (рис.1).
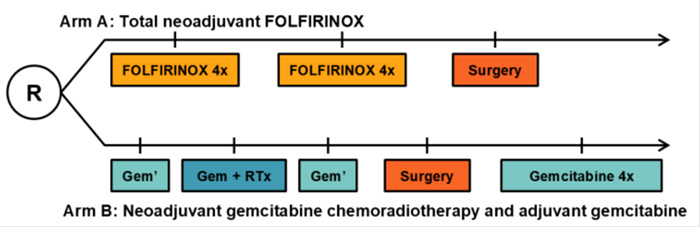
Рисунок 1. Дизайн исследования PREOPANC-2.
Авторы не забыли отметить, что в отличие от своих скандинавских коллег, они провели более 4 курсов FOLFIRINOX в 81% случаев. Но сравнительная эффективность двух групп многих специалистов поставила в тупик. Медианы продолжительности жизни для групп FOLFIRINOX и ХЛТ составили 22 и 21 месяц, без статистически значимых различий (рис.2). Стоит напомнить, что в историческом исследовании PREOPANC-1 медианы продолжительности жизни в группе хирургического лечения и неоадъювантной ХЛТ составили 14,3 и 15,7 месяца соответственно [13]. Критерии включения и режим ХЛТ в экспериментальной группе PREOPANC-1 были такими же, как и в контрольной группе PREOPANC-2.
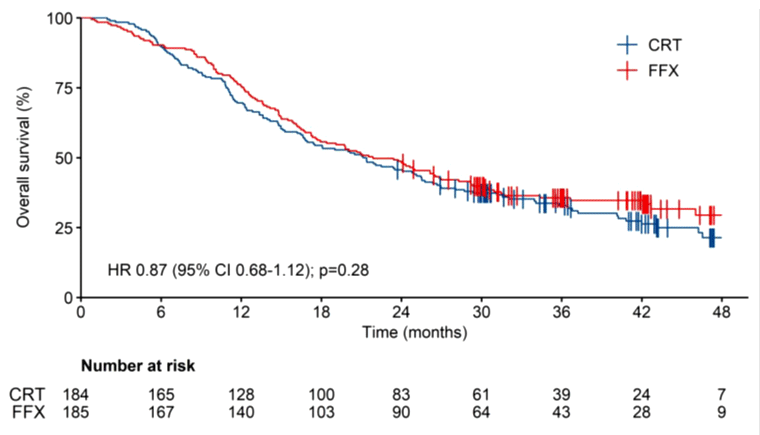
Рисунок 2. Общая выживаемость в исследуемых группах (PREOPANC-2).
Казалось бы, проведенные исследования A021501, ESPAC-5F и CONKO-007 показали, что комбинированная химиотерапия существенно более эффективна, чем химиолучевая терапия при погранично резектабельном процессе, а консолидирующая ХЛТ после нескольких курсов химиотерапии не увеличивает отдаленные результаты лечения и не увеличивает шанс на перевод в резектабельный статус [14-16]. Поэтому отсутствие различия между группами в продолжительности жизни было неожиданным. В дискуссии критики исследования не получили ответа на некоторые свои вопросы:
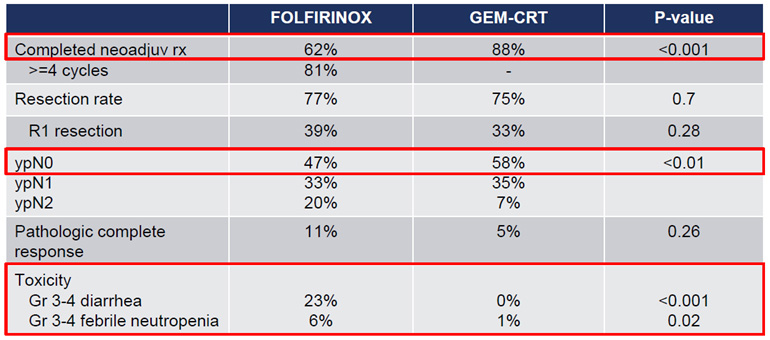
Рисунок 3. Сравнение вторичных конечных точек в исследовании PREOPANC-2.
Пока мы ждем поданализа по статусу резектабельности, уже анонсировано исследование III фазы PREOPANC-3, где сравнят неоадъювантную терапию FOLFIRINOX (8 курсов) и операцию на первом этапе при исходно резектабельном процессе.
Мы следим за развитием событий, а пока неоадъювантную терапию исходно резектабельного РПЖ следует считать исследовательской методикой, не подходящей для рутинной клинической практики.
Наиболее эффективная терапия первой линии
Представленные на ESMO 2023 данные поставили много вопросов. Равнозначны ли две наиболее эффективные комбинации – FOLFIRINOX и гемцитабин + nab-паклитаксел в первой линии лечения рака поджелудочной железы (РПЖ)? В отношении модифицированного FOLFIRINOX со сниженными дозами иринотекана и фторурацила была определенность, что это так, основанная на двух рандомизированных исследованиях: на основании исследования II фазы SWOG S1505 неоадъювантная терапия двумя схемами показала сопоставимые результаты по доле патоморфозов и времени без прогрессирования [1], в японском исследовании JCOG1407 при местнораспространенном раке эти две комбинации показали сопоставимые данные по отдаленным результатам лечения [2]. Кроме того, многочисленные ретроспективные анализы показывали то же самое при метастатическом раке.
Сомнения появились после публикации исследования NAPOLI 3 на конференциях в начале 2023 года. Режим NALIRIFOX с заменой иринотекана на липосомальный иринотекан оказался более эффективным, чем гемцитабин с nab-паклитакселом [3]. При этом сам инновационный режим NALIRIFOX продемонстрировал такие же результаты, как 12 лет назад режим FOLFIRINOX с обычным иринотеканом в регистрационном исследовании PRODIGE4/ACCORD11 [4]. Учитывая отсутствие сравнительных исследований липосомального иринотекана и обычного при любой опухоли, а также историю сравнения липосомального доксорубицина и обычного [5], многие эксперты поспешили поставить режим FOLFIRINOX как приоритетный для метастатического рака поджелудочной железы, передвинув гемцитабин + nab-паклитаксел на вторую линию.
Однако на ESMO 2023 представили первые результаты рандомизированного японского исследования JCOG1611, где сравнили модифицированный FOLFIRINOX с гемцитабином в комбинации с nab-паклитакселом. Получены одинаковые данные по времени без прогрессирования и несколько более высокая (статистически не значимо) общая выживаемость на гемцитабин-содержащей комбинации. Третий рукав с комбинацией иринотекана, оксалиплатина и S1 для России неактуален (рис.4).
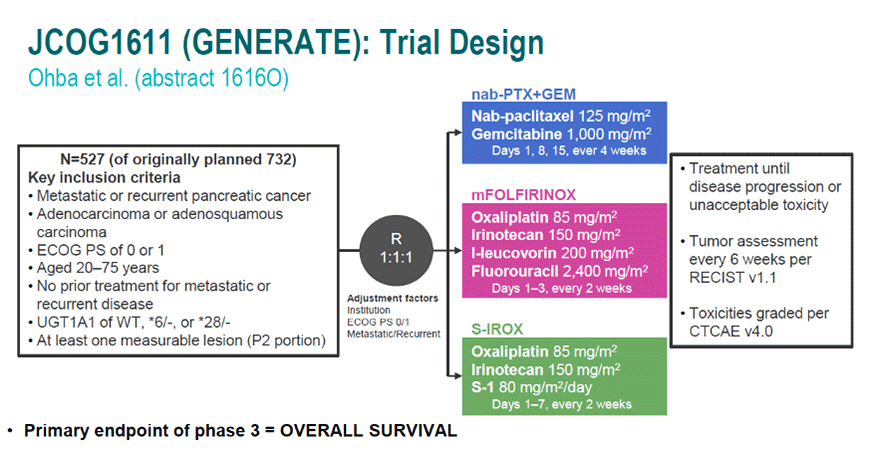
Рисунок 4. Дизайн исследования JCOG1611.
Полученные данные указывают на равнозначную эффективность при старте лечения с модифицированного FOLFIRINOX или гемцитабин+nab-паклитаксел (рис. 5-6). Будет ли полнодозовый FOLFIRINOX более эффективен, чем гемцитабин +nab-паклитаксел, остается вопросом.
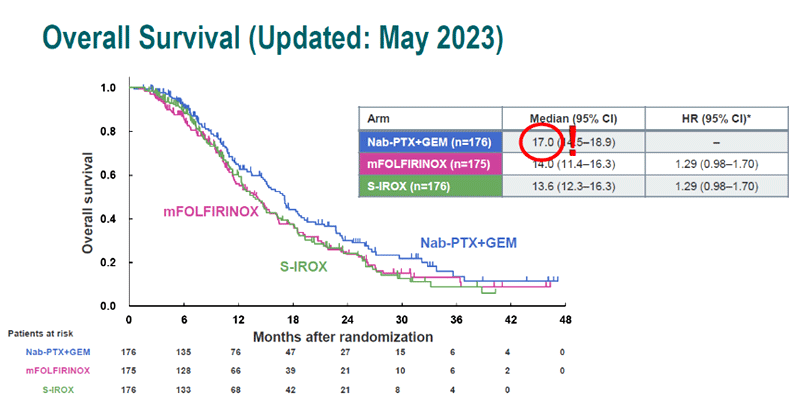
Рисунок 5. Общая выживаемость в исследуемых группах (JCOG1407).
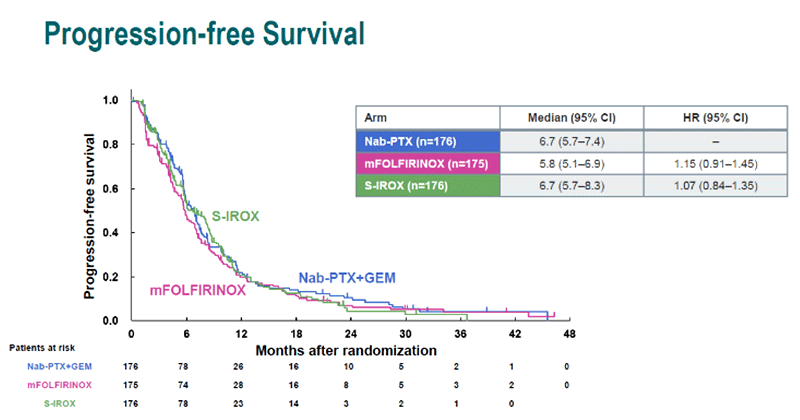
Рисунок 6. Выживаемость без прогрессирования в исследуемых группах (JCOG1407).
Персонализированная терапия
Ну а любителям редкого, но меткого лечения была предложена постерная сессия. В исследовании II фазы препарата zenocutuzumab (биспецифическое антитело к HER2 и HER3) при ранее предлеченном метастатическом РПЖ с NRG1-фьюженами частота объективных эффектов составила 42%, а медиана длительности эффекта – 9 месяцев [17]. NRG1-фьюжены и мутация KRAS не являются взаимоисключающими событиями, и пациенты, содержащие мутации KRAS и NRG1-fusion, не включались в данное исследование. Это очень оптимистичные данные, но ситуацию омрачает редкость данной альтерации (1% случаев при wtKRAS) и отсутствие препарата в РФ. Для наших пациентов с данной находкой можно отметить опубликованные клинические случаи эффективности афатиниба или комбинации эрлотиниба и пертузумаба [18-20].
В поданализе мультикогортного исследования RAGNAR у пациентов с метастатическим предлеченным РПЖ и FGFR1-4-альтерациями исследовался FGFR-ингибитор эрдафитиниб (в РФ зарегистрирован, но пока нет коммерческой доступности). В анализ включено 18 пациентов, все из которых имели FGFR-фьюжены, ни одного пациента с мутациями FGFR. Все эти пациенты также не имели мутации KRAS. Частота объективных эффектов составила 56%, медиана времени без прогрессирования – 7 месяцев, медиана продолжительности жизни – 20 месяцев [21]. И снова оптимизм результатов разбивается о редкость выявления данных альтераций – около 1% случаев [22].
Наконец, в крупном исследовании, направленном на изучение ларотректиниба при NTRK-альтерациях вне зависимости от нозологии (агностический подход), нашлось 7 пациентов с метастатическим РПЖ. Когорта РПЖ была самой малочисленной, поскольку всего 0,7% пациентов имеют NTRK-фьюжены на практике [23]. Как видно на графиках, объективный эффект был примерно у половины из них (рис.7), однако длительность лечения в когорте РПЖ была наименьшей (после меланомы) среди всех злокачественных опухолей (рис.8) [24].
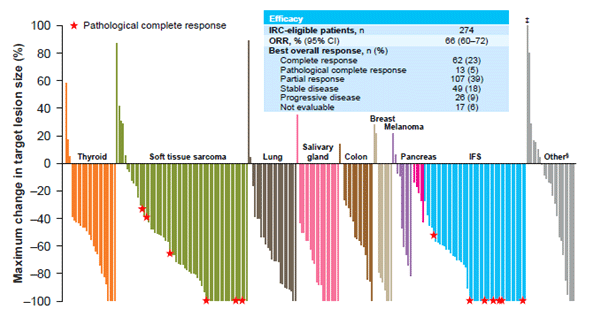
Рисунок 7. Глубина эффектов ларотректиниба при NTRK-альтерациях.
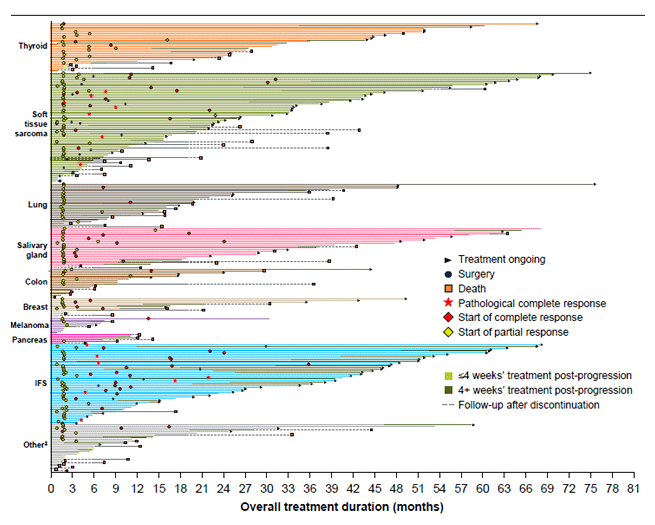
Рисунок 8. Длительность лечения ларотректинибом при NTRK-альтерациях.
B заключение следует отметить постерный доклад из Франции, в котором из 24 пациентов с wtKRAS РПЖ четверть карцином имели различные альтерации, для которых разработаны методы персонализированной медицины, доступные в том числе в нашей стране [25].
Источники: