22.11.2023

В октябре 2023 года прошел очередной ежегодный конгресс ESMO, который оказался очень «урожайным» в части представления новых данных по лечению различных злокачественных новообразований. Естественно, не обошел конгресс вниманием и онкогинекологическую патологию. В этом материале – наиболее примечательные работы в этой области, расставленные, в соответствии с субъективным взглядом автора, от наиболее важных. Have fun.
Индукционная химиотерапия перед химиолучевой терапией улучшает отдаленные результаты лечения рака шейки матки – рандомизированное исследование III фазы INTERLACE
Пожалуй, самым значимым для нашей практики исследованием среди работ, представленных на конгрессе ESMO 2023, стали результаты рандомизированного клинического исследования III фазы INTERLACE, включившего 500 пациенток с местнораспространенным раком шейки матки (РШМ). Основной целью исследования было продемонстрировать, что проведение индукционной химиотерапии паклитакселом 80 мг/м2 и карбоплатином AUC2 (6 еженедельных введений) перед химиолучевой терапией позволит улучшить отдаленные результаты лечения пациенток. Рандомизация между данной группой и группой стандартной химиолучевой терапии осуществлялась в соотношении 1:1. Стратификация производилась в соответствии со стадией, статусом лимфатических узлов, методикой дистанционной (3D-конформная или IMRT) лучевой терапии, вариантом брахитерапии (2D или 3D), размером первичной опухоли, ее гистотипом, а также исследовательским центром. В качестве основного анализируемого показателя исследования выбрана композитная конечная точка, включившая выживаемость без прогрессирования (ВБП) и общую выживаемость (ОВ) пациенток. Целевое время начала химиолучевой терапии после завершения индукционной химиотерапии составляло ≤7 дней. Дизайн исследования представлен на рисунке 1.
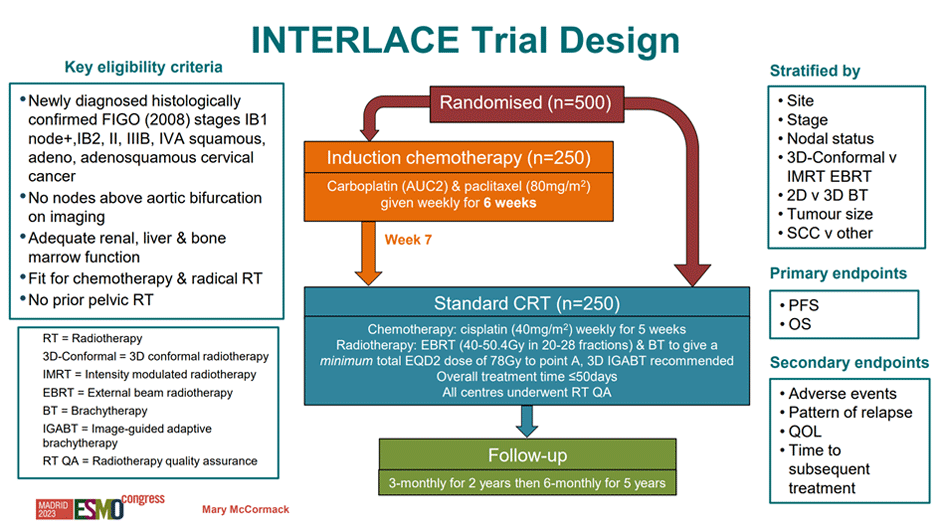
Рисунок 1. Дизайн исследования INTERLACE.
Сформированные группы были сбалансированы по основным демографическим характеристикам, у 70% пациенток в обеих группах была IIB (FIGO 2008) стадия РШМ, у 42% отмечалось метастатическое поражение регионарных лимфатических узлов, плоскоклеточный вариант РШМ был у 82% пациенток. Набор в исследование шел с 2012 года, 76% пациенток было включено в UK, 20% – в Мексике, остальные – Италия, Индия, Бразилия. Индукционная химиотерапия в полном объеме была завершена у 84% пациенток. Медиана времени до начала этапа химиолучевого лечения в экспериментальной группе исследования составила 7 дней (5-53 дня).
Таблица 1. Данные о проведении лучевой терапии в исследовании INTERLACE.
| Только ХЛТ (n=250) | ХТ+ХЛТ (n=250) | |
|---|---|---|
| Получили ДЛТ | 231 (92%) | 242 (97%) |
| IMRT | 93 (40%) | 102 (42%) |
| 3D конформная ЛТ | 138 (60%) | 140 (58%) |
| Получили брахитерапию | 223 (97%) | 238 (98%) |
| 2D | 49 (22%) | 46 (19%) |
| 3D | 106 (48%) | 120 (51%) |
| 3D HRCTV D90 | 68 (30%) | 72 (30%) |
| Получили 5 введений цисплатина | 197 (79%) | 169 (68%) |
| Получили ≥4 введений цисплатина | 224 (90%) | 212 (85%) |
| Медиана длительности ХЛТ | 45 дней (37-88) | 45 дней (36-70) |
По результатам исследования, при медиане наблюдения 64 мес. медиана ВБП не была достигнута ни в одной из групп исследования, показатели 3-летней и 5-летней ВБП в группе индукционной химиотерапии с последующим проведением ХЛТ – 75% и 73% по сравнению с 72% и 64% в контрольной группе (HR 0,65; p=0,013). Медиана ОВ не была достигнута ни в одной из групп исследования, показатели 3-летней и 5-летней ОВ в группе индукционной химиотерапии составили 86% и 80%, в контрольной группе – 80% и 72% соответственно (HR 0,61; p=0,04). Кривые Каплана-Майера представлены на рисунке 2. Ожидаемо снижение частоты прогрессирования опухолевого процесса произошло за счет улучшения системного контроля заболевания. При этом профиль безопасность терапии был приемлемым – некоторое повышение частоты нежелательных явлений G3-4 (59% vs 48%), но только за счет гематологической токсичности (30% vs 13%), что ожидаемо.
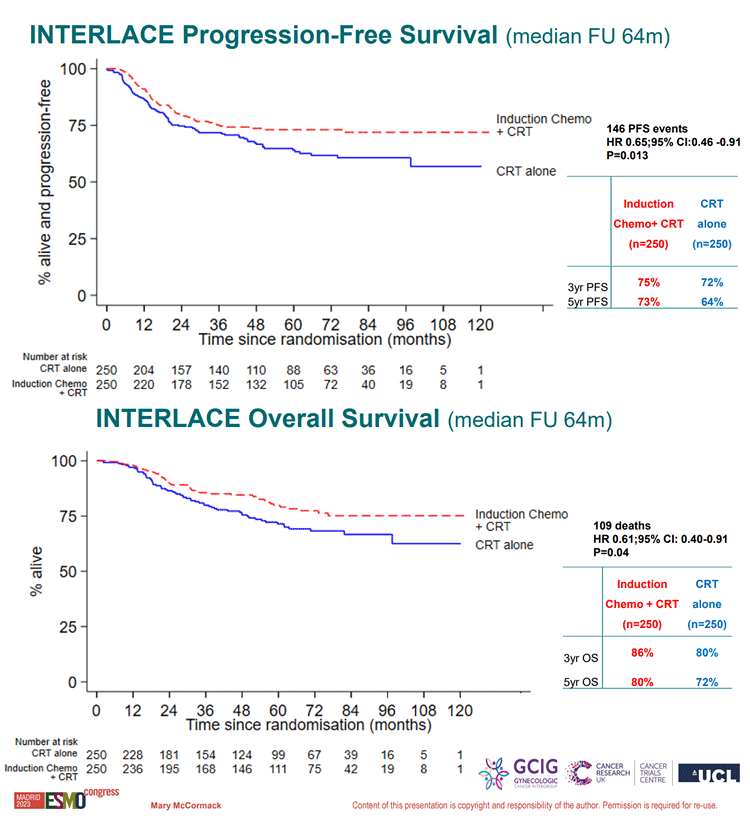
Рисунок 2. Кривые Каплана-Майера по ВБП и ОВ пациенток в исследовании INTERLACE.
Основной вывод из этого исследования – индукционная химиотерапия паклитакселом/
LBA8 – A randomised phase III trial of induction chemotherapy followed by chemoradiation compared with chemoradiation alone in locally advanced cervical cancer: The GCIG INTERLACE trial.
Поддерживающая терапия дурвалумабом/олапарибом при метастатическом раке эндометрия улучшает результаты лечения – исследование DUO-E
Рандомизированное плацебо-контролируемое исследование III фазы DUO-E/ENGOT-EN10 было посвящено оценке эффективности добавления моноклонального антитела к PD-L1 дурвалумаба или комбинации олапариба/дурвалумаба к стандартной первой линии химиотерапии метастатического рака эндометрия. Рандомизация – в три рукава:
Этап поддерживающей терапии проводился до прогрессирования или непереносимой токсичности. В качестве факторов стратификации были выбраны статус MMR (dMMR vs pMMR), стадия опухолевого процесса (de novo метастатическая болезнь или прогрессия после ранее проведенного лечения) и регион происхождения пациента (рис.3).
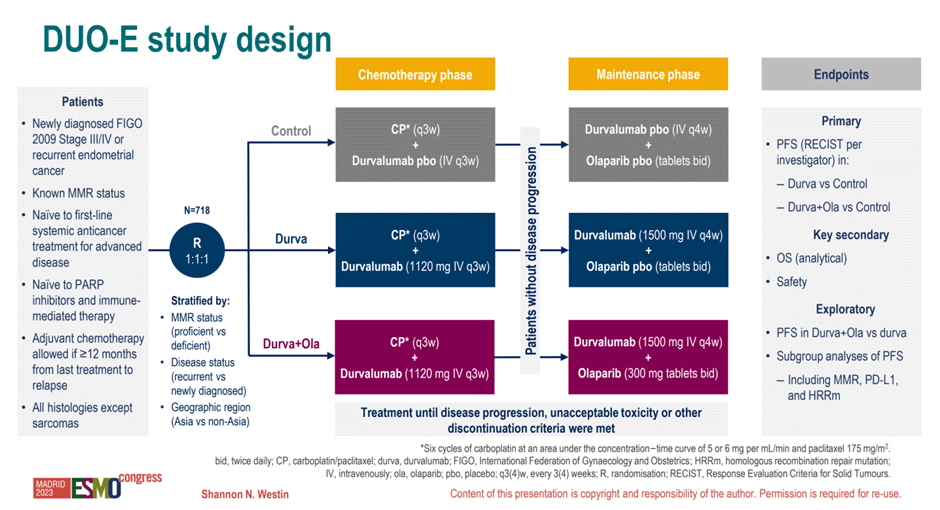
Рисунок 3. Дизайн исследования DUO-E.
В качестве первичной конечной точки исследования была выбрана ВБП пациенток, дизайн исследования предусматривал иерархическое тестирование гипотез и сравнение эффективности двух экспериментальных рукавов исследования с контрольной группой. Всего в исследование было включено 718 пациенток, dMMR статус был выявлен у 20% из них, у 41% пациенток определялись отдаленные метастазы на момент постановки диагноза.
По результатам исследования в общей популяции пациенток в группе только химиотерапии, группе дурвалумаба и группе дурвалумаба с олапарибом медиана ВБП составила 9,6 мес., 10,2 мес. (HR 0,71; p=0,003) и 15,1 мес. соответственно (HR 0,55; p<0,0001). Таким образом, в сравнении с группой химиотерапии оба рукава исследования продемонстрировали достоверное увеличение ВБП пациенток. При оценке данных по ОВ пациенток медиана ОВ составила 25,9 мес. в группе химиотерапии, не была достигнута в группе дурвалумаба (HR 0,77; p=0,120) и в группе дурвалумаба/олапариба (HR 0,59; p=0,003). Отметим, что данные были «незрелыми» на момент проведения анализа (27,7%). Кривые Каплана-Майера по ВБП и ОВ пациенток представлены на рисунке 4.
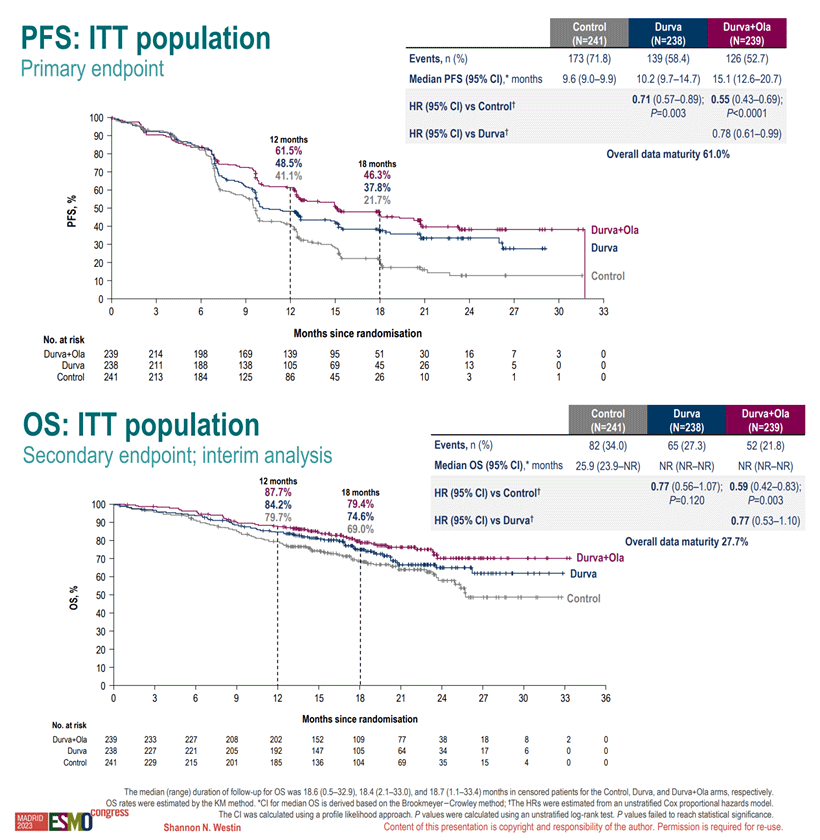
Рисунок 4. Кривые Каплана-Майера по ВБП и ОВ пациенток в исследовании DUO-E.
Естественно, наиболее важным представляется раздельная оценка эффективности комбинации препаратов в зависимости от MMR статуса опухоли, так как данный биомаркер является признанным предиктором эффективности терапии анти-PD-1/PD-L1 агентов при раке эндометрия. В популяции с dMMR медиана ВБП в группе только химиотерапии составила 7 мес. и не была достигнута группе дурвалумаба (HR 0,42; 95% ДИ 0,22-0,80) и комбинации дурвалумаба/олапариба (HR 0,41; 95% ДИ 0,21-0,75). В популяции с pMMR соответствующие показатели составили 9,7 мес., 9,9 мес. (HR 0,77; 95% ДИ 0,60-0,97) и 15,0 мес. (HR 0,57; 95% ДИ 0,44-0,73) (рис.5).
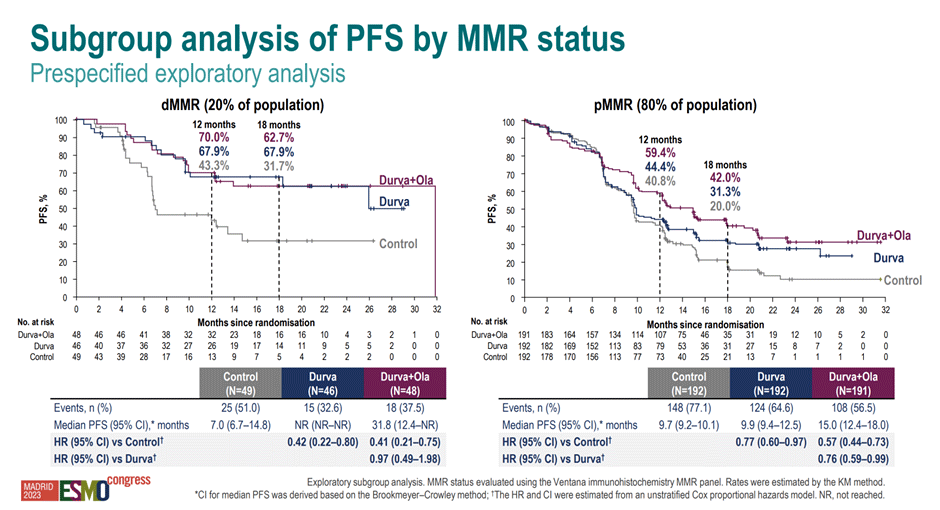
Рисунок 5. Кривые Каплана-Майера по ВБП пациенток в исследовании DUO-E в зависимости от MMR-статуса опухоли.
Таким образом, результаты исследования DUO-E демонстрируют значимое улучшение ВБП пациенток с распространенным раком эндометрия и создают предпосылки для дифференцированного выбора варианта терапии в зависимости от MMR статуса опухоли.
LBA41 – Durvalumab (durva) plus carboplatin/paclitaxel (CP) followed by maintenance (mtx) durva ± olaparib (ola) as a first-line (1L) treatment for newly diagnosed advanced or recurrent endometrial cancer (EC): Results from the phase III DUO-E/GOG-3041/ENGOT-EN10 trial.
Иммунотерапия пембролизумабом улучшает результаты лечения у пациенток, получающих химиолучевую терапию при местнораспространенном РШМ, – исследование KEYNOTE-A18
В рандомизированное плацебо-контролируемое исследование III фазы включались пациентки с IB2-IIB с N+ (FIGO 2014) или III-IVA стадиями РШМ, рандомизация 1:1 в группу пембролизумаба 200 мг каждые 21 день на период химиолучевой терапии или соответствующего ему плацебо, далее проводилась поддерживающая терапия пембролизумабом/
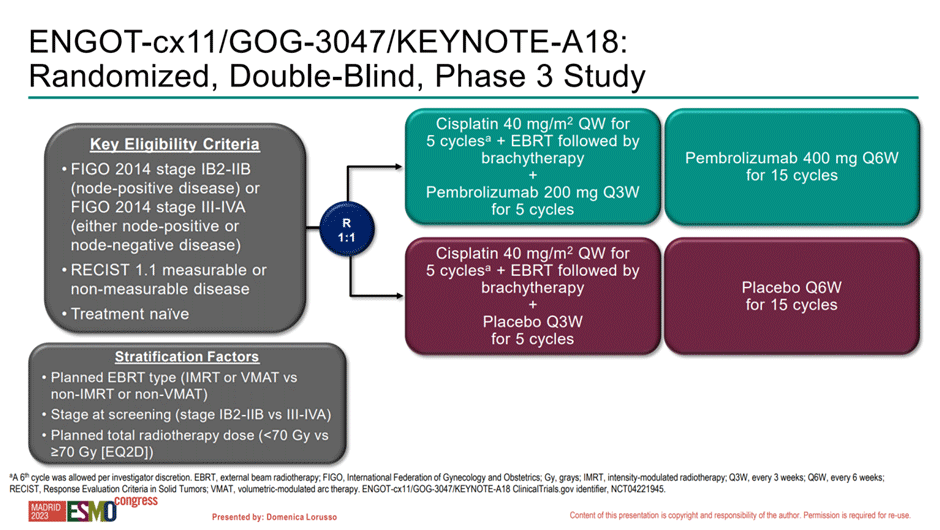
Рисунок 6. Дизайн исследования KEYNOTE-A18.
Всего в исследование было включено 1060 пациенток, однако скрининг для участия в исследовании прошли 1562 пациентки – 32% неудачи скрининга; на что стоит обратить внимание – причины не уточнены. У 56% пациенток была III-IVA стадии опухолевого процесса. Медиана длительности лучевой терапии составила 52 дня (12-139 дней), 75% пациенток завершили данный этап лечения в течение 56 дней.
На ESMO 2023 представлены результаты первого запланированного анализа данных из исследования. При медиане наблюдения 17,9 мес. по результатам исследования на момент анализа медиана ВБП не была достигнута ни в одной из групп исследования, 2-летняя ВБП составила 67,8% в группе пембролизумаба и 57,3% в группе плацебо (HR 0,70; 95% ДИ 0,55-0,89; p=0,002), различия были достоверными в соответствии с планом статистического анализа данных. Результаты подгруппового анализа продемонстрировали наибольшую эффективность лечения при III-IVA стадиях опухолевого процесса (HR 0,58; 95% ДИ 0,42-0,80); в то время как при IB2-IIB (N+!) стадиях различия не были так очевидны (HR 0,91; 95% ДИ 0,61-1,31). Показатель 2-летней ОВ составил 87,2% в группе пембролизумаба и 80,8% в группе плацебо (HR 0,73; 95% ДИ 0,49-1,07) (рис.7).
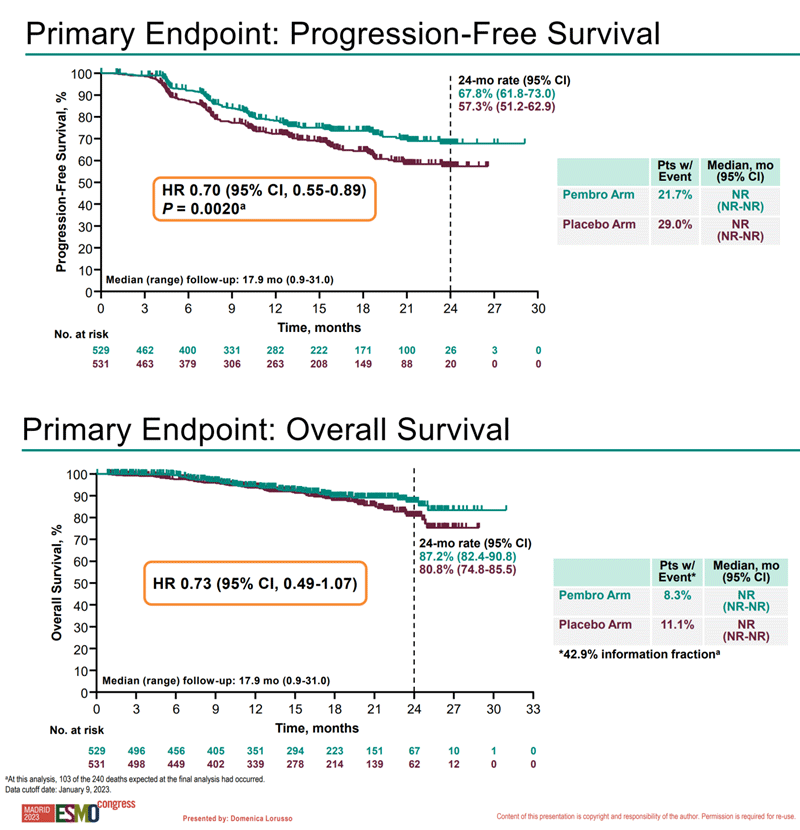
Рисунок 7. Кривые Каплана-Майера по ВБП и ОВ пациенток в исследовании KEYNOTE-A18.
LBA38 – Pembrolizumab plus chemoradiotherapy for high-risk locally advanced cervical cancer: A randomized, double-blind, phase III ENGOT-cx11/GOG-3047/KEYNOTE-A18 study.
Эффективность PARP-ингибитора сенапариба в поддерживающей терапии при раке яичников – рандомизированное исследование III фазы
В плацебо-контролируемом исследовании FLAMES изучалась эффективность нового PARP-ингибитора из Китая в первой линии терапии распространенного (III-IV стадии) серозного или эндометриоидного рака яичников высокой степени злокачественности. Включались пациентки с полным или частичным ответов на первую линию платиносодержащей химиотерапии. Рандомизация – 1:1 в группу сенапариба 100 мг 1 раз в сутки или группу плацебо, стратификация – в соответствии с ответом на первую линию терапии (полный vs частичный ответ) и статусом генов BRCA1/2. Первичной конечной точкой исследования была выбрана ВБП пациенток. Дизайн исследования – на рисунке 8.
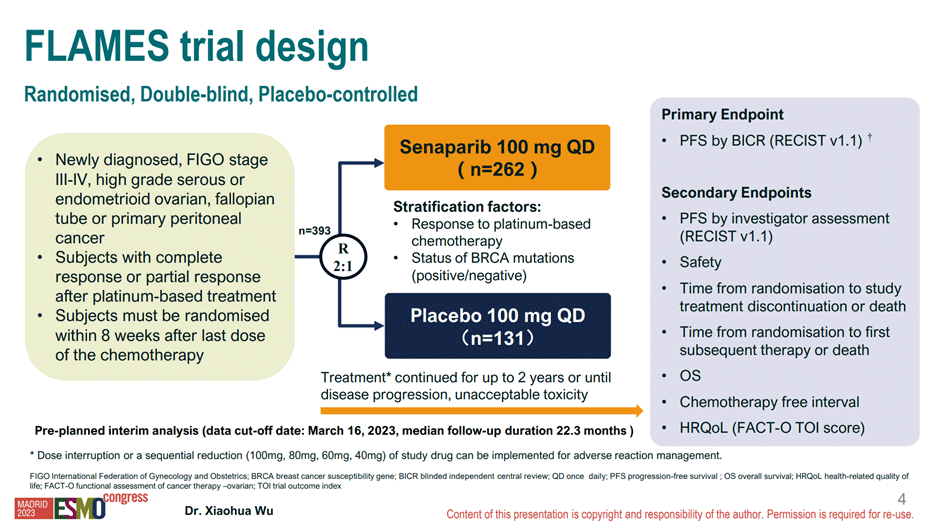
Рисунок 8. Дизайн исследования FLAMES.
Всего в исследование были включены 393 пациентки, первичные циторедукции были выполнены у 50% пациенток, наличие резидуальной опухоли после хирургического лечения отмечалось у 20% пациенток; патогенные мутации в генах BRCA1/2 были выявлены у 65% пациенток. По результатам исследования при медиане наблюдения 22,3 мес. медиана ВБП не была достигнута в группе сенапариба и составила 13,6 мес. в группе плацебо (HR 0,43; 95% ДИ 0,32-0,58; p<0,0001). Пожалуй, самая интересная часть исследования – отсутствие достоверных различий в эффективности терапии между группой BRCA-мутированных пациенток и в группе пациенток с «диким» типом этих генов. Кривые Каплана-Майера представлены на рисунке 9.
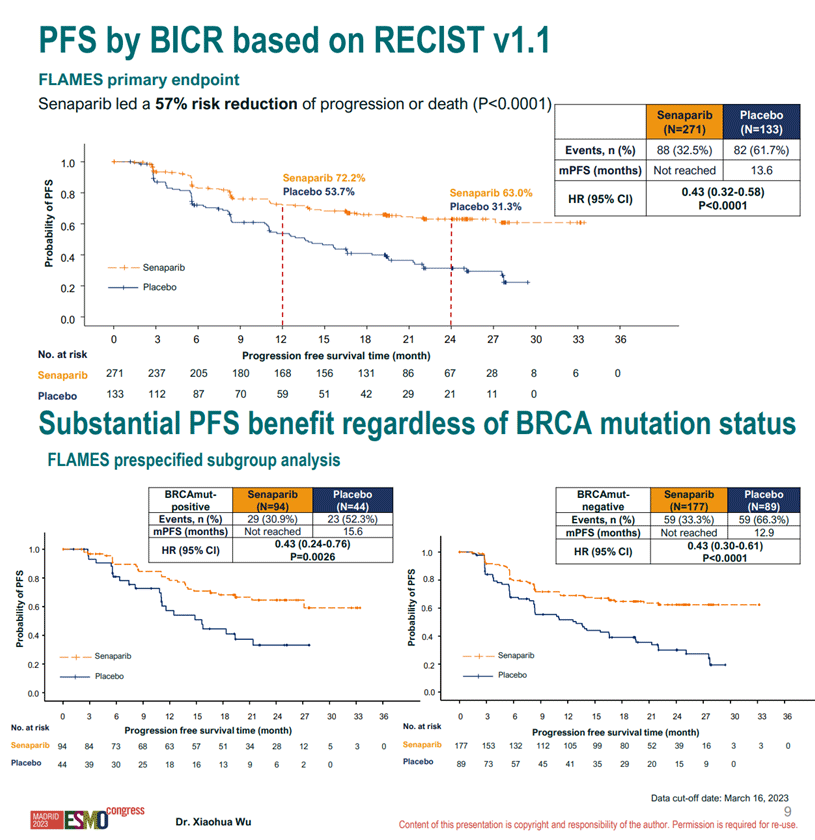
Рисунок 9. Кривые Каплана-Майера по ВБП пациенток в исследовании FLAMES.
В то же время некоторые вопросы вызывает профиль безопасности препарата: сенапариб выглядит более токсичным в сравнении с другими ингибиторами PARP, например, олапарибом (рис.10).
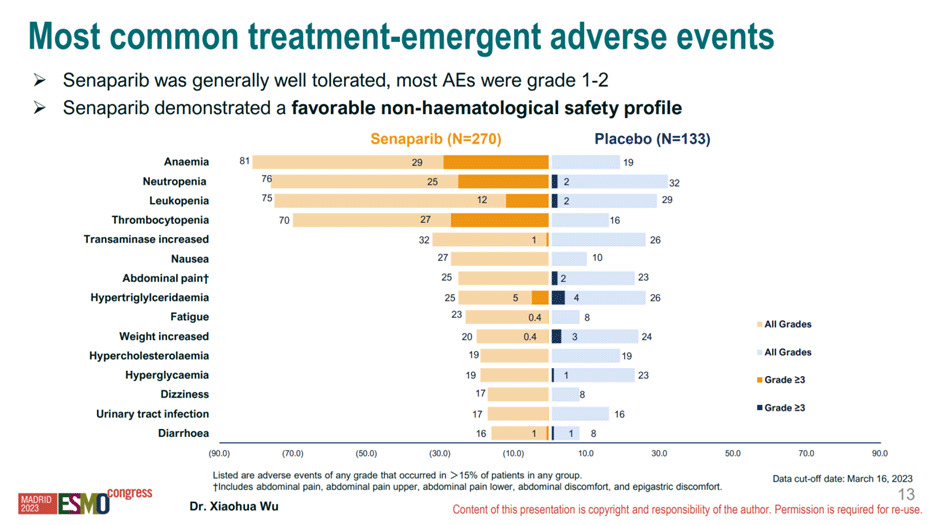
Рисунок 10. Профиль безопасности сенапариба.
LBA36 – Efficacy and safety of senaparib as maintenance treatment in patients with newly diagnosed advanced ovarian cancer (FLAMES study): A randomized, double-blind, placebo-controlled, phase III trial.
Персонализированная (или не очень) терапия при «редких» злокачественных опухолях яичников – первые результаты исследования BOUQUET
В рамках этого многорукавного нерандомизированного исследования изучаются различные варианты молекулярно-направленной терапии при редких разновидностях злокачественных новообразований яичников. Включаются пациентки с low-grade опухолями яичников, светлоклеточным раком, муцинозными опухолями, карциносаркомами и другими подтипами рака яичников, ранее получившие 1-4 линии системной терапии. Всем пациенткам выполняется тест F1CDx, после чего они распределяются по когортам (n=20 для каждой с возможностью расширения когорты до 50 пациенток). Всего здесь есть 11 когорт пациенток в зависимости от найденных мишеней для терапии – дизайн исследования представлен на рисунке 11. Сейчас нам показали результаты лечения в 2 из них: когорта кобиметиниба для пациенток с активирующими мутациями BRAF/KRAS/NRAS или мутациями NF1, а также когорта атезолизумаба/
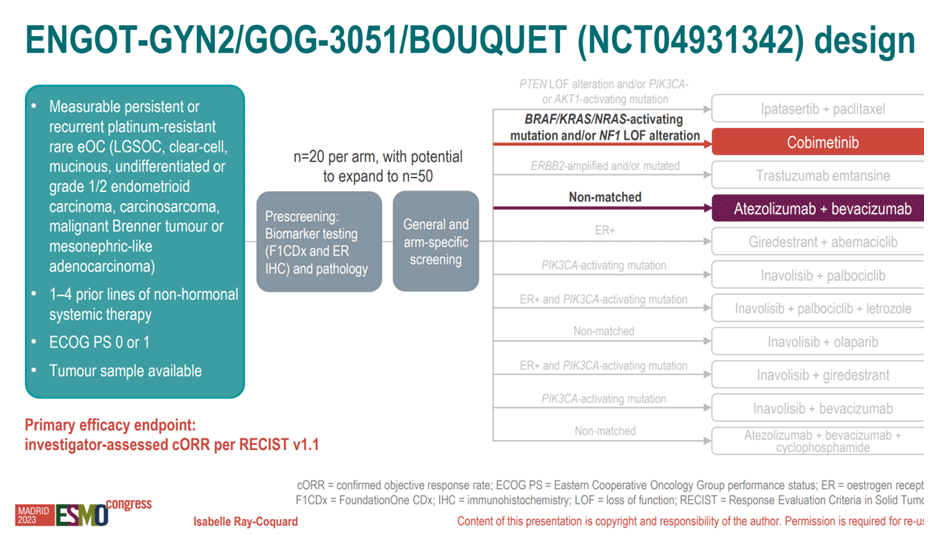
Рисунок 11. Дизайн исследования BOUQUET.
Полученные результаты выглядят следующим образом. Когорта кобиметиниба (n=20) – медиана наблюдения 6,9 мес., 65% пациенток ранее получили >3 линий терапии, у 8 пациенток были low-grade опухоли. По результатам – объективный ответ у 3 пациенток (19%), при этом наибольшая эффективность отмечена при low-grade опухолях (рис.12).
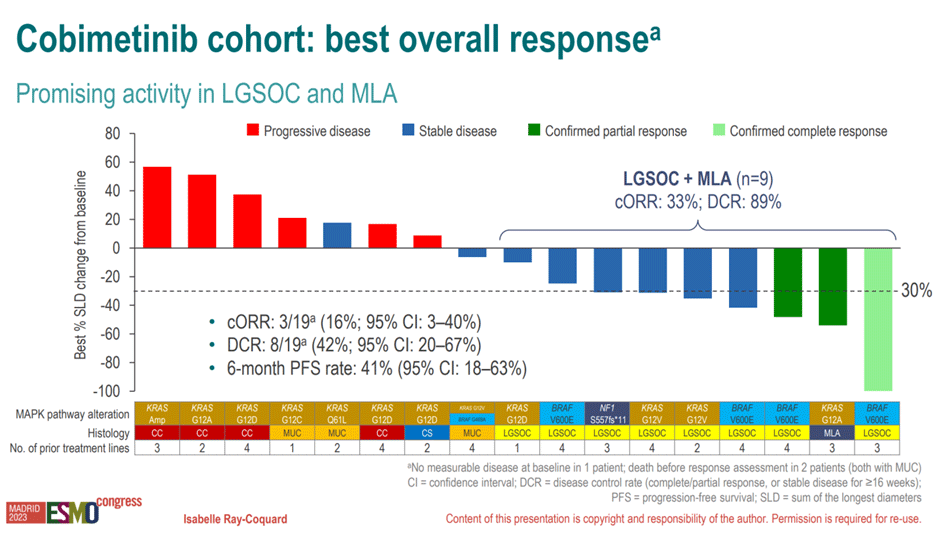
Рисунок 12. Частота объективного ответа в когорте кобиметиниба в исследовании BOUQUET.
В когорте атезолизумаба/
747MO – First results from the ENGOT-GYN2/GOG-3051/BOUQUET phase II biomarker-directed platform study: Cobimetinib (cobi) or atezolizumab (atezo) + bevacizumab (bev) for persistent/recurrent rare epithelial ovarian cancer (eOC).
Повторюсь, конгресс был очень продуктивным на представление новых работ – был представлен и ряд других интересных исследований в области лечения онкогинекологических заболеваний.