28.09.2023
В сентябрьском номере журнала The Lancet Gastroenterology and Hepatology были опубликованы отдаленные результаты уже многим известного крупного мультицентрического (24 европейских страны-участницы) рандомизированного исследования 3 фазы Neo-AEGIS. Оно напрямую касалось одной из давних нерешенных проблем торакальной онкологии – неоадъювантного лечения местнораспространенных аденокарцином пищевода и эзофаго-гастрального перехода (ЭГП). Оптимальный подход в лечении этой категории пациентов пока не определен, в большинстве рекомендаций показано проведение неоадъювантного химиолучевого лечения с последующей радикальной операцией. Без сомнения, пройти весь сложный тримодальный путь, чреватый немалым процентом осложнений, вплоть до летальных, под силу далеко не всем пациентам. Но нужен ли столь токсичный подход всем пациентам с аденокарциномой этой локализации?
Исследование Neo-AEGIS (также известное как CTRIAL-IE 10-14) было разработано после публикации исследования CROSS с основной целью напрямую сравнить результаты лечения по тримодальному протоколу CROSS (лучевая терапия на фоне ПХТ с карбоплатином/
В период с 24 января 2013 г. по 23 декабря 2020 г. было рандомизировано 377 пациентов, из которых 362 были включены в intention-to-treat анализ (327 [90%] мужчин и 360 [99%] белых):
Исследование завершилось преждевременно в декабре 2020 года после второго промежуточного анализа (после фиксирования 143 смертей) с учетом схожих показателей выживаемости и воздействия пандемии COVID-19. Все пациенты имели первичные аденокарциномы пищевода T2-3N0-3 и ЭГП I, II и III типов по Siewert, стадированные по ПЭТ-КТ и методом эндоскопического ультразвукового исследования. Первичной конечной точкой была общая выживаемость, оцениваемая у всех случайно выбранных пациентов, получивших хотя бы одну дозу исследуемого препарата, независимо от того, какой исследуемый препарат они получали по протоколу. Вторичными конечными точками были безрецидивная выживаемость, локализация рецидива, послеоперационные осложнения, токсичность, патологический ответ (полный [ypT0N0] и большой [степень регрессии опухоли 1 и 2]), частота резекции R0 и качество жизни.
При медиане наблюдения 38,8 мес. (16,3-55,1) медиана общей выживаемости составила 48,0 мес. (95% ДИ 33,6-64,8) в группе периоперационной химиотерапии и 49,2 мес. (34,8-74,4) в группе тримодальной терапии (3-летняя общая выживаемость 55% [95% ДИ 47-62] против 57% [49-64]; отношение рисков 1,03 [95% ДИ 0,77-1,38]). Медиана безрецидивной выживаемости составила 32,4 мес. (95% ДИ 22,8-64,8) в группе периоперационной химиотерапии и 24,0 мес. (18,0-40,8) в группе тримодальной терапии (отношение рисков 0,89 [95% ДИ 0,68-1,17]) (рис.1). Характер рецидивов, локорегиональный или системный, достоверно не отличался (отношение рисков 1,35 [95% ДИ 0,63-2,91], p=0,44). Патологический полный ответ (4% в группе ХТ и 12% в группе ХЛТ, отношение шансов 0,33 [95% ДИ 0,14-0,81], p=0,012), наибольший патологический ответ (0,21 [0,12-0,38], p<0,0001) и показатели R0 резекций (0,21 [0,08-0,53], p=0,0003) все же оказались в пользу тримодальной терапии.
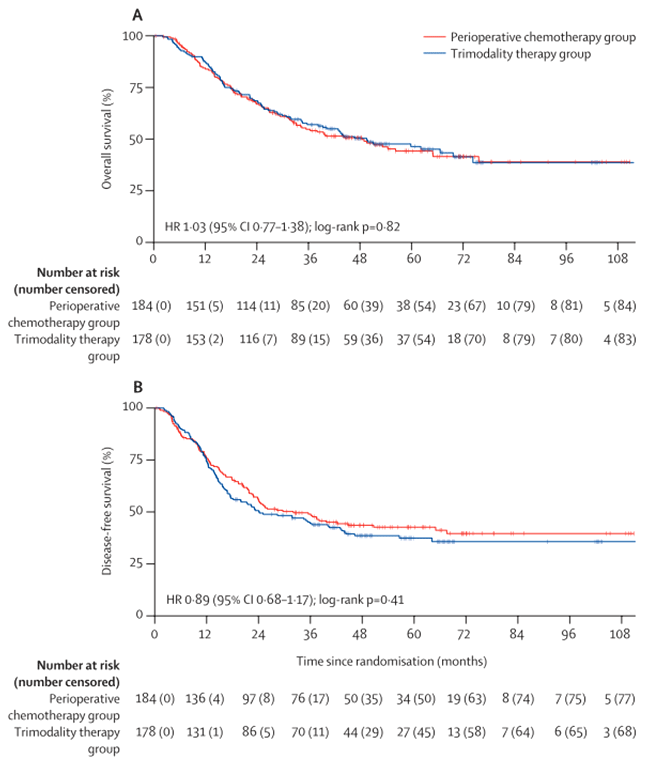
Рисунок 1. Кривые общей и безрецидивной выживаемости в группах.
Наиболее частым нежелательным явлением 3-4 степени была нейтропения (49 [27%] из 183 пациентов в группе периоперационной химиотерапии против 11 [6%] из 178 пациентов в группе тримодальной терапии), за которой следовали диарея (20 [11%]) против 0%) и легочная эмболия (по 5%). Один (1%) пациент в группе периоперационной химиотерапии и три (2%) пациента в группе тримодальной терапии умерли от серьезных нежелательных явлений, у двоих (по одному в каждой группе) причины, возможно, были связаны с лечением. Никаких различий не наблюдалось в операционной смертности (пять [3%] смертей в группе периоперационной химиотерапии против четырех [2%] в группе тримодальной терапии) или общем состоянии здоровья через 1 и 3 года.
Подгрупповой анализ показал, что, пожалуй, более возрастные и ослабленные пациенты без явных признаков поражения регионарных лимфоузлов больше подходят для тримодального лечения, тогда как остальным показана более интенсивная системная терапия с целью улучшения показателей выживаемости (рис.2).
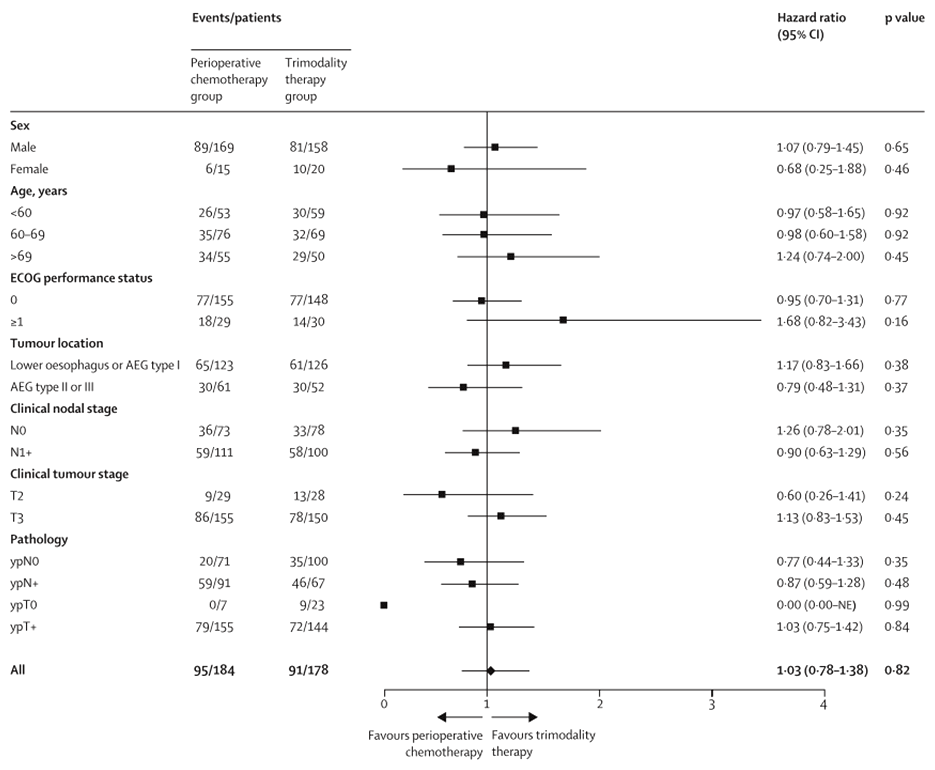
Рисунок 2. Подгрупповой анализ общей выживаемости по данным исследования.
Несмотря на недостаточную полноту данных, Neo-AEGIS предоставляет собой, пожалуй, крупнейшее рандомизированное исследование по аденокарциноме пищевода и пищеводно-желудочного перехода, получавших периоперационную химиотерапию (преимущественно модифицированный режим MAGIC) и тримодальную терапию CROSS, демонстрируя схожую 3-летнюю выживаемость и отсутствие принципиальных различий в последствиях оперативного этапа и общем качестве жизни. Авторы предполагают, что эти данные подтверждают сохранение клинического равновесия при использовании двух упомянутых подходов.
Источник: Reynolds JV, Preston SR, O'Neill B, Lowery MA, Baeksgaard L, Crosby T, Cunningham M, Cuffe S, Griffiths GO, Parker I, Risumlund SL, Roy R, Falk S, Hanna GB, Bartlett FR, Alvarez-Iglesias A, Achiam MP, Nilsson M, Piessen G, Ravi N, O'Toole D, Johnston C, McDermott RS, Turkington RC, Wahed S, Sothi S, Ford H, Wadley MS, Power D; Neo-AEGIS Investigators and Trial Group. Trimodality therapy versus perioperative chemotherapy in the management of locally advanced adenocarcinoma of the oesophagus and oesophagogastric junction (Neo-AEGIS): an open-label, randomised, phase 3 trial. Lancet Gastroenterol Hepatol. 2023 Sep 18; S2468-1253(23)00243-1. doi: 10.1016/S2468-1253(23)00243-1. Epub ahead of print. PMID: 37734399.