30.08.2023

То, о чем многие онкологи говорили на протяжении нескольких лет, начинает получать подтверждение.
Для начала вспомним глубочайший скепсис в отношении роли SBRT (стереотаксической лучевой терапии) в лечении больных ранним раком легкого: какое неимоверное количество ретроспективных (!) анализов демонстрировало «бесперспективность» метода для тех больных, которые могли быть прооперированы, но отказывались от операции в пользу консервативного метода лечения. Вспомним, как медленно шел набор в исследования, пытавшиеся подтвердить адекватность метода SBRT. Как профессору из MDACC Joe Chang это удалось на основании данных пролонгированного исследования STARS по сравнению результатов SBRT и радикальной лобэктомии при раннем раке легкого [1]. Статистически достоверный, явный, пусть и упорно не признаваемый многими успех не может кануть в небытие. Новый этап в лечении больных ранним раком легкого – комбинация SBRT и иммунотерапии, изучаемая в настоящее время многими исследователями, – начинает давать плоды.
Июльский номер журнала The Lancet Oncology включил публикацию профессора Chang, которая собрала немало комплиментов и персональных поздравлений известных онкологов в социальных сетях и, вне всякого сомнения, будет не раз цитирована в статьях и презентациях [2].
Итак, в настоящее время SBRT, или SABR, является предпочтительным вариантом лечения для тех, кто признан неоперабельным по медицинским показаниям, или для отказавшихся от операции, а также для пациентов с изолированным паренхиматозным поражением легкого. Регулярно появляющиеся данные указывают на то, что лучевая терапия и иммунотерапия могут иметь синергический эффект, особенно если биологически эффективные дозы лучевой терапии достаточно высоки (≥100 Гр). Аблативная лучевая терапия способна превратить так называемые «холодные» опухоли в радиочувствительные за счет эффекта «вакцина in situ» – за счет увеличения высвобождаемых опухолеассоциированных антигенов, повышающих экспрессию PD-L1, активацию Т-лимфоцитов, направленных на опухолевые очаги, не только явные, но и латентные (микрометастазы). Преимущества иммунотерапии как самостоятельного метода в лечении НМРЛ, так и в качестве неоадъювантной терапии были продемонстрированы рядом исследований. Идея комбинации SBRT как эффективного метода локального воздействия, синергичного с лекарственной терапией и иммунотерапией, лежала на поверхности, и в настоящее время не менее десятка проспективных рандомизированных исследований занимается изучением этой проблемы. В целях уменьшения риска рецидивов и улучшения результатов после SABR для больных, ранее не получавших лечения на ранней стадии НМРЛ, первичного или в виде изолированного паренхиматозного рецидива, а также подтверждения теоретического преимущества сочетания SABR с иммунотерапией (I-SABR), авторы из MDACC провели рандомизированное исследование 2 фазы по сравнению только SABR и I-SABR у данной категории больных.
Пациенты в возрасте 18 лет и старше, в статусе ECOG 0-2 балла и способные получать ниволумаб, с патоморфологически подтвержденным НМРЛ ранних стадий, которые не могли или не хотели оперироваться, включались в исследование. Ранняя стадия заболевания была определена как стадия IA-IB (размер опухоли ≤4 см, N0M0), стадия IIA (размер опухоли ≤5 см, N0M0) или стадия IIB (размер опухоли >5 см и ≤7 см, N0M0) в соответствии с последней классификацией.
Первая доза ниволумаба для группы I-SABR (480 мг внутривенной инфузии) совпадала с первой фракцией SABR или в течение 36 часов после первой фракции и повторялась каждые 4 недели (±1 неделя), в общей сложности – четыре запланированных цикла. Режим SABR составлял 50 Гр на планируемый объем с одновременным интегрированным бустом на опухоль до 60 Гр в случае периферических или центральных очагов, если ограничения доза-объем для критических органов позволяли это. При всех других центральных поражениях подводились десять фракций в общей дозе 70 Гр, при возможности – с одновременным бустом до 80 Гр, если ограничения доза-объем были соблюдены.
Первичной конечной точкой была 4-летняя бессобытийная выживаемость для пациентов, получавших лечение по протоколу.
В итоге с 30 июня 2017 г. по 22 марта 2022 г. 156 больных были случайным образом распределены в одну из двух групп, и 141 пациент из 19 стран получили лечение по протоколу (n=75 в группе SABR, n=66 в группе I-SABR) в трех разных больницах штата Техас, США. Достоверных различий по возрасту, полу, состоянию, работоспособности, гистологии опухоли, размеру опухоли, статусу курения или наличию рецидива/первичной опухоли между двумя группами не было. Средний период от первоначального диагноза до рецидива составил 46,4 мес. (диапазон 15,6-111,1 мес.). Следует отметить, что 32 участника были потенциальными кандидатами на хирургическое вмешательство, но они отказались от операции и были включены в исследование (16 – в группе I-SABR и 16 – в группе SABR). Медиана наблюдения составила 33 месяца.
В итоге комбинация I-SABR значительно улучшила 4-летнюю бессобытийную выживаемость с 53% (95% ДИ 42-67%) при использовании SABR до 77% (66-91%; популяция по протоколу, отношение рисков [ОР] 0,38; 95% ДИ 0,19-0,75; р=0,0056 (рис.1); для популяции ITT – HR 0,42; 95% ДИ 0,22-0,80; р=0,0080). Не было отмечено при этом нежелательных явлений 3 степени и выше, связанных с SABR. В группе I-SABR у десяти участников (15%) наблюдались иммунологические неблагоприятные явления 3 степени, связанные с ниволумабом, но ни у кого не было отмечено пневмонита 3-й степени или токсичности 4-й степени или выше.
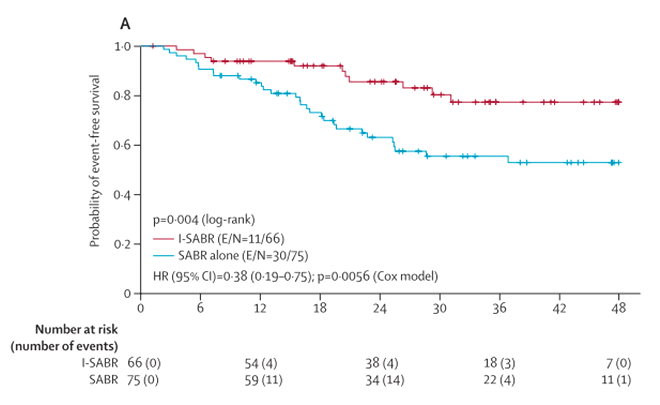
Рисунок 1. Бессобытийная выживаемость пациентов, пролеченных по протоколу, в 2 группах за 4 года.
Мультивариантный анализ с учетом ряда факторов (ECOG статус, размер опухоли, длительность истории рака легких и гистология) показал, что преимущество в бессобытийной выживаемости в группе I-SABR все еще было значительным (HR 0,36; 95% ДИ 0,18-0,74; р=0,0054).
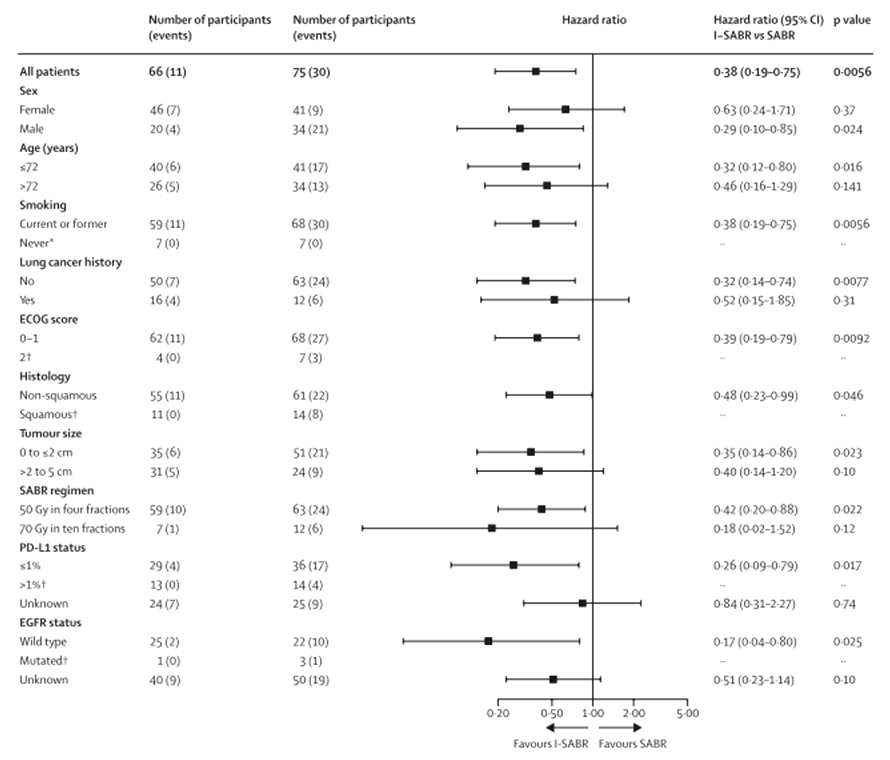
Рисунок 2. Подгрупповой анализ бессобытийной выживаемости в 2 группах.
Результаты показали значительное преимущество в бессобытийной выживаемости у участников с размером опухоли 2 см или меньше (ОР 0,35; 95% ДИ 0,14-0,86; p=0,0230). Однако для пациентов с опухолью размером более 2 см незначительная тенденция к улучшению была отмечена, но без достоверности (0,40 [0,14-1,20]; р=0,10). Не было никакого влияния объема опухоли на бессобытийную выживаемость (0,99 [0,98-1,02]; р=0,90). Кроме того, отмечено значительное улучшение показателя бессобытийной выживаемости для больных с заболеванием на ранней стадии, не получавших лечения (0,32 [0,14-0,74]; р=0,0077); однако у тех, у кого зарегистрирован изолированный паренхиматозный рецидивный НМРЛ, различий не выявлено, возможно, из-за малого числа больных (n=28; 0,52 [0,15-1,85]; p=0,31).
Рецидивы любого типа отмечены у 36% участников (27/75) в группе SABR по сравнению с 12% участников (8/66) в группе I-SABR. Местные рецидивы наблюдались у 13% (10/75) в группе SABR по сравнению с отсутствием таковых в группе I-SABR. Региональные рецидивы наблюдались у 11% (8/75) в группе SABR и 6% (4/66) в группе I-SABR, отдаленные рецидивы – в 16% (12/75) в группе SABR и в 3% (2/66) в группе I-SABR. При использовании SABR 11% (8/75) имели более одного типа рецидива (например, местный, региональный и отдаленный) по сравнению с отсутствием такой закономерности в группе I-SABR. Второй первичный рак легких наблюдался у 8% (6/75) в группе SABR и 3% (2/66) в группе I-SABR. 13 участников умерли: девять [12%] в SABR и четыре [6%] в I-SABR.
Данные о статусе экспрессии PD-L1 были доступны для 92 больных (65%) и данные о статусе мутации EGFR – у 51 участников (36%). При анализе преимущество бессобытийной выживаемости для больных группы I-SABR было более выражено у участников с PD-L1-положительными опухолями, ни у одного из этих участников не развился рецидив (0/15 I-SABR против 5/16 SABR). Однако выигрыш в бессобытийной выживаемости при I-SABR также был статистически значимым и у PD-L1-отрицательных пациентов (n=61; ОР 0,27; 95% ДИ 0,09-0,81; p=0,012).
Таким образом, это рандомизированное исследование фазы 2 показало, что для пациентов с впервые диагностированной ранней стадией НМРЛ или изолированным паренхиматозным рецидивом НМРЛ I-SABR значительно улучшает бессобытийную выживаемость и может стать вариантом лечения для таких пациентов. Результаты нескольких продолжающихся исследований фазы 3 подтвердят выводы, представленные профессором Chang и соавторами. А пока они собирают комплименты от коллег-онкологов со всего мира, мы ждем 3 фазу исследования и отдаленные результаты, прежде всего – общей выживаемости.
Источники: