17.07.2023

В июне 2023 года прошел очередной ежегодный конгресс ASCO 2023. Огромное количество новостей из мира онкоурологии. В этом небольшом материале постараемся рассказать о наиболее практически значимых из них.
ddMVAC – новый стандарт неоадъювантной химиотерапии мышечно-инвазивного рака мочевого пузыря
На ASCO 2023 представлены финальные данные рандомизированного исследования III фазы VESPER (n=500) по изучению эффективности режима ddMVAC в периоперационной терапии уротелиального рака. Включались цисплатин-подходящие пациенты с мышечно-инвазивным раком и рандомизировались в соотношении 1:1 в группу гемцитабина 1250 мг/м2 день 1, 8 в сочетании с цисплатином 70 мг/м2 день 1 (GC) каждые 21 день или в группе ddMVAC (метотрексат 30 мг/м2 день 1, винбластин 3 мг/м2 день 2, доксорубицин 30 мг/м2 день 2, цисплатин 70 мг/м2 день 2) с поддержкой Г-КСФ [1,2]. Медиана наблюдения на момент представления данных составила 5 лет.
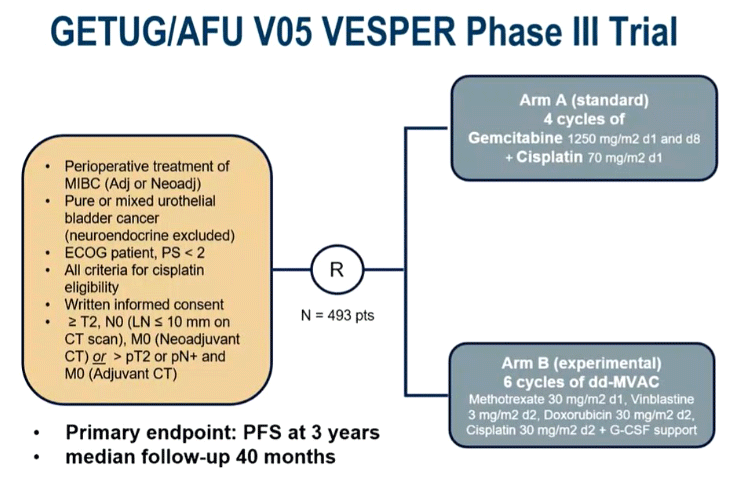
Рисунок 1. Дизайн исследования VESPER.
По результатам исследования показатель 5-летней общей выживаемости (ОВ) в общей популяции этого исследования составил 64% в группе ddMVAC и 56% в группе GC (HR 0,77; p=0,078), а среди пациентов, получавших лечение в неоадъювантном режиме (n=437), – 66% и 57% соответственно (HR 0,71; p=0,032). Также было отмечено достоверное увеличение опухоль-специфической выживаемости в общей популяции исследования (72% и 59%; HR 0,63; p=0,004) и в неоадъювантной подгруппе (75% и 60%; HR 0,56; p=0,001).
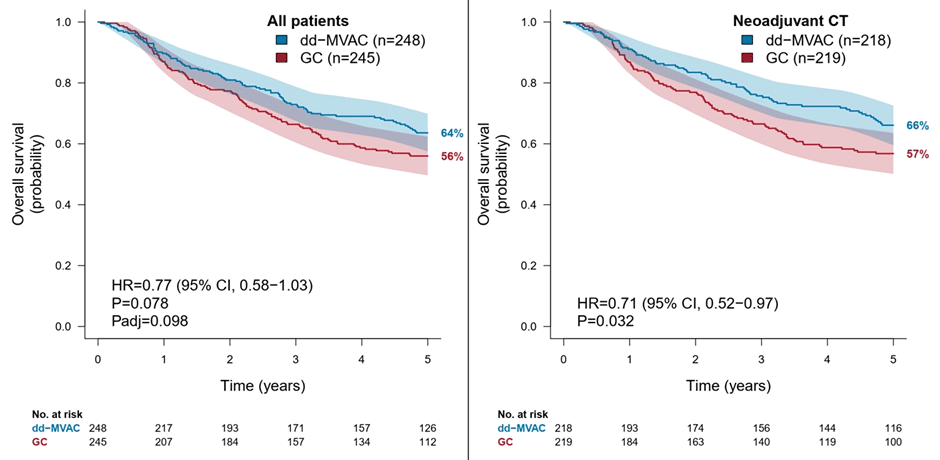
Рисунок 2. Общая выживаемость пациентов в исследовании VESPER.
Переносимости исследуемого режима лечения была удовлетворительной. Весь запланированный объем лечения получили 66% и 58% пациентов в группе GC (4 курса) и группе ddMVAC (6 курсов) соответственно. Данные по частоте развития наиболее частых нежелательных явлений представлены в диаграмме ниже (рис.3).
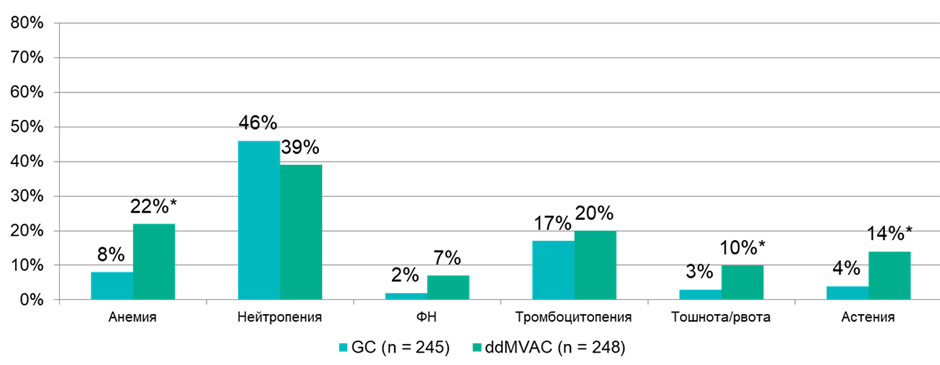
Рисунок 3. Частота развития наиболее распространенных нежелательных явлений в исследовании VESPER.
* – статистически значимые различия.
Финальные результаты VESPER подтверждают высокую эффективность режима ddMVAC в неоадъюванте мышечно-инвазивного рака мочевого пузыря. Несколько портит идеальную картину тот факт, что за счет небольшого количества включенных «адъювантных» пациентов различия по ОВ в общей популяции исследования не достигли статистической достоверности, но это вряд ли должно влиять на общую интерпретацию результатов исследования.
Эрдафитиниб в лечении FGFRalt метастатического рака мочевого пузыря: исследование III фазы THOR
Исследование III фазы THOR (n=266) – сравнение эффективности селективного FGFRi эрдафитиниба и стандартной химиотерапии во 2-3 линии терапии уротелиального рака (доцетаксел или винфлунин) [3]. На ASCO 2023 представлены результаты когорты 1 данного исследования, в которую включались пациенты, ранее получившие PD-1/PD-L1 антагонисты. Первичная конечная точка достигнута: медиана ОВ составила 12,1 мес. в группе эрдафитиниба по сравнению с 7,8 мес. в группе химиотерапии (HR 0,64; p=0,005). Медиана ВБП составила 5,6 и 2,7 мес. соответственно (HR 0,58; p=0,0002). В подгрупповом анализе – наибольшая эффективность в отношении ОВ при опухолях верхних отделов мочевыводящих путей (HR 0,34; 95% ДИ 0,18-0,64). RR – 45,6% против 11,5%.
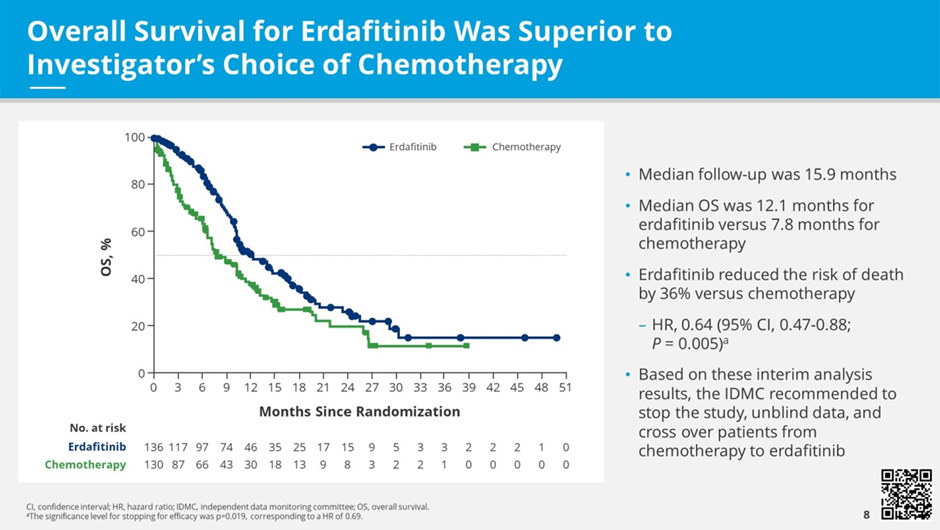
Рисунок 4. Общая выживаемость в исследовании THOR.
В подгрупповом анализе нельзя не обратить внимание на результаты применения препаратов в подгруппе больных с опухолями верхних и нижних отделов мочевыводящих путей – именно в последней подгруппе была отмечена наиболее высокая эффективность исследуемого препарата, медиана ОВ в группе эрдафитиниба составила 23,3 мес. по сравнению с 7,2 мес. в контрольной группе (HR 0,34; 95% ДИ 0,18-0,64), в то время как среди пациентов с опухолями нижних отделов достоверных различий отмечено не было (медиана 10,5 и 9,6 мес.; HR 0,82; 95% ДИ 0,56-1,18).
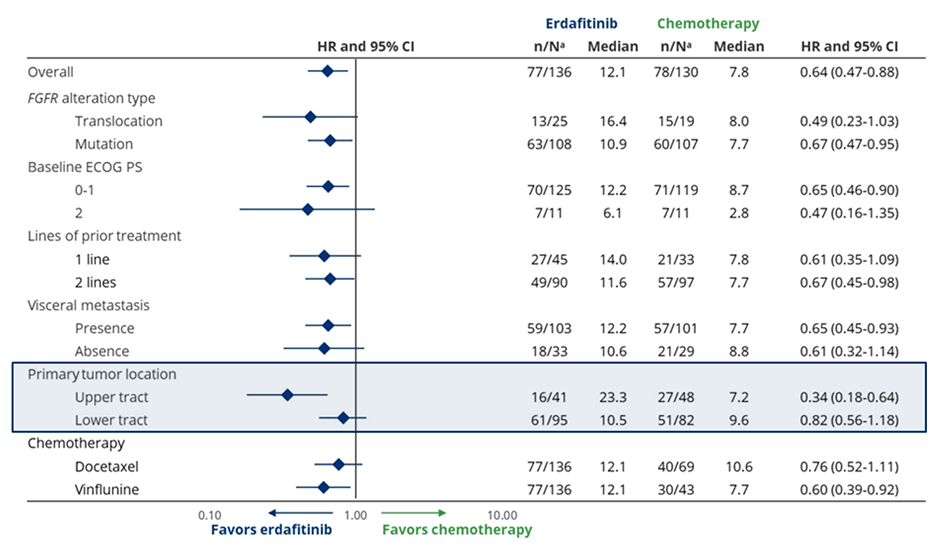
Рисунок 5. Подгрупповой анализ эффективности терапии в исследовании THOR.
Пембролизумаб/
Представлены финальные результаты по общей выживаемости из рандомизированного исследования III фазы CLEAR (n=712) – сравнение комбинации ленватиниба/
Различия в ОВ пациентов между группами остаются достоверными, но в первую очередь – за счет предотвращения «ранних» смертей, видимо, в первую очередь за счет тех пациентов, у которых значительная распространенность опухолевого процесса представляет собой значимую угрозу. Дополнительные подгрупповые анализы ОВ продемонстрировали отсутствие различий в эффективности терапии среди пациентов с благоприятным прогнозом (HR 0,94; 95% ДИ 0,58-1,52) и снижение риска смерти при неблагоприятном/
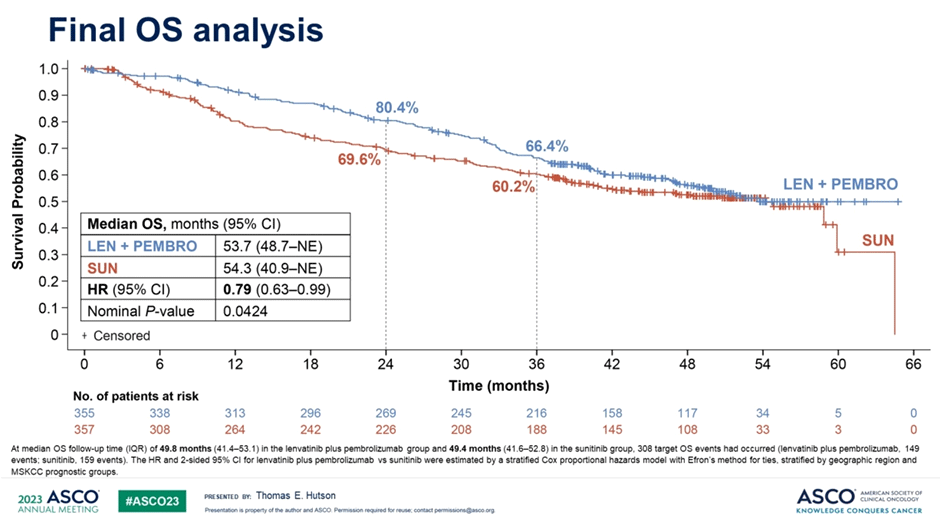
Рисунок 6. Общая выживаемость в исследовании CLEAR.
Ожидаемо, что между группами был выявлен серьезный дисбаланс с точки зрения последующего применения иммунотерапевтических агентов – 15% в группе комбинации и 55% в группе сунитиниба. Могло ли большее количество терапевтических опций во 2+ линиях обеспечить постепенное уменьшение различий в рисках смерти? Конечно! Исследователи дополнительно продемонстрировали данные по ОВ пациентов с поправкой на последующие линии терапии – в этом анализе медиана ОВ не была достигнута в группе ленватиниба/пембролизумаба и составила 32 мес. в группе сунитиниба (HR 0,55; 95% ДИ 0,44-0,69).
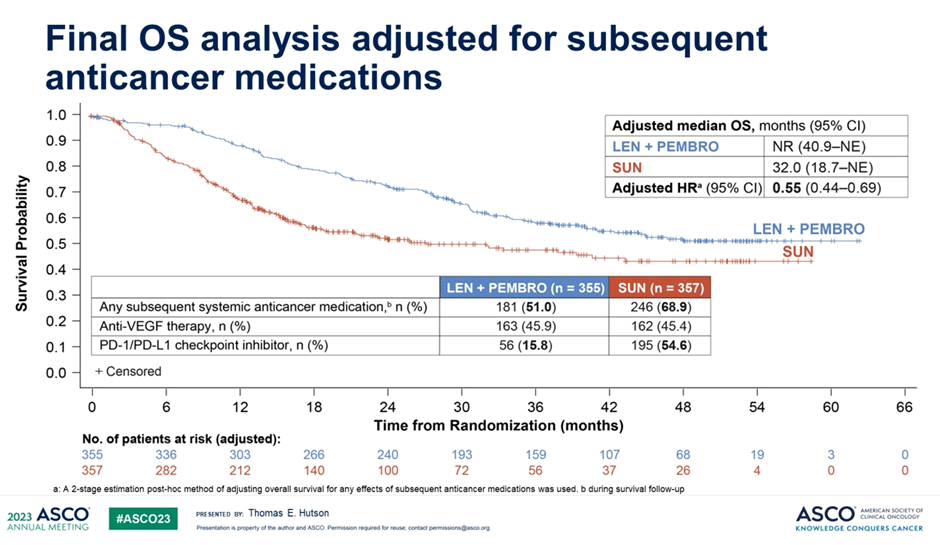
Рисунок 7. Общая выживаемость в исследовании CLEAR с поправкой на последующую терапию.
При этом группа благоприятного прогноза достоверно выигрывала с точки зрения другой ключевой конечной точки – медианы ВБП, здесь медиана ВБП составила 28,6 мес. в группе комбинации и 12,9 мес. в контрольной группе (HR 0,50; 95% ДИ 0,35-0,71), в группе промежуточного или неблагоприятного прогноза данные показатели составили 22,1 и 5,9 мес. соответственно (HR 0,43; 95% ДИ 0,34-0,55).
Одновременно с CLEAR представлены результаты 5-летнего наблюдения из исследования III фазы KEYNOTE-426 (n=801) – пембролизумаб/
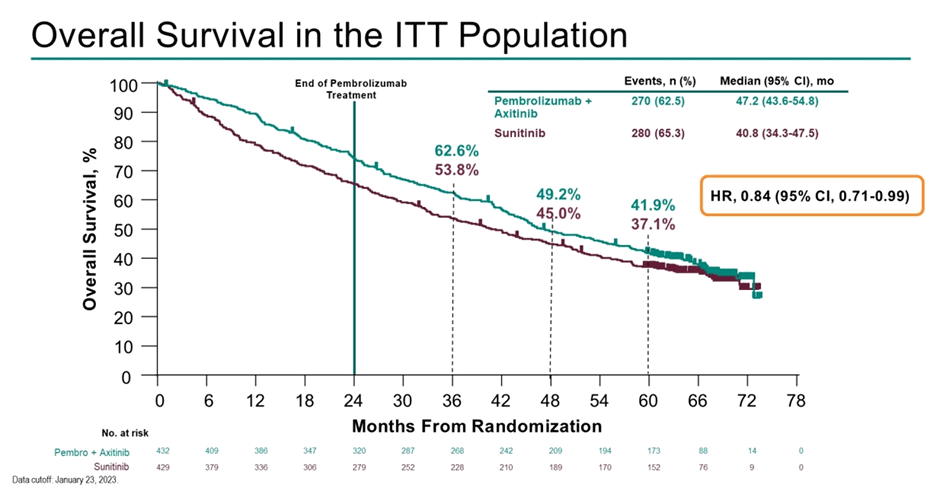
Рисунок 8. Общая выживаемость в исследовании KEYNOTE-426.
Медиана наблюдения на момент публикации текущих данных составляет 67 мес. По результатам – медиана ВБП составляет 15,7 мес. в группе пембролизумаба/
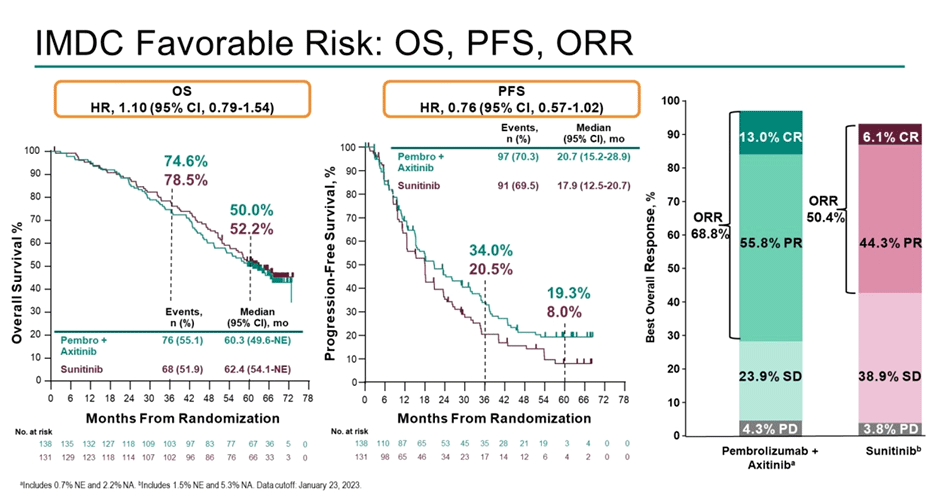
Рисунок 9. Результаты лечения благоприятной прогностической группы в исследовании KEYNOTE-426.
Как и в CLEAR, исследователи из KEYNOTE-426 решили проверить гипотезу о влиянии последующей терапии на общую выживаемость пациентов – и опять последующую иммунотерапию получили 27% из группы комбинации и 80% из контрольной группы. Проведен анализ общей выживаемости с поправкой на последующую терапию – достоверный выигрыш в пользу комбинации (HR 0,67; 95% ДИ 0,52-0,84).
Таким образом, среди пациентов благоприятной прогностической группы назначение интенсифицированной терапии не позволяет увеличить общую выживаемость пациентов – за счет наличия эффективных опций последующей терапии для этих больных. Интересно, будут ли учтены новые данные в следующей версии клинических рекомендаций.
Несветлоклеточный рак почки: пембролизумаб/
Представлены результаты исследования KEYNOTE-B61, которое, возможно, изменит нашу практику лечения несветлоклеточных подтипов рака почки [6]. Нерандомизированное исследование II фазы, первая линия терапии, один рукав, режим лечения – пембролизумаб 200 мг в/в капельно день 1 + ленватиниб 20 мг ежедневно, каждые 21 день. В исследовании приняло участие 158 пациентов, медиана наблюдения составила 14,9 мес. По результатам исследования объективный ответ на терапию отмечен у 78 (49%) пациентов:
Медиана ВБП составила 18 мес., а показатель 12-месячной ВБП – 63%. Медиана общей выживаемости не достигнута, 1-летняя ОВ – 82%. Скоро узнаем, приведут ли эти данные к тому, что мы начнем лечить рак почки комбинацией пембролизумаба и ленватиниба вне зависимости от гистологического подтипа опухоли.
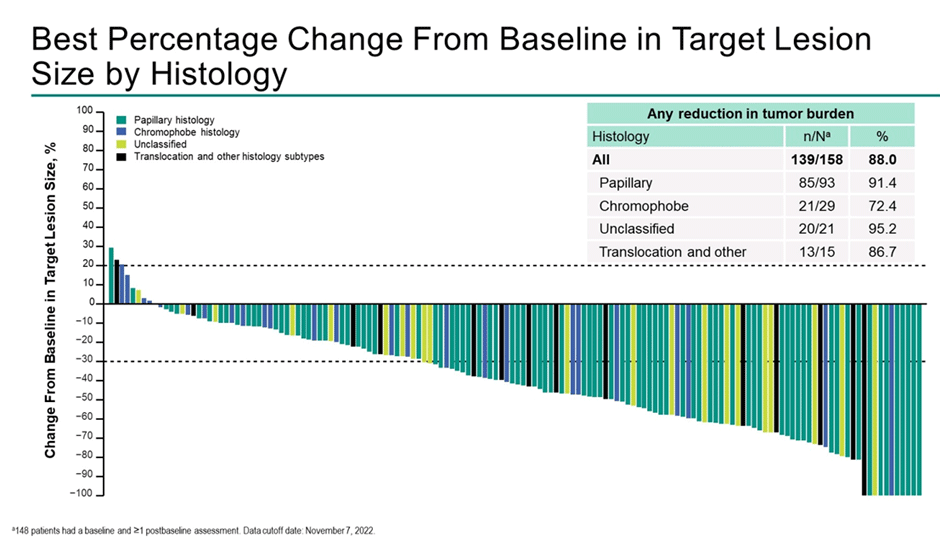
Рисунок 10. Waterfall plot по частоте и выраженности объективных ответов на терапию пембролизумабом и ленватинибом.
В этом же контексте можно упомянуть еще одно исследование – ретроспективную работу по лечению несветлоклеточного рака почки, проведенную с помощью анализа базы данных IMDC (n=532). Авторы работы сфокусировали свое внимание на проблеме лечения несветлоклеточного рака почки с саркоматоидными чертами опухоли и эффективности применения иммуноонкологических режимов лечения в данной категории пациентов. По результатам исследования у пациентов с саркоматоидными подтипами опухоли применение иммуноонкологических режимов лечения позволяло достоверно повысить частоту объективного ответа на терапию (34,5% против 10,9% на фоне монотерапии анти-VEGF препаратами; p=0,006), а также общую выживаемость пациентов (медиана не достигнута против 7,0 мес.; p<0,0001), в то же время среди пациентов без саркоматоидных черт опухоли эффективность иммуноонкологических режимов не отличалась от монотерапии анти-VEGF препаратами [7]. Перефразируя слова советского плаката – «Требуйте указания наличия или отсутствия саркоматоидных черт в опухоли!».
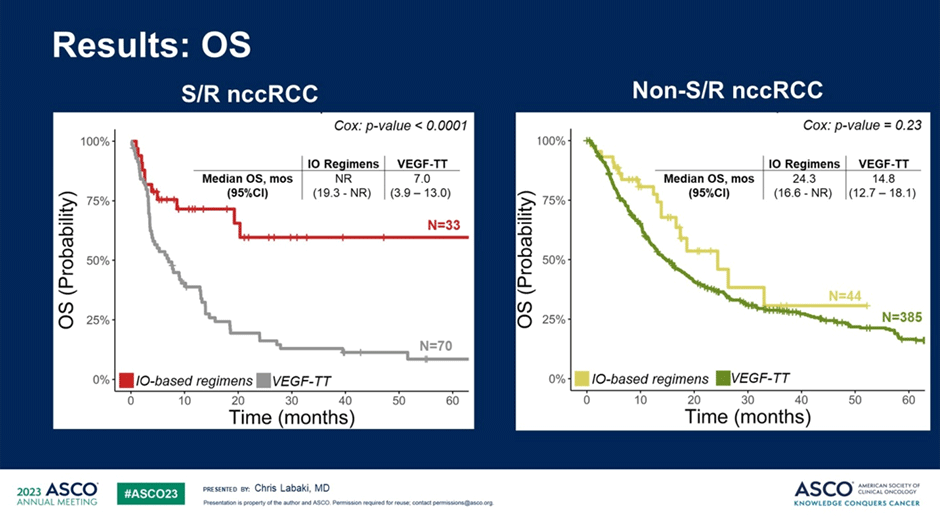
Рисунок 11. Общая выживаемость пациентов с несветлоклеточными подтипами рака почки в зависимости от наличия или отсутствия саркоматоидной дифференцировки опухоли и варианта терапии.
Низкие дозы ниволумаба в лечении рака почки: ретроспектива из Индии
Иммунотерапия давно и прочно обосновалась в лечении метастатического рака почки; например, в соответствии с клиническими рекомендациями RUSSCO комбинации иммуноонкологических и таргетных препаратов – стандарт лечения пациентов в любой прогностической группе. Очень широко этот метод лечения применяется и при других онкологических заболеваниях – и завоевывает все новые позиции. В виде короткого абстракта наши коллеги из Индии опубликовали результаты ретроспективного исследования (n=58) по оценке эффективности низких доз ниволумаба при лечении рака почки. Исследование не было рандомизированным – те пациенты, кто мог себе позволить получить ниволумаб в полной дозе, получали его в полной дозе (n=27), те, кто не мог, – в различных режимах дозирования начиная с 40 мг каждые 2 недели (n=26). Большинство пациентов (81%) получали ниволумаб в первой линии терапии, наиболее часто используемыми ингибиторами тирозинкиназ были ленватиниб (47%) и кабозантиниб (34%). По результатам – достоверных различий в медиане ВБП между группами пациентов выявлено не было (17 мес. в группе низкой дозы ниволумаба и 21 мес. в группе высокой дозы; p=0,75), в то же время медиана ОВ была несколько выше в группе низкой дозы (не достигнута и 21 мес. соответственно; p=0,017) [8].
Конечно, это исследование обладает массой ограничений: сумбурный дизайн, ретроспективный характер, небольшой размер выборки и так далее. Но – оно чуть-чуть добавляет данных к той доказательной базе, что используемые в настоящее время дозы иммунотерпевтических агентов завышены и, проведя соответствующие исследования, мы сможем получить «большее за меньшее» и повысить доступность иммунотерапии.
Кабозантиниб после прогрессирования рака почки на фоне иммунотерапии: исследование реальной клинической практики
Heng D. и коллеги представили в виде постерного доклада результаты исследования реальной клинической практики по оценке эффективности терапии кабозантинибом и другими тирозинкиназными ингибиторами (акситиниб, пазопаниб, сунитиниб, ленватиниб + эверолимус) после прогрессирования рака почки на фоне ранее проведенной иммунотерапии (ниволумаб/ипилимумаб, ниволумаб или пембролизумаб). Крупное ретроспективное исследование – включено 783 пациента. По результатам исследования применение кабозантиниба достоверно улучшало ответ на терапию – 62,5% по сравнению с 46,0% в контрольной группе (p=0,0002), но не влияло на общую выживаемость (медиана ОВ 19,2 и 19,1 мес.; HR 1,05; p=0,735) и оказывало только пограничное влияние на время до начала следующей линии терапии (будем считать суррогатом для ВБП). Достаточно существенные различия в частоте ответа, но которые не транслировались в выживаемость пациентов, – не проясняют оптимальные подходы к лечению, но могут быть важны для тех, у кого есть симптомы опухолевого процесса.
Лучевая терапия на первичную опухоль при de novo метастатическом раке предстательной железы с малым объемом метастатического поражения: новые данные из PEACE-1
Представлены новые данные из рандомизированного исследования III фазы PEACE-1. Ранее из этой работы мы узнали об эффективности «триплета» АДТ, доцетаксела и абиратерона при de novo метастатическом раке предстательной железы, сейчас нам представили результаты второй предзапланированной первичной конечной точки – оценить влияние облучения первичной опухоли на общую выживаемость пациентов. Дизайн исследования и подходы к его статистическому анализу были специально спланированы для оценки этого аспекта лечения. В исследовании приняло участие 1172 пациента, медиана наблюдения составила 6,1 лет [9].
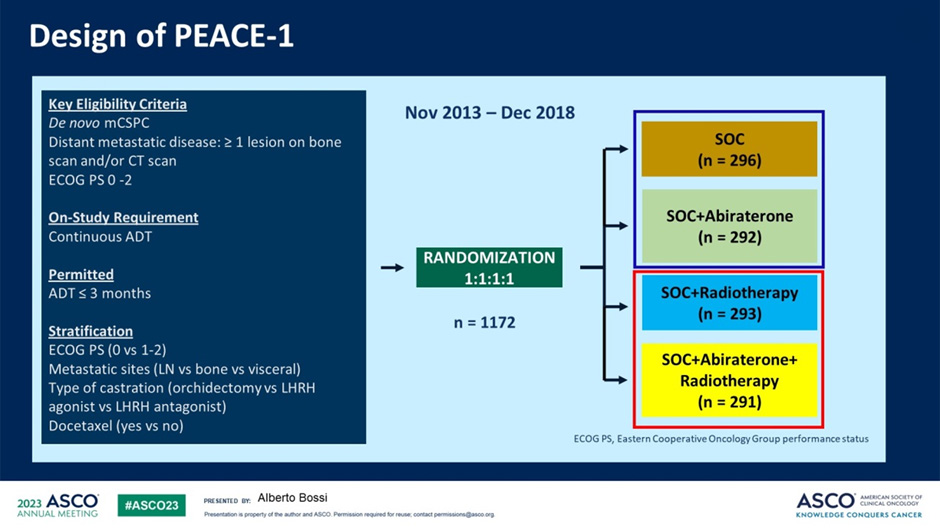
Рисунок 12. Дизайн исследования PEACE-1.
Что в результате? Проведение лучевой терапии на первичную опухоль у пациентов не смогло улучшить результаты лечения пациентов, медиана ОВ составила 6,9 лет в группе без лучевой терапии и 7,5 лет в группе с ее проведением (HR 0,98; p=0,86). Дополнительно были проанализированы результаты лечения в зависимости от применения абиратерона: группа пациентов, получавших АДТ + абиратерон + лучевую терапию, характеризовалась наилучшими результатами выживаемости по сравнению с остальными подгруппами пациентов, однако различия в сравнении с группой абиратерона не достигли статистической достоверности (HR 0,81; p=0,29).
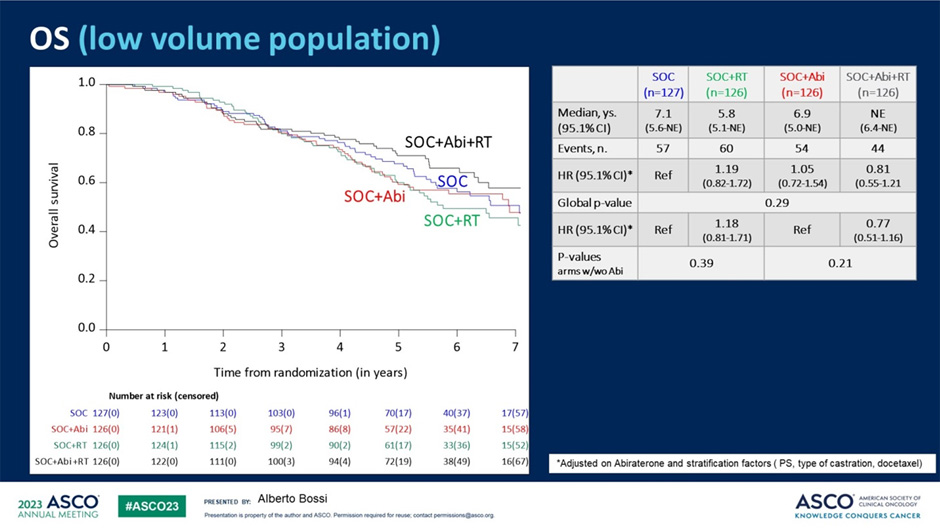
Рисунок 13. Общая выживаемость в различных подгруппах исследования PEACE-1.
В то же время облучение первичной опухоли достоверно увеличивало время до развития серьезных нежелательных явлений со стороны мочеполовой системы по сравнению с пациентами, которые не получали данный вид лечения (p=0,0006). На мой взгляд, это можно имплементировать в рутинную клиническую практику следующим образом: если у пациента малый объем метастатического поражения и первичная опухоль бессимптомная и не угрожает их появлением на момент начала лечения – проведение лучевой терапии нецелесообразно, в остальных случаях – пользуемся.
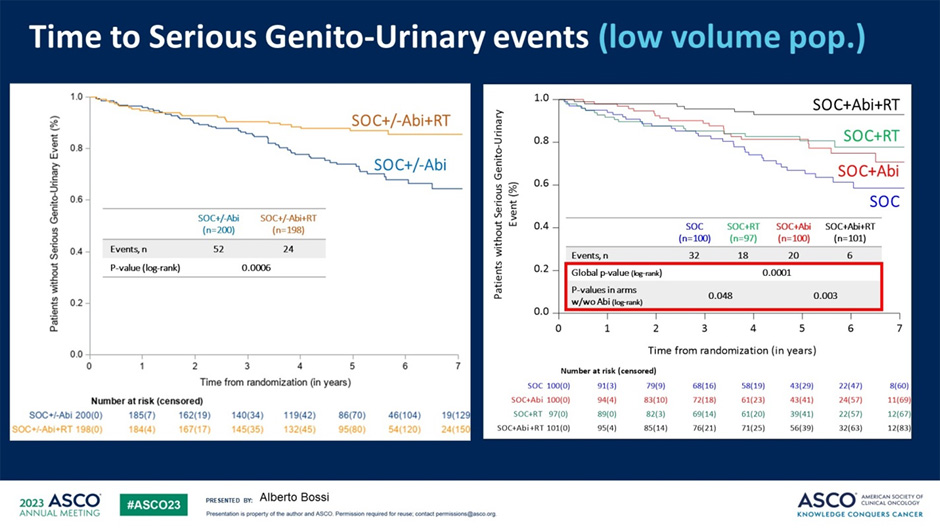
Рисунок 14. Время до развития серьезных нежелательных явлений со стороны первичной опухоли в зависимости от проведения лучевой терапии.
Источники: