04.06.2023
Во второй день конгресса обсуждались предикторы иммунного ответа при метастатическом РМЖ. Применение иммунотерапии при мРМЖ в настоящее время ограничено первой линией лечения PD-L1-позитивного трижды негативного подтипа. Мультиомиксное изучение характеристик противоракового иммунного ответа при мРМЖ нацелено на понимание механизмов, лежащих в основе недостаточности иммунного ответа. Представлено несколько исследований по изучению опухоль-инфильтрирующих лимфоцитов (или TILs) в первичной опухоли и отдаленных метастазах, оценена корреляция с показателями выживаемости.
В исследование AURORA (NCT02102165) включались больные, получившие хотя бы одну линию химиотерапии по поводу метастатической болезни. На образцах первичной и метастатической опухоли выполнялось секвенирование РНК, оценка TILs, анализировались рецепторы Т-клеток и В-клеток (TCR и BCR).
Ожидаемо отмечено снижение уровня TILs в метастатических очагах по сравнению с первичной опухолью, исключением стали очаги в легких, где уровень TILs достоверно не снижался. В 9% наблюдений отмечено сохранение уровня TILs выше 20% в метастатическом очаге. В таких образцах было больше Treg-клеток (p<0,001) и B-клеток (p<0,001) по сравнению с метастазами с низким уровнем TILs, в которых было больше Th1-клеток (p<0,001), тучных клеток (p<0,001) и NKT (р<0,001).
Высокий уровень TILs в метастатическом очаге ассоциировался со значимым увеличением продолжительности жизни при трижды негативном подтипе, отмечена аналогичная тенденция для HER2-позитивного подтипа (рис.1).
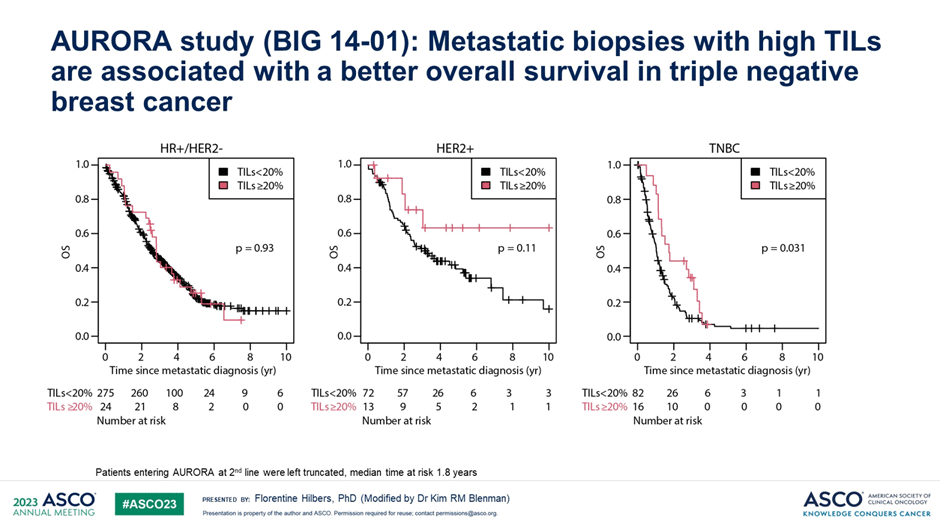
Рисунок 1. Корреляция уровня TILs в метастатическом очаге с общей выживаемостью при различных подтипах РМЖ.
Схожие результаты получены в post-hoc поданализе исследования CALGB (Alliance, III фаза), оценившем уровень TILs в первичной опухоли и метастатических очагах больных, получавших I линию терапии по поводу мРМЖ (бевацизумаб в комбинации с паклитакселом, наб-паклитакселом или иксабепилоном).
Уровень TILs в метастатических очагах был ниже по сравнению с таковым в ткани первичной опухоли. Низкий уровень TILs (<5%) ассоциировался со значимым снижением показателей выживаемости без прогрессирования (HR 1,34; 95% ДИ 1,1-1,63; p=0,004) и общей выживаемости (HR 1,32; 95% ДИ 1,07-1,63; p=0,009), независимо от режима терапии (рис.2).

Рисунок 2. Post-hoc анализ исследования CALGB (Alliance, III фаза). Показатели выживаемости в зависимости от уровня TILs.
Продолжаются поиски путей преодоления резистентности к иммунотерапии. В доклинических исследованиях онколитический реовирус Pelareorep способствовал развитию воспалительного микроокружения опухоли (TME), способствуя большей инфильтрации опухолью инфильтрирующих лимфоцитов и усиливая экспрессию PD-1/PD-L1, потенциально повышая эффективность блокады иммунных контрольных точек. Целью исследования 2 фазы BRACELET-1 (рис.3) была частота объективных ответов (ЧОО) на 16-й неделе терапии больных HR+ HER2- мРМЖ, ранее получавших эндокринотерапию ± химиотерапию. Токсичность, выживаемость без прогрессирования (ВБП) и общая выживаемость были вторичными конечными точками.
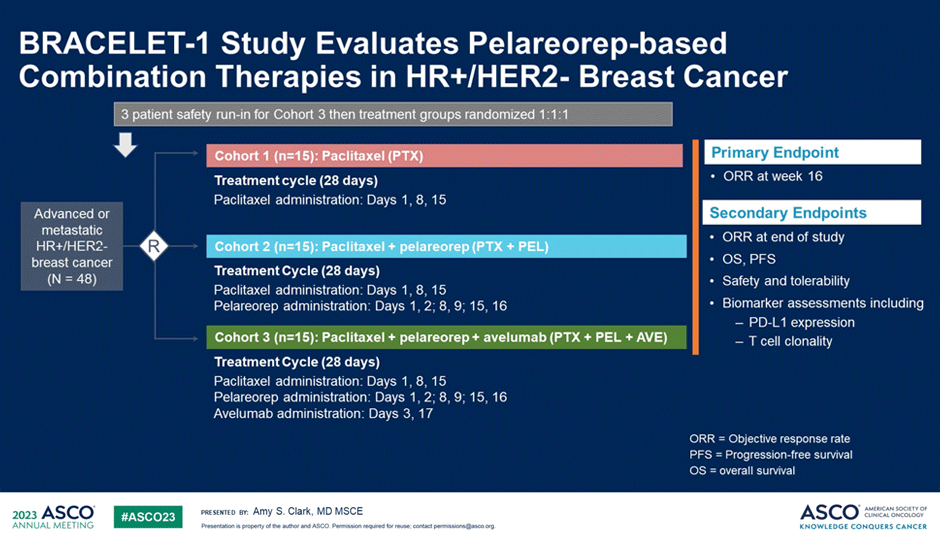
Рисунок 3. Дизайн исследование BRACELET-1.
Пациенты рандомизировались в 3 когорты в соотношении 1:1:1 в группу только паклитаксела (когорта 1), паклитаксел + пелареореп (когорта 2) или паклитаксел + пелареореп + авелумаб (когорта 3). Наилучшие показатели ЧОО на 16 неделе терапии отмечены в когорте 2 (паклитаксел + пелареореп) (рис.4).
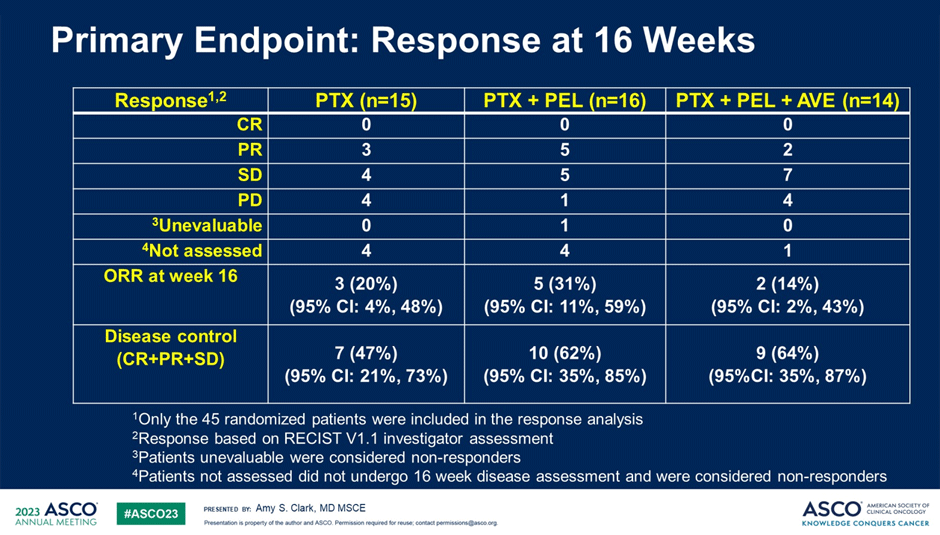
Рисунок 4. Результаты исследования BRACELET-1.
Наиболее частыми нежелательными явлениями, связанными с Pelareorep, были лихорадка, озноб и гриппоподобные инфузионные реакции, которые в части наблюдений потребовали госпитализации (15%) пациентов. Девять пациентов (33%) прекратили прием пелареорепа и 6 (35%) прекратили прием авелумаба из-за токсичности. Pelareorep увеличил репертуар Т-клеток с идентификацией и расширением новых и ранее существовавших клонов Т-клеток за счет C2D1.
Авторы делают вывод, что добавление пелареорепа к ПТ является активной схемой с высокой 6-месячной ВБП, заслуживающей дальнейшего изучения. Треть пациентов прекратили прием пелареорепа или авелумаба из-за токсичности, что подчеркивает необходимость тщательной поддерживающей терапии.
Источники: