23.05.2023
Миксоидная липосаркома (МЛС) представляет собой подтип саркомы мягких тканей (МТС), который характеризуется специфическими генетическими транслокациями, продуцирующими транскрипты слияния FUS-DDIT3 или, реже, EWSR1-DDIT3. Местные рецидивы возникают в 10-20% случаев, в то время как отдаленные метастазы могут развиваться в 30-60% случаев даже через несколько лет после постановки первоначального диагноза, с преимущественным поражением мягких тканей и костей, не легких. Гистологически пациенты с опухолями, гиперклеточность которых превышает 5%, считаются подверженными высокому риску развития отдаленных метастазов и смерти от этого заболевания. В отличие от других подтипов липосаркомы (например, дедифференцированной липосаркомы), MЛС более чувствительны к классической химиотерапии первой линии с антрациклинами, а также проявляют чувствительность к трабектедину, который действует как таргетный препарат, преодолевая блок липогенной дифференцировки клеток, обусловленный транслокацией хромосом опухоли.
Эти характеристики привели к старту исследования по неоадъювантной терапии трабектедином при местнораспространенной МЛС, которое показало частоту ответа 24% [1]. В этом исследовании пациенты с МТС высокого риска были до операции рандомизированы для получения либо антрациклина и ифосфамида, либо химиотерапии, адаптированной к гистотипу, а для пациентов с MЛС химиотерапия с учетом гистотипа трабектедином показала те же результаты, что и после антрациклинов с ифосфамидом.
Кроме того, миксоидная липосаркома обладает более высокой радиочувствительностью, чем все другие МТС. Действительно, лучевая терапия (ЛТ) часто используется на предоперационном этапе с целью уменьшения опухоли и обеспечения адекватных хирургических условий. Более того, некоторые доклинические данные о синергической активности показали, что трабектедин проявляет радиочувствительность, являясь синхронизатором клеточного цикла, вызывая блокаду S-фазы и торможение клеток в G2/M фазах клеточного цикла, наиболее чувствительными к лучевой терапии.
По этим причинам комбинация трабектедина и ЛТ при МЛС кажется логичной и заслуживающей изучения, что побудило инициирование европейского исследования по изучению эффективности подобной комбинации. Данные фазы 1 исследования уже были опубликованы [2], показав благоприятный профиль безопасности при комбинации трабектедина в дозе 1,5 мг/м2 и ЛТ (45 Гр) за 25 фракций в подгруппе из 14 пациентов с местнораспространенной операбельной МЛС.
Международное открытое нерандомизированное клиническое исследование 2 фазы [3], недавно опубликованное в журнале JAMA Oncology, с участием 46 пациентов с миксоидной липосаркомой, проводилось в 4 центрах в Испании, 1 в Италии и 2 во Франции с 1 июля 2016 года по 30 сентября 2019 года. Все пациенты имели гистологический, централизованно подтвержденный диагноз локализованной резектабельной миксоидной липосаркомы конечности или туловища.
Трабектедин вводили в дозе, рекомендованной по результатам фазы 1 (1,5 мг/м2), внутривенно в течение 24 часов каждые 21 день, всего 3 цикла. Лучевую терапию начинали после завершения первой инфузии трабектедина (цикл 1, день 2). Пациенты получали 25 фракций облучения общей дозой 45 Гр. Операцию планировали через 3-4 недели после введения последнего предоперационного цикла и не раньше, чем через 4 недели после окончания предоперационной ЛТ.
Основной целью исследования был общий ответ на лечение. Вторичными конечными точками были безрецидивная выживаемость и патоморфологический ответ.
Всего было включено 46 пациентов. Четыре пациента не подлежали оценке. Средний возраст составлял 43 года (диапазон 18-77 лет). В целом, 9 из 41 больных (22%) достигли частичного ответа после неоадъювантной терапии трабектедином и ЛТ, при этом 5 из 39 пациентов (13%) достигли полного патоморфологического ответа и 20 из 39 пациентов (51%) имели 10% или менее от жизнеспособной оставшейся опухоли. Частичный ответ в соответствии с критериями Choi наблюдался у 24 из 29 поддающихся оценке пациентов (83%), и ни у одного пациента не было прогрессирования заболевания. Лечение переносилось хорошо.
При медиане наблюдения 37 месяцев (диапазон 16-62 месяца) ни один пациент не умер, тогда как у 7 из 42 был зарегистрирован рецидив заболевания. Среднее время до рецидива составило 15 месяцев (диапазон от 8 до 51 месяца). Из этих пациентов у 1 из 7 возник местный рецидив, а у 6 из 7 развились отдаленные метастазы. Соответствующая 4-летняя общая выживаемость составила 100%, тогда как безрецидивная выживаемость составила 84% (95% ДИ 73-96%) (рис.1).
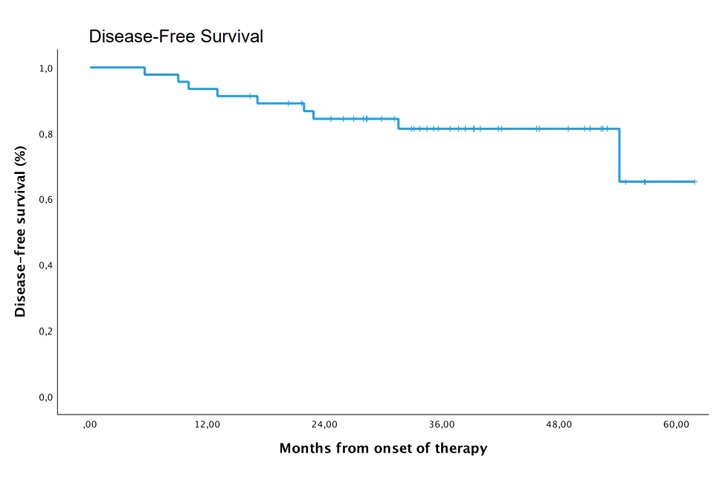
Рисунок 1. Выживаемость без прогрессирования за 4 года по данным исследования [3].
Хотя первичная конечная точка этого нерандомизированного клинического исследования фазы 2 не была достигнута (общий ответ при солидных опухолях у ≥70% пациентов), результаты показывают, что эта комбинация хорошо переносилась и явилась весьма эффективной с точки зрения развития патоморфологического ответа. Таким образом, комбинация трабектедина и ЛТ может стать хорошей в лечении подобных больных, прежде всего в плане переносимости.
Источники: