28.04.2023
Европейский конгресс по раку легкого (ELCC 2023), состоявшийся 29.03-01.04.2023 в Копенгагене, был организован ведущими междисциплинарными обществами в области торакальной онкологии с целью продвижения научных знаний, обучения и повышения квалификации специалистов по раку легких во всем мире. В этом кратком обзоре мы представим ряд интересных данных, продемонстрированных на конгрессе.
Либтайо превосходит только химиотерапию в терапии первой линии местнораспространенного НМРЛ
На конгрессе ELCC 2023 последние результаты исследований EMPOWER-Lung 1 и EMPOWER-Lung 3 показали, что Либтайо (цемиплимаб) продолжает демонстрировать явную и длительную эффективность в качестве иммунотерапии для поздних стадий НМРЛ без драйверных мутаций.
Новые данные ретроспективного анализа международного исследования фазы III EMPOWER-Lung 1 (NCT03088540) показали, что Либтайо в первой линии в сочетании с химиотерапией улучшил общую выживаемость (ОВ) и выживаемость без прогрессирования заболевания (ВБП) по сравнению с химиотерапией, выбранной исследователем, у пациентов с PD-L1-положительным метастатическим НМРЛ с метастазами в головном мозге.
Этот крупнейший анализ, проведенный на пациентах со стабильными метастазами в головной мозг, получающих монотерапию PD-1 в клинических испытаниях фазы III, предполагает, что использование Либтайо в этой популяции пациентов является предпочтительным и ставит под сомнение представление о том, что наличие метастазов в головном мозге должно исключать проведение у них иммунотерапии. EMPOWER-Lung 3 дало положительные результаты после дополнительного 12-месячного наблюдения, продемонстрировав эффективность Либтайо с химиотерапией на основе платины у пациентов с НМРЛ и любым уровнем PD-L1 [1]. FDA одобрило эту схему лечения в ноябре 2022 года для использования у взрослых больных с распространенным НМРЛ, у которых отсутствуют аберрации EGFR, ALK или ROS1, на основании предыдущих данных исследования EMPOWER-Lung 3.
Либтайо был одобрен в качестве второго ингибитора PD-1/L1 после Китруды для использования в сочетании с химиотерапией в терапии первой линии НМРЛ независимо от уровня PD-L1 или гистологии. Это дополняет его предыдущее одобрение в качестве монотерапии для пациентов с высоким уровнем экспрессии PD-L1. Однако тот факт, что его показания совпадают с показаниями к Китруде, не означает автоматически, что Либтайо будет поровну делить рынок с Китрудой, которая в настоящее время является ведущим ингибитором PD-1.
Таблица 1. Резюме расширенных анализов исследований фазы III EMPOWER-Lung 1 и EMPOWER-Lung 3.
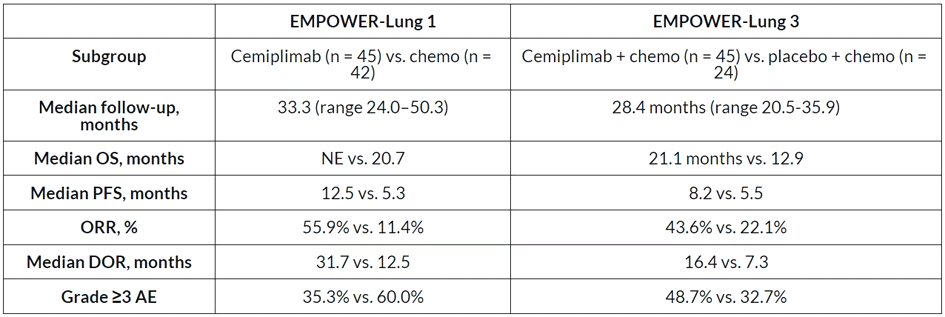
По мнению экспертов, представленные данные обнадеживают. Подтверждено, что цемиплимаб является эффективным вариантом лечения НМРЛ без целевого драйвера, и он особенно ценен, поскольку, в отличие от некоторых других ингибиторов контрольных точек, его применение включает не только метастатический НМРЛ, но и пациентов с местнораспространенным процессом, которые не могут быть полностью излечены радикальной химиолучевой терапией.
Комбинированная терапия разочаровывает: Тецентрик и Кабометикс не обеспечивают улучшение выживаемости при метастатическом НМРЛ
Пациенты с метастатическим НМРЛ, у которых наблюдается прогрессирование заболевания после лечения анти-PD-L1/PD-1 в комбинации с химиотерапией на основе препаратов платины или после нее, обычно получают монотерапию доцетакселом или пеметрекседом, что дает весьма ограниченные клинические преимущества и оставляет значительный пробел в вариантах медикаментозного лечения.
На ELCC 2023 в исследовании CONTACT-01 фазы III (NCT04471428) был представлен окончательный анализ общей выживаемости, вторичных конечных точек и безопасности. В этом исследовании сравнивали Тецентрик (атезолизумаб) плюс Кабометикс (кабозантиниб) с доцетакселом у пациентов с метастатическим НМРЛ, которые получали химиотерапию на основе препаратов платины и анти-PD (L) агентом. Основная конечная точка (ОВ) не была достигнута. Хотя PFS и DOR (продолжительность ответа) показали численные улучшения, вторичные конечные точки эффективности не продемонстрировали клинически значимых улучшений в пользу Тецентрика плюс Кабометикс.
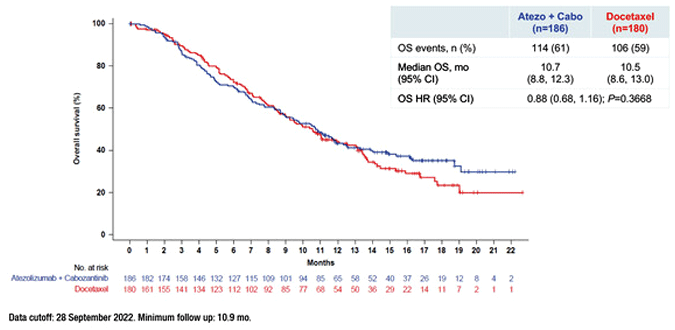
Рисунок 1. Общая выживаемость по данным исследования CONTACT-01 [2].
Таблица 2. Общие результаты исследования CONTACT-01 [2].
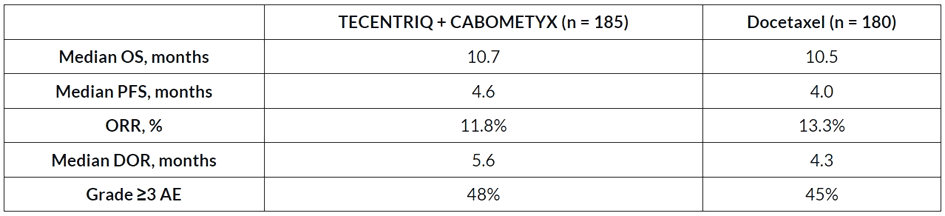
Комбинация препаратов компаний Roche и Ipsen столкнулась с трудностями в этом году, не только из-за этой недавней неудачи, но и в марте, когда Кабометикс и Тецентрик проиграли в исследовании фазы III против препарата Bayer Нексавар для лечения недавно диагностированного рака печени. Эта неудача заставила Exelixis отказаться от планов по расширению утвержденных показаний для применения Кабометикс. В качестве терапии первой линии ингибиторы иммунных контрольных точек становятся все более распространенными, но в настоящее время существует дефицит эффективных препаратов второй линии для лечения пациентов, которые не реагируют на начальную терапию. Исследование CONTACT-01 – не первое исследование фазы III, в котором не удалось достичь конечной точки выживаемости после обнадеживающих результатов испытания фазы II.
Ниволумаб в сочетании с химиотерапией в неоадъюванте дает долговременные преимущества независимо от типа хирургического вмешательства
Обновленные данные исследования III фазы CheckMate 816 (NCT02998528) показали, что неоадъювантная терапия препаратом Опдиво (ниволумаб) в сочетании с химиотерапией приводила к преимуществу в отношении долгосрочной бессобытийной выживаемости (EFS) по сравнению с монохимиотерапией у пациентов с операбельным НМРЛ, независимо от типа выполненной операции (малоинвазивная или торакотомия) или объема резекции легкого (полная или частичная).
На ELCC 2023 были представлены данные, свидетельствующие о том, что после медианы наблюдения в 41,4 мес. медиана БСВ еще не была достигнута для пациентов, получающих Опдиво в сочетании с химиотерапией, по сравнению с 21,1 мес. для пациентов, получающих только химиотерапию. Сообщалось, что 3-летняя БСВ составила 57% для пациентов, получавших Опдиво в сочетании с химиотерапией, и 43% для тех, кому проводилась только химиотерапия.
Среди пациентов, перенесших операцию, частота рецидивов составила 28% для тех, кто получал комбинацию Опдиво с химиотерапией, и 42% для тех, кто получал только химиотерапию. 4 марта 2022 г. FDA одобрило Опдиво в сочетании с двойной химиотерапией с платиной для неоадъювантного применения у взрослых пациентов с операбельным (опухоли ≥4 см или с подтвержденным поражением лимфатических узлов средостения) НМРЛ на основании более ранних данных исследования CheckMate 816. Предыдущие результаты из исследования показали, что Опдиво в сочетании с химиотерапией приводит к значительному улучшению БСВ по сравнению с одной химиотерапией.
На ежегодной конференции AACR 2022 года были представлены данные по БСВ и ОВ, которые показали, что медиана БСВ составила 31,6 мес. при применении Опдиво в сочетании с химиотерапией и 20,8 мес. при применении только химиотерапии. Исследование CheckMate 816 показало повышение БСВ, которая часто используется в качестве суррогатного показателя общей выживаемости. Это указывает на то, что возрастает вероятность реального улучшения выживаемости.
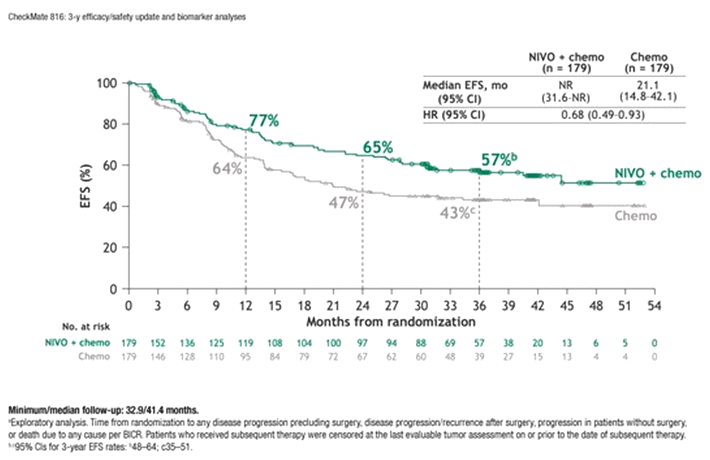
Рисунок 2. Бессобытийная выживаемость по данным исследования CheckMate 816 [3].
По мнению экспертов, важным вопросом для клинической практики остается интерпретация результатов, наблюдаемых при проведении неоадъювантной химиоиммунотерапии, использованной в CheckMate 816, и результатов, о которых вскоре будет сообщено в исследованиях фазы III нового поколения, посвященных неоадъювантной плюс адъювантной химиоиммунотерапии при операбельном НМРЛ.
Препарат Рибревант компании J&J продолжает демонстрировать эффективность при НМРЛ с мутацией EGFR в экзоне 20: долгосрочное наблюдение
ELCC 2023 года представила новые отдаленные результаты исследования CHRYSALIS [4], в котором оценивалась эффективность Рибреванта (амивантамаб) в лечении распространенного НМРЛ с мутацией EGFR в экзоне 20. В исследование были включены пациенты, у которых заболевание прогрессировало после химиотерапии на основе препаратов платины. Прошло более двух лет, как терапия нашла свое место на рынке для этой группы пациентов, поскольку Рибревант получил ускоренное одобрение FDA в мае 2021 года на основании предыдущих данных исследования CHRYSALIS, которые продемонстрировали, что препарат вызывает ORR 40% и медиана продолжительности эффекта DOR – 11,1 мес. в этой популяции больных.
При медиане наблюдения 19,2 мес. медиана ВБП при применении Рибреванта составила 6,9 мес., а показатель ВБП за 2 года – 13,7%. Медиана ОВ при приеме препарата составила 23 мес., а показатель 2-летней выживаемости – 47,2%. Более того, Рибревант показал частоту объективных ответов в 37% со средним DOR 12,5 мес. Независимо от предыдущего лечения пациента или его реакции на химиотерапию на основе платины эффективность препарата оставалась неизменной.
НМРЛ с мутациями в экзоне 20 имеет худший прогноз и худшие показатели выживаемости по сравнению с раком легкого, вызванным более распространенными мутациями EGFR, такими как делеции экзона 19 и замены L858R. Ингибиторы тирозинкиназы EGFR, которые являются стандартом лечения рака легких с распространенными мутациями EGFR, как правило, неэффективны против мутаций вставки экзона 20 и не одобрены FDA для лечения этих больных.
Рибревант и Экскивити в настоящее время являются единственными двумя препаратами, одобренными для лечения предварительно леченного НМРЛ, хотя несколько других препаратов находятся в разработке. Некоторые из них, в том числе зипалертиниб, сунвозертиниб, фурмонертиниб, BLU-451 и ORIC-114, кажутся многообещающими, при этом особый интерес представляют низкомолекулярные ингибиторы, способные проникать в центральную нервную систему. Однако необходимо определить, как эти ингибиторы можно использовать у пациентов с ранее не леченым процессом. В исследовании III фазы PAPILLON изучается эффективность комбинации Рибреванта в сочетании с химиотерапией по сравнению с монотерапией химиотерапией в первичной терапии НМРЛ с мутацией в 20 экзона EGFR.
Благодаря этим новым данным амивантамаб продемонстрировал стабильную долгосрочную эффективность независимо от предшествующей терапии или ответа на предыдущую химиотерапию препаратами платины. Из-за агрессивного характера НМРЛ с мутациями в экзоне 20 EGFR таргетная терапия является важным фактором при выборе варианта лечения для этих пациентов.
Революция в лечении НМРЛ: последние новости о мутациях KRAS G12C
KRAS G12C, подтип KRAS, который ранее считался бесперспективным для воздействия с помощью препаратов, составляет 40-45% всех мутаций KRAS у больных раком легких.
Исследование под названием EAP Study-436 [5], проведенное в шести странах, предоставило данные об использовании Лумакраса (соторасиб) у пациентов с распространенным НМРЛ с мутацией KRAS G12C в рамках программы расширенного доступа. В исследовании сообщается, что медиана общей выживаемости составила 9,5 мес. у 147 пациентов с последующим наблюдением в течение 13,6 мес. У пациентов с метастазами в ЦНС в анамнезе медиана ОВ была такой же, как и у пациентов без метастазов (9,5 мес. против 10,3 мес.).
Данные ВБП, о которых ранее сообщалось на конгрессе ESMO 2022, были сопоставимы с данными, полученными в исследовании CodeBreaK 200 с соторасибом по сравнению с доцетакселом. В исследовании также сообщалось, что у 21,1% пациентов наблюдались побочные эффекты ≥3 степени, связанные с лечением.
На ELCC 2023 в ходе анализа исследования фазы II KRYSTAL-1 изучалась потенциальная связь между устранением частоты мутационного аллеля (MAFC) и ответом на Кразати (адаграсиб) у пациентов с распространенным/метастатическим НМРЛ с мутацией KRAS G12C. Исследование показало, что пациенты с MAFC ≥90% к 4-му дню цикла 1 (C4D1), по данным анализа по циркулирующей опухолевой ДНК (цДНК), имели более высокую частоту объективного ответа по сравнению с пациентами с MAFC <90%. Пациенты с MAFC ≥90% при C4D1 также имели более длительную ВБП.
По мнению экспертов, результаты ОВ, полученные в рамках этой программы расширенного доступа, очень информативны: хотя они и не были собраны в рамках клинических испытаний, но подтверждают, что соторасиб работает и может улучшить результаты лечения подобных пациентов. Медиана ОВ впечатляет в группе больных, получавших очень интенсивное предварительное лечение, до восьми линий терапии. Кроме того, обнадеживает тот факт, что наличие метастазов в головной мозг не ограничивает эффективность соторасиба, при этом аналогичная выживаемость наблюдается у пациентов с/без метастазов в ЦНС.
Источники: