07.02.2023

C 19 по 22 января 2023 года в Сан-Франциско прошел симпозиум ASCO, посвященный терапии опухолей желудочно-кишечного тракта. Некоторые исследования, представляющие научный и практический интерес, отражены в этом сообщении.
Рак желудка и кардиоэзофагеального перехода
Комбинированный подход к терапии при локализованной аденокарциноме желудка (РЖ) и кардиоэзофагеального перехода (КЭП) в настоящий момент рассматривается начиная со стадии cT2N0-2M0. Возможными опциями являются периоперационная химиотерапия, адъювантная химиотерапия и химиолучевая терапия. В настоящий момент активно обсуждается, какой из подходов является оптимальным в той или иной клинической ситуации.
Исследование Neo-AEGIS [1] было посвящено сравнению периоперационного режима FLOT c неоадъюватной химиолучевой терапией у больных аденокарциномой пищевода и пищеводно-желудочного перехода.
В нескольких работах, в том числе в подгрупповом классическом исследовании FLOT4, была продемонстрирована прогностическая значимость таких факторов, как частота достижения ypN0, R0, pCR и степень патоморфоза. В данном исследовании назначение пациентам неоадъювантной химиолучевой терапии в сравнении с периоперационной терапией в режиме FLOT позволяло значимо увеличить частоту ypN0, R0, pCR и достижения TRG, что, однако, не повлияло на трехлетнюю ОВ (рис.1).
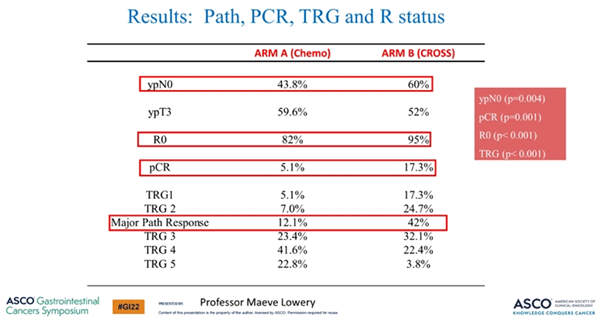
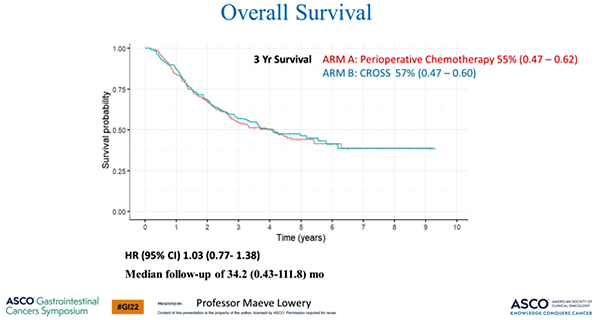
Рисунок 1. Результаты исследования Neo-AEGIS [1].
Недостаточная эффективность цитостатической терапии и ее высокая токсичность привели к активному поиску молекулярных мишеней, воздействие на которые способствовало бы улучшению результатов лечения локализованного РЖ и КЭП. Возможность назначения иммунотерапии в неоадъювантном режиме больным локализованным РЖ и КЭП с dMMR/MSI-H представлена в исследовании INFINITY [2].
В работу были включены больные РЖ и КЭП с dMMR/MSI-H, которым проведена терапия в режиме тремелимумаб 300 мг в 1 день в комбинации с дурвалумабом 1500 мг в 1, 29 и 57 дни. Первичными конечными точками исследования было достижение ypT0N0, а также уровень снижения цДНК.
С мая 2021 по февраль 2022 года 18 пациентов были включены в исследование, 1 больной отказался от терапии после 1 цикла лечения, у 1 зарегистрировано прогрессирование на фоне терапии и 2 воздержались от операции.
Медиана возраста пациентов достигла 71,5 лет, большинство их них были мужчинами (67%) с ECOG статусом 0 баллов (67%), локализацией опухоли в желудке (78%) и T3-4 (95%), N2(50%).
Назначение комбинации тремелимумаба и дурвалумаба позволило достигнуть ypT0N0 у 60% больных. При анализе достижения элиминации опухолевой цДНК составила 17% (n=1/6) для пациентов с Т4 и 89% (n=8/9) для пациентов с Т2 или Т3 (Р=0,011) (рис.2).
Нежелательные явления (НЯ) любой степени, связанные с иммунотерапией, были преимущественно представлены зудом (22%), тиреоидитом (22%), гепатитом (17%) и кожной сыпью (17%). НЯ 3-й степени и выше включали гепатит (n=1), колит (n=1) и пневмонит (n=1).
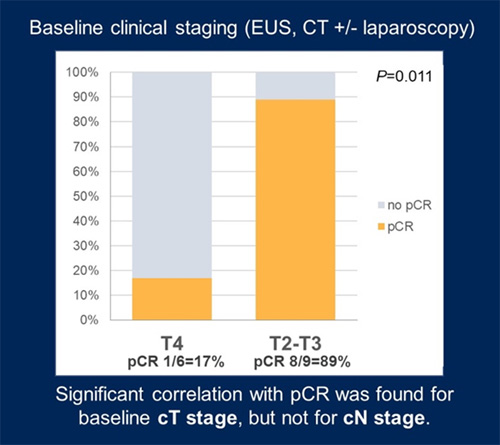
Рисунок 2. Частота достижения pCR [2].
Золбетуксимаб – моноклональное химерное антитело (Ig G1) к CLDN18.2, которое, связываясь с рецептором на поверхности опухолевых клеток, вызывает антителозависимую и комплемент-зависимую клеточную цитотоксичность. Ранее эффективность золбетуксимаба при РЖ и КЭП была продемонстрирована в исследовании 2b фазы FAST, где добавление золбетуксимаба к EOX позволило увеличить медиану ВБП с 5,7 до 9,0 мес., а медиану ОВ – с 8,9 до 15,6 мес.
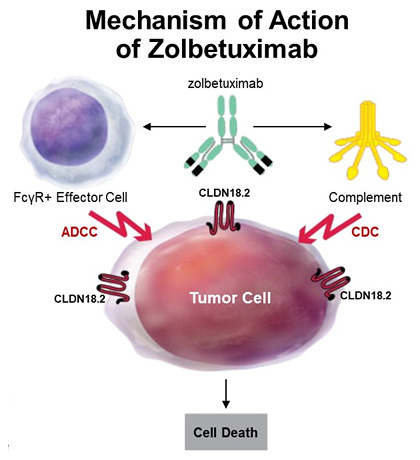
Рисунок 3. Механизм действия золбетуксимаба.
В исследовании 3 фазы SPOTLIGH [3] изучалась целесообразность добавления золбетуксимаба к химиотерапии в режиме mFOLFOX6 в 1 линии терапии диссеминированного HER2-негативного РЖ и КЭП с высокой экспрессией CLDN18.2 (≥75% клеток опухоли). Из 2244 изученных опухолевых образцов высокий уровень экспрессии CLDN18.2 выявлен в 856 случаях (38,5%).
В исследование было рандомизировано 565 пациентов (1:1):
Пациенты получали терапию до прогрессирования или неприемлемой токсичности.
Первичной конечной точкой исследования была медиана ВБП, вторичными – медиана ОВ, частота достижения объективного ответа (ОО), контроля роста опухоли (КРО) и токсичность терапии.
При медианах времени наблюдения в 12,9 и 12,6 мес. добавление золбетуксимаба к mFOLFOX позволило увеличить медиану ВБП с 8,67 до 10,6 мес. (p=0,0066) и медиану ОВ с 15,5 до 18,2 мес. (p=0,0053) (рис.4).
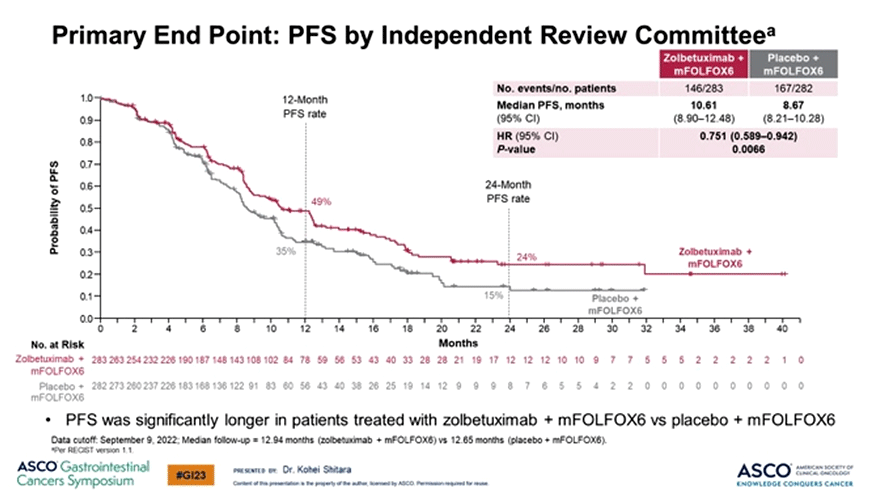
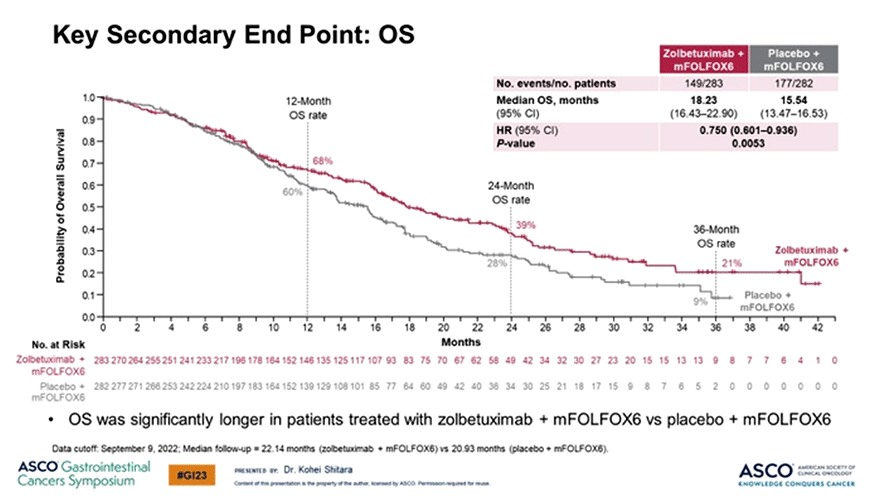
Рисунок 4. Результаты исследования SPOTLIGH [3].
При подгрупповом анализе как в отношении ВБП, так и для ОВ не отмечено значимого улучшения результатов терапии при добавлении золбетуксимаба при диффузном подтипе опухоли и локализации первичного очага в КЭП.
Объективный ответ в группе с золбетуксимабом зарегистрирован у 60,7% больных, а в группе с плацебо – в 62,1% случаев.
Частота серьезных НЯ, связанных с терапией, была одинаковой в группах золбетуксимаба и плацебо (44,8% и 43,5%). НЯ 3 степени и выше отмечены у 86,7% и 77,7% пациентов, получавших золбетуксимаб и плацебо соответственно. НЯ, связанные с лечением, которые послужили причиной прекращения терапии золбетуксимабом или плацебо, зарегистрированы у 13,6% и 2,2% пациентов, а в 1,8% и 1,4% случаев НЯ привели к смерти. Наиболее частыми НЯ любой степени были тошнота (82,4% и 60,8%), рвота (67,4% и 35,6%) и снижение аппетита (47,0% и 33,5%).
Колоректальный рак
Энкорафениб и цетуксимаб в комбинации с химиотерапией при раке толстой кишки с мутацией в гене BRAF (V600E)
Добавление к комбинации энкорафениба и цетуксимаба химиотерапии в режимах mFOLFOX6 или FOLFIRI продемонстрировало высокую противоопухолевую активность и приемлемый профиль токсичности у больных диссеминированным колоректальным раком с мутацией в гене BRAF V600E. Результаты исследования 3 фазы BREAKWATER были представлены на симпозиуме ASCO GI 2023 [4].
Напомним, что комбинация энкорафениба и цетуксимаба одобрена FDA для лечения пациентов диссеминированным КРР с мутацией в гене BRAF V600E на основе результатов исследования 2 фазы BEACON (NCT02928224).
BREAKWATER – это мультикогортное исследование; в первой когорте больные получали энкорафениб в комбинации с цетуксимабом и химиотерапию в режиме FOLFIRI, во второй – энкорафениб, цетуксимаб и mFOLFOX6. Первичной конечной точкой исследования была частота НЯ, вторичными – ЧОО, медианы ВБП и ОВ.
НЯ любой степени зарегистрированы у всех пациентов в исследовании. Серьезные НЯ наблюдались у 48,1% группы mFOLFOX6 и у 33,3% в группе FOLFIRI. НЯ 3 степени и более отмечены у 77,8% пациентов в когорте энкорафениба, цетуксимаба и mFOLFOX6 и у 50,0% в группе энкорафениб, цетуксимаб и FOLFIRI. Эти осложнения потребовали снижения дозы у 63,0% и 40,0% больных соответственно, а в 18,5% против 20,0% НЯ привели к прекращению терапии. Наиболее частыми осложнениями, зарегистрированными в группах, были тошнота (74,1%), гипертермия (48,1%), рвота (40,7%) и диарея (33,3%).
Результаты исследования SUNLIGHT: бевацизумаб в комбинации с трифлуридин/типирацилом (TAS-102) в сравнении с трифлуридином/типирацилом в поздних линиях лечения метастатического колоректального рака
В исследование SUNLIGHT [5] было включено 492 больных диссеминированным метастатическим КРК, ранее получавших фторпиримидины, иринотекан, оксалиплатин, анти-VEGF и анти-EGFR терапию. Пациенты были стратифицированы по месту жительства, времени с момента постановки диагноза диссеминированного КРК и статусу генов RAS.
Участники были рандомизированы в две лечебные группы (1:1): TAS-102 в комбинации с бевацизумабом либо только TAS-102. Первичной конечной точкой исследования была медиана ОВ, а вторичными – медиана ВБП, КРО и токсичность терапии.
Медианы ВБП составили 5,6 мес. в группе TAS-102 в комбинации с бевацизумабом и 2,4 мес. в контрольной группе (ОР 0,44; 95% ДИ 0,36-0,54; P<0,001), при 6-месячной ВБП 43% против 16% и 12-месячной ВБП 16% и 1% соответственно.
Медиана OВ достигла 10,8 мес. в группе FTD/TPI в комбинации с бевацизумабом и 7,5 мес. в группе FTD/TPI (ОР 0,61; 95% ДИ 0,49-0,77; p<0,001), при 6-месячной ОВ в 77% и 61% и 12-месячной ОВ в 43% и 30% соответственно (рис.5).
![Результат исследования SUNLIGHT [5]](05.jpg)
Рисунок 5. Результат исследования SUNLIGHT [5].
Частота НЯ в группе TAS-102 в комбинации с бевацизумабом составила 72% и 70% в группе TAS-102, у 13% пациентов в обеих группах зарегистрированы НЯ, которые привели к прекращению терапии. У 16% пациентов в группе с бевацизумабом наблюдалось снижение дозы в сравнении с 12% в контрольной группе.
Такие НЯ, как артериальная гипертензия (10% 2%), тошнота (37% и 27%) и нейтропения (62% и 51%), были выше группе TAS-102 в комбинации с бевацизумабом в сравнении с группой только TAS-102.
Гепатоцеллюлярный рак
В настоящий момент комбинация атезолизумаба и бевацизумаба является предпочтительной для первой линии системной терапии у пациентов с ECOG 0-1 баллов и функцией печени CPS 5-6 баллов. По данным исследования 3 фазы ImBrave150 комбинация атезолизумаба и бевацизумаба в сравнении с сорафенибом позволяет статистически значимо увеличить медиану ОВ с 13,4 до 19,2 мес. и медиану ВБП с 4,3 до 6,9 мес. соответственно. По данным другого исследования III фазы HIMALAYA, выживаемость пациентов с ECOG 0-1 балл и функцией печени CPS 5-6 баллов без тромбоза ствола воротной вены и при ограниченном объеме поражения печени в первой линии иммунотерапия дурвалумабом была не хуже, чем при терапии сорафенибом (ОР 0,86; 95, 67% ДИ 0,73-1,03).
Исследование NRG/RTOG 1112 [6] было инициировано до получения результатов ImBrave150 и HIMALAYA, на тот момент терапия сорафенибом являлась стандартом первой линии терапии. В исследовании NRG/RTOG 1112 изучалась целесообразность добавления SBRT к сорафенибу в первой линии терапии.
Добавление SBRT к терапии сорафенибом позволило увеличить медиану ОВ с 12,3 до 15,8 мес. (p=0,55) и медиану ВБП с 5,5 до 9,2 мес. (p=0,0001) (рис.6).
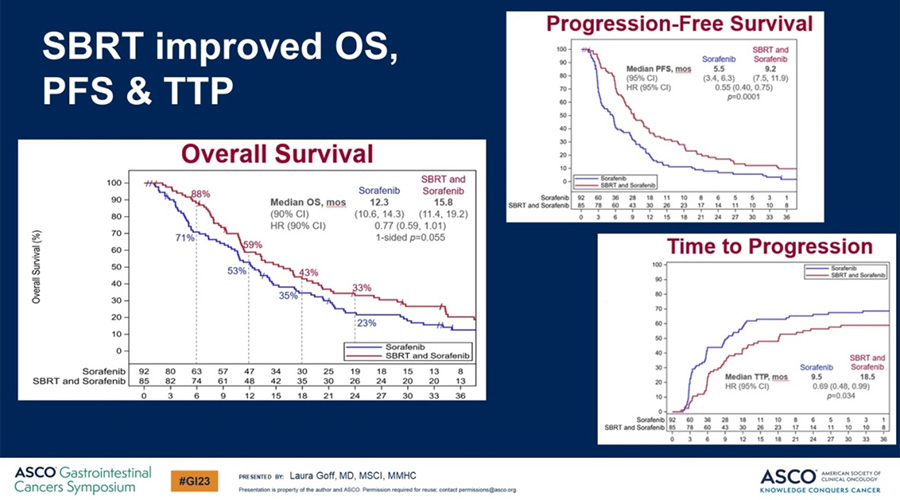
Рисунок 6. Результаты исследования NRG/RTOG 1112.
В группах SBRT в комбинации с сорафенибом и в группе монотерапии сорафениба у пациентов наблюдались гастроинтестинальная токсичность (10% и 7%), гематологическая токсичность (27% и 19%) и нарушения со стороны гепатобилиарной системы (1% и 3%). Желудочно-кишечное кровотечение развилось у 4% (n=3) и 6% (n=5) пациентов в группах соответственно. Таким образом, сорафениб в комбинации с SBRT представляет собой опцию первой линии лечения у пациентов, которые не могут получать иммунотерапию.
Рак поджелудочной железы
В рандомизированном исследовании NAPOLI 3 [7] оценивалась эффективность и безопасность липосомального иринотекана в комбинации с оксалиплатином, лейковорином и 5-ФУ (NALIRIFOX) в сравнении с наб-паклитакселом и гемцитабином в первой линии лечения диссеминированного рака поджелудочной железы (РПЖ).
Пациенты были рандомизированы в две лечебные группы (1:1):
Лечение продолжалось до прогрессирования заболевания или неприемлемой токсичности. Факторы стратификации: статус ECOG, место проживания и наличие или отсутствие метастазов в печени. Первичной конечной точкой исследования была медиана ОВ, вторичными – медиана ВБП, ЧОО и токсичность.
Характеристики пациентов были сопоставимы в группах лечения: так, средний возраст составил 64 года и 65 лет в группах NALIRIFOX и наб-паклитаксел/гемцитабин соответственно. Большинство пациентов в группах были белыми (82,2% и 83,7%) мужчинами (53,3% и 59,4%), с ECOG 1 (58,0% и 56,6%) и, по крайней мере, с 3 метастатическими очагами (38,9% и 36,4%), преимущественно локализующимися в печени (80,2% и 80,4%), и исходным уровнем CA 19-9 не менее 37 Ед/мл (83,8% и 81,7%).
Медиана ВБП в группе NALIRIFOX составила 7,4 мес. против 5,6 мес. в группе наб-паклитаксел/гемцитабин (p<0,0001).
При медиане времени наблюдения в 16,1 мес. медиана ОВ в группе NALIRIFOX достигла 11,1 мес. по сравнению с 9,2 мес. в группе наб-паклитаксел плюс гемцитабин (p=0,04) (рис.7).
![Результаты исследования NAPOLI 3 [7]](07.jpg)
Рисунок 7. Результаты исследования NAPOLI 3 [7].
ЧОО в группе NALIRIFOX составила 41,8% против 36,2% в группе наб-паклитаксела/гемцитабина, при КРО в 67,3% и 62,3% соответственно.
НЯ любой степени зарегистрированы у 99,7% и 99,2% пациентов в группе NALIRIFOX и наб-паклитаксела/гемцитабина. НЯ 3 степени и выше отмечены у 87% и 86% пациентов в группах, при зарегистрированных серьезных побочных эффектах у 54,3% и у 26,5% больных. Наиболее распространенными НЯ были нейтропения (29,5% и 31,9%), анемия (26,2% и 40,4%), тромбоцитопения (10,5% и 17,9%), диарея (70,5% и 36,7%), тошнота (59,5% и 42,7%), рвота (39,7% и 26,4%), гипокалиемия (31,6% и 12,9%), полинейропатия (17,8% и 17,4%), парестезии (11,9% и 8,7%) и гипертермия (10,5% и 23,0%).
Источники: