16.01.2023

Достижения современной онкологии позволяют реализовать борьбу за жизнь пациента, не только укладываясь в стандарты необходимой противоопухолевой терапии, но и затрагивая решение вопросов качества жизни каждого пациента. Совершенствование терапевтических подходов в лечении онкобольных устойчиво расширяет диапазон сопроводительной терапии, как по остро возникающим осложнениям, так и по осложнениям, отягощающим жизнь больного вне болезни. В последнем случае простыми примерами могут служить симптомы периферической нейропатии, лимфостаза, о которых пациент охотно сообщит на каждом приеме у онколога. Однако не менее важными осложнениями, «незаметно» изменяющими качество жизни больных, являются нарушения когнитивных функций, выпадение которых, без грубых симптомов, на всех этапах лечения и после его окончания, не дает повода к активным терапевтическим подходам. Ускользание от объективного взгляда клиницистов онкологов выпадения когнитивных функций у онкобольных возможно обусловлено, «специфическими» проявлениями возрастных особенностей пациента. Коморбидными заболеваниями отягощен соматический статус у большинства онкологических больных, которые чаще относятся к гериатрической практике. Привносит отрицательное влияние и частая смена онколога у одного больного, когда возникающие отклонения когнитивного здоровья также ускользают от объективной оценки и своевременной терапии. У больного нарастает когнитивный дефицит различных функций, и пациент начинает путь в его лечении либо самостоятельно, либо по рекомендации близких, которым становится очевидным когнитивное неблагополучие больного. Данные обстоятельства дестабилизируют социальное положение пациента, а лечение когнитивных нарушений становится не только затратным, но и менее эффективным.
Следует отметить, что лекарственная терапия коморбидных заболеваний у онкологического больного может также привносить отрицательное воздействие на когнитивное здоровье пациента, в этой связи смежным специалистам необходимо скорректировать их назначение и принимаемую дозировку с учетом предстоящего лечения у онколога. Из лекарственных препаратов, влияющих на когнитивное здоровье пациента в большей степени, можно отметить антихолинергические средства (антидепрессанты, противопаркинсонические препараты, миорелаксанты, антипсихотические средства, антиэметики и др.), антагонисты Н2-рецепторов, бензодиазепины и ряд других.
Современные исследования приблизили к валидации такого термина, как когнитивная реабилитация, которая подразумевает терапевтические программы, направленные на улучшение когнитивных способностей, функциональных возможностей, реальных навыков и/или внутренних метакогнитивных стратегий. С.А. Meyers c соавторами (2005 г.) отметили, что около 13% пациентов, перенесших рак, перестают работать в течение последующих 4 лет после постановки диагноза в связи с возникающими когнитивными нарушениями. Michell C. Janelsins с коллегами в своей работе отметили, что когнитивные нарушения широко распространены среди онкологических больных, они могут быть диагностированы в 30% случаях до начала лечения, 75% случаев в процессе проводимой противоопухолевой терапии и до 35% случаев в отдаленные периоды наблюдения. В последующем Wefel с соавторами при изучении когнитивных нарушений у больных раком молочной железы детализировали данные показатели. Когнитивные нарушения были отмечены у 40% больных при постановке диагноза, 65% больных показали спад когнитивных функций в процессе или вскоре после завершения лечения и 61% больных показали изученные отклонения в течение 1 года после окончания лечения, при этом значительная часть пациентов продемонстрировала ухудшение когнитивных функций, которые ранее не были очевидными.
К пониманию характера и причин когнитивных нарушений у онкологических больных (исключая больных с опухолями центральной нервной системы) впервые стали стремиться с середины 1990-х годов, подведя итоги в начале 2000-х. Было впервые установлено, что когнитивный дефицит у онкологических больных может быть связан с присутствием злокачественного новообразования, а в последующем и в связи с проводимой химиотерапией. Диапазон когнитивных нарушений с частотой от 12% до 82% случаев лежал в области нарушения исполнительной функции, памяти, психомоторной функции и нарушения внимания (современные данные корректируют данный диапазон от 17% до 70% случаев различных когнитивных нарушений). Отечественные авторы А.О. Войнаревич, В.А. Горбунова с соавторами (1997 г.) в группе из 42 больных на фоне проводимой терапии производными платины отметили центральную нейротоксичность в 32 случаях, из них у 24 больных имело место нарушение концентрации внимания, краткосрочной и отсроченной памяти, головокружение. У 8 больных отмечено изменение ментального статуса I-II степени тяжести. В 2018 г. Д.Р. Терегулова, Б.А. Бакирова с соавторами публикуют результаты исследования когнитивных функций у больных лимфопролиферативными заболеваниями (n=61, средний возраст больных 63,87±9,76 года): после лечения снижение когнитивных функций отмечено у 73,77% больных, субъективно эти нарушения отмечали только 36% больных (n=22). Наибольшие изменения были отмечены в нарушениях памяти, внимания, концентрации и исполнительных функциях.
Относительно когнитивных изменений у онкологических больных разных возрастных групп стоит отметить работу группы исследователей из Сингапурского национального онкологического центра. Alex Chan с соавторами (2018 г.) доложили о результатах изучения когнитивных нарушений у онкобольных в возрасте от 15 до 39 лет в сравнении со здоровыми данной возрастной категории. Было отмечено, что у онкобольных в указанном возрасте меньше число трудоустройств и большая потеря продуктивности в работе в сравнении с пожилыми пациентами, пережившими рак. Средний возраст больных составил 27,8±6,7 лет, n=65, все пациенты относились к азиатскому этносу. Структура онкозаболеваний: 41% – больные с саркомами, 32,3% – больные с лимфомами, герминогенные опухоли были диагностированы у 15,4% больных. Почти половина участников исследования жаловались, что лечение онкозаболевания неблагоприятно повлияло на их внимание и память, что сделало необходимым больше использовать современные гаджеты для компенсации возникающего дефицита. Диагностированные когнитивные нарушения сохранялись в течение 12 месяцев после окончания лечения.
К пониманию природы возникающих когнитивных нарушений у онкологических больных привели несколько работ зарубежных авторов, отмечена роль цитокинов в патогенезе развития данного состояния. С.А. Meyers c соавторами (2005 г.) в исследовании когнитивных нарушений у больных острым лейкозом и у больных с миелодиспластическим синдромом (n=54, средний возраст больных составил 60,2 года) отметили, что возраст пациента, его уровень образования согласно проведенным опросникам коррелируют с тяжестью нарушения КФ. Цитокины, которые были изучены в работе, включали: IL-1β, антагонист рецептора IL-1 (IL-1 RA), IL-6, IL-8, TNF-α. Было отмечено, что высокий уровень IL-6 имел место у пациентов при низких показателях исполнительной функции. Высокий уровень IL-8 имел положительную корреляционную связь при тестировании функций памяти. Ning Yi Yap, Yi Long Toh с соавторами (2021 г.) изучали когнитивные нарушения (острые, стойкие и отсроченные) у больных ранним раком молочной железы (рРМЖ) (n=136, 116 (85,3%) больных – китаянки), средний возраст больных составил 52,0±8,9 лет; 70,6% пациентов получили протоколы химиотерапии на основе антрациклинов, 29,4% – на основе таксанов. В адъювантном режиме 47,8% получили тамоксифен, 35,3% – ингибиторы ароматазы, не получали антиэстрогены 16,9% больных. Проспективное когортное исследование включало наблюдение за больными ранним раком молочной железы с ноября 2014 г. по январь 2020 г. Сравнение проводилось между больными исходно с наличием когнитивных нарушений с группой пациентов без когнитивных отклонений. Контрольными точками для оценки когнитивных нарушений служили исходное состояние когнитивных функций (КФ) – T1, состояние КФ через 6 недель после начала химиотерапии (T2), КФ через 3 месяца после начала химиотерапии либо после окончания химиотерапии (T3) и через 12 и 24 месяца после окончания химиотерапии (T4). На протяжении всего периода наблюдения о когнитивных нарушениях сообщили 40,4% больных. У 11% (n=15) больных были диагностированы острые когнитивные нарушения, у 15,4% (n=21) пациенток зарегистрированы когнитивные нарушения, носящие постоянный характер, и у 14% (n=19) отмечены когнитивные нарушения после завершения лечения. В представленной работе изучение уровня цитокинов IFN-γ, IL-4, IL-6, TNF-α указало на наличие повышенных показателей всех цитокинов до начала лечения, как у больных с наличием нарушения КФ, так и без отклонений КФ, также был отмечен рост показателей цитокинов на фоне проводимой химиотерапии. Параллельно в исследованной группе пациенток был изучен уровень BDNF (brain derived neurotrophic factor) – мозгового нейротрофического фактора. BDNF является белком из класса цитокинов, семейства факторов роста и подсемейства нейротрофинов. BDNF выявляется в глиальных и преимущественно в нейрональных клетках, является одним из факторов, поддерживающих дифференциацию, созревание и выживаемость нейронов в нервной системе, угнетающих клеточный апоптоз и проявляющих нейропротекторный эффект в неблагоприятных условиях, таких как глутаматергическая стимуляция, церебральная ишемия, гипогликемия и нейротоксичность. Дефицит BDNF может обусловить аномалии развития головного мозга, понижение нейрональной пластичности и снижение адаптивных реакций на стрессовые ситуации. У больных раком молочной железы в изученной группе отмечено повышение более чем в 3 раза уровней цитокинов при развитии острых и постоянных нарушений КФ в сравнении с группой пациентов без когнитивного дефицита. Также были получены результаты взаимодействия высоких показателей цитокинов у больных рРМЖ с низким уровнем BDNF. Достоверными оказались высокий уровень IL-6 с обратной корреляционной связью с уровнем BDNF у пациенток с постоянными нарушениями КФ. Alex Сhan (2022 г.) опубликовал результат изучения белков экстрацеллюлярных везикул в плазме крови больных раком молочной железы как этиопатогенетического фактора в развитии когнитивных нарушений. В норме формирование экзосом как одного из класса внеклеточных везикул является необходимым процессом для поддержания межклеточного взаимодействия в организме человека. Экзосомы представляют собой сферические частицы с размером 30-150 нм, их участие отмечено в таких состояниях, как нарушение иммунного гомеостаза, беременность, инфекционные заболевания, наличие у пациента злокачественного новообразования, а также при органических заболеваниях головного мозга. Экзосомы формируют везикулярные тельца, которые действуют строго в клетках мишенях. Формирование экзосом является естественным процессом при поддержании межклеточного взаимодействия как в структурах головного мозга, так и в его взаимодействии с периферической нервной системой. Установлена основополагающая роль экзосом в поддержании пластичности процессов головного мозга, регенерации нейронов, а также в сохранении их функций в условиях оксидантного стресса. Экзосомы также являются модуляторами иммунного ответа, пролиферации клеток, а также активаторами сигнальных путей в клетках реципиента. У больных со злокачественными новообразованиями установлено формирование опухолевых экзосом, которые обладают свойствами злокачественной клетки – инвазией, иммуносупрессией, обладают факторами роста, перенося в своем составе микро-РНК опухолевой клетки, они также участвуют в формировании метастазов, формируют и резистентность опухолевой клетки к проводимой терапии. При изучении участия опухолевых экзосом в формировании когнитивных нарушений было установлено, что они помогают патологическим белкам преодолевать гематоэнцефалический барьер, нарушают передачу импульса как в центральной нервной системе, так и при передаче импульса с периферии и внутренних органов. Путем переноса в своем составе патологических белков опухолевые экзосомы прицельно поражают олигодендроциты, астроциты и клетки микроглии, вызывая демиелинизацию клеточных структур, препятствуют их регенерации, нарушают межнейрональное взаимодействие. Установлено, что опухолевые экзосомы способны переносить в своем составе матричные РНК (miR-155, miR-21 и miR-29а), а также белки теплового шока (Hsp70 и Hsp90), стимулируя катаболизм в скелетной мускулатуре, что вызывает атрофию мышц и характерные для онкобольных кахексию и такой распространенный симптом, как «слабость, снижение работоспособности».
Опухолевые экзосомы участвуют в регуляции иммунного ответа путем воздействия непосредственно на макрофаги, Т-клетки и NK-клетки. Стоит отметить, что Maji S. с соавторами (2017 г.) установили, что клетки рака молочной железы формируют экзосомы, которые содержат белки, активирующие патологические сигнальные пути в макрофагах, которые в свою очередь участвуют в ангиогенезе метастазов и формируют цитокиновый ответ в клетках головного мозга и легких.
В настоящее время экзосомы потенциально рассматриваются как клинические биомаркеры для прогнозирования и динамического контроля в развитии когнитивных нарушений у онкологических больных, а также как мишени для терапевтического воздействия для лечения нарушения КФ у онкологических больных. Chan A. с соавторами в июне 2022 г. анонсировали грант на изучение воздействия электроакупунктуры на уровень определенных молекул у больных раком молочной железы с параллельным фиксированием сканов структур головного мозга на фоне проводимой терапии. Стоит отметить результаты более ранней публикации Chan A. с соавторами от 2015 г., которые изучали фармакологическое воздействие на коррекцию КН у больных раком молочной железы (эритропоэтина альфа, Гинко билоба, психостимуляторы) в сравнении с проведением занятий, направленных на коррекцию КН и физической активности. Полученные данные указали на отсутствие эффекта от лекарственной терапии данными препаратами для коррекции КН у больных РМЖ. Упражнения, направленные в отношении нарушенных когнитивных функций, позволили улучшить самооценку когнитивного здоровья, память, словесную функцию, речь, ориентацию в происходящем и внимание, скорректированная физическая активность позволила улучшить показатели по выполнению функций и самооценке когнитивного здоровья.
Резюмируя, стоит вспомнить слова героя народного артиста СССР Леонида Сергеевича Броневого (лекарь, «Формула любви», 1984 г.): «…А голова – предмет тёмный и исследованию не подлежит». Широкий диапазон исследований в изучении этиопатогенетических факторов когнитивных нарушений у онкологических больных на всех этапах лечения и при длительном наблюдении требует дальнейшей детализации и систематизации для формирования единого терапевтического подхода как со стороны онколога, так и в рамках междисциплинарного взаимодействия. В настоящее время сформированы опросники для диагностики когнитивных нарушений у онкологических больных, однако их презентация больному в рутинную практику онколога представляется сомнительной с учетом приоритетных направлений, формирующихся у онкобольного при постановке диагноза и в процессе лечения. Внедрение тестов с объективной оценкой когнитивного статуса пациента представляется возможным на этапах диспансерного наблюдения. Следует отметить, что клиницисту онкологу просто оценить риск развития КН у каждого пациента с учетом полученных знаний (рис.1). Принятие решения о дообследовании когнитивного статуса онкобольного в каждом конкретном случае остается нерешенным вопросом, так как нет четких критериев для дальнейшей тактики ведения онкологического пациента как в рамках, так и вне диагноза по основному заболеванию. Необходимым является и формулирование диагноза КН (для примера может служить указание КН в рамках шифра F06.7 «Лёгкое когнитивное расстройство»).
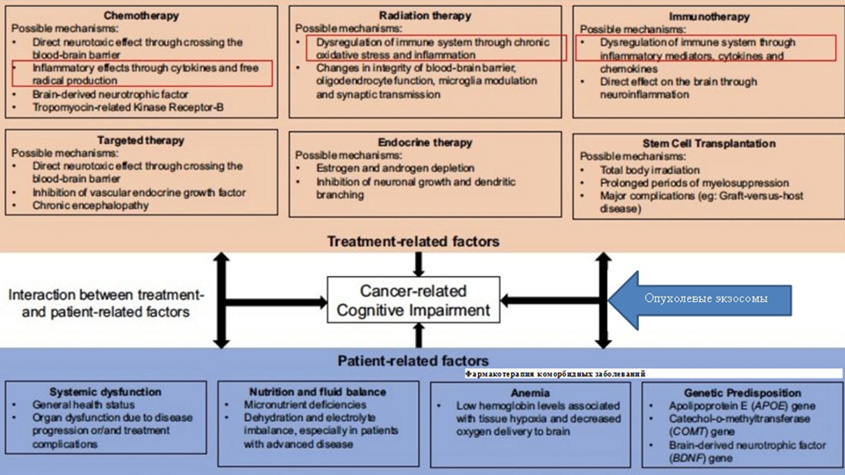
Рисунок 1. Факторы риска развития когнитивных нарушений у онкологических больных (слайд презентации «Risk factors for cancer-related Cognitive Impairment» A.Chan, вебинар MASCC, 2022 г.) с дополнением автора статьи.
В современных условиях формирование показаний к когнитивной реабилитации, объем необходимых обследований и терапевтические подходы требуют рассмотрения как со стороны клинических онкологов, так и в рамках междисциплинарного подхода. Необходимо привнести КН у онкологических больных в протоколы оказания медицинской помощи на всех этапах реабилитации.
Список литературы: