10.12.2021

У российских радиотерапевтов есть общий чат с большим числом участников – шесть сотен без малого. Чувствовать виртуальную связь с коллегами вне огромного пространства страны очень приятно и, более того, удобно и полезно. Можно не просто спросить совета в отношении подходов в сложных клинических ситуациях, получить ссылку на нужную статью или книгу, но и устроить блиц-опрос. В ответ на просьбу назвать наиболее весомые исследования уходящего 2021 года с включением лучевой терапии коллегами были упомянуты следующие.
1 Обновленные 5-летние данные исследования PACIFIC, представленные в июне 2021 года на конгрессе ASCO [1]. Переоценить их сложно, ибо ранее получить подобные результаты радикального лечения больных нерезектабельным немелкоклеточным раком легкого III стадии не удавалось: показатель 5-летней общей выживаемости в группе пациентов, получивших стандартное химиолучевое лечение и консолидирующую иммунотерапию дурвалумабом, составил невиданные до этого 43% (в сравнении с 33% в группе плацебо), при этом треть больных не имели признаков прогрессирования (выживаемость без прогрессирования в группе плацебо – 19% за 5 лет). Эти данные демонстрируют не только преимущество добавления иммунотерапии на этапе консолидации, но и более высокую эффективность самой химиолучевой терапии, нежели было показано в более ранних исследованиях. Облучение первичной опухоли и вовлеченных зон одновременно с ХТ, с применением современных технологий ЛТ, со строгим соблюдением ограничений для снижения токсичности, с максимально более ранним контролем для исключения прогрессирования и последующим переводом на поддерживающую иммунотерапию дурвалумабом – теперь это общепринятый стандарт лечения этой сложной категории пациентов.
2 Данные немецкого исследования CAO/ARO/AIO-12 по применению подхода TNT (тотальной неоадъювантной терапии) у больных с местнораспространенным раком прямой кишки [2], когда и химиотерапия, и одновременная химиолучевая терапия полностью переносятся на предоперационный этап. Стратегия TNT имеет вариации, например, применение коротких курсов облучения с последующей интенсивной химиотерапией, или стандартное химиолучевое лечение с дальнейшим оперативным лечением, или, как в данном исследовании, различная последовательность химиотерапии и химиолучевой терапии на предоперационном этапе. Триста шесть больных раком прямой кишки II-III стадии были рандомизированы либо в группу А (индукционная ХТ с последующим химиолучевым лечением), либо в группу В (наоборот, ХЛТ с консолидирующей ХТ); в дальнейшем пациенты шли на оперативное лечение через 123 дня после начала TNT, только, следовательно, в разные сроки после окончания облучения: в среднем через 45 дней для группы А и 90 дней для группы В. Схема химиолучевой терапии была следующей: 50,4 Гр за 28 фракций на фоне инфузии 5-фторурацила 250 мг/м2 в 1-14 и 22-35 дни плюс оксалиплатин 50 мг/м2 в 1, 8, 22 и 29 дни. Индукционная и консолидирующая ХТ проводились по схеме FOLFOX трижды. Первые результаты, касающиеся ранней токсичности и представленные пару лет назад, показали преимущество комбинации В: практически все пациенты смогли закончить полностью химиолучевое лечение и получить полнодозные режимы ХТ, тогда как в группе индукционной ХТ их процент был достоверно ниже, да и токсичность III-IV степени оказалась чаще встречаемой (37% против 27%). При этом более длительный интервал от окончания облучения до операции (на фоне проводимой химиотерапии) значительно повысил частоту полных патоморфологических регрессов (25% против 17%) без увеличения послеоперационных осложнений. Таким образом, схема ХЛТ – консолидирующая ХТ – операция полностью удовлетворила предварительную статистическую гипотезу авторов в отношении увеличения частоты pCR. При этом более длительное наблюдение за пролеченными пациентами (данные 2021 года) не показало какой-либо разницы ни в показателях ВБП за 3 года (73% против 73%), ни в частоте локорегиональных рецидивов (6% против 5%) или отдаленных метастазов (18% против 16%), ни в общей 3-летней выживаемости (92% против 92%). Частота поздних осложнений 3-4 степени тоже была схожей (15,4% против 17,4%). Дежавю: похожая ситуация наблюдалась с результатами рандомизированного проспективного исследования польских авторов (K.Bujko et al. [3]), когда первоначально в 2016 году было продемонстрировано явное достоверное преимущество в 3-летней ОВ (71,6% против 63,0%, p=0,046) в пользу режима 5×5 Гр с последующими 6 курсами CAPOX или 9 курсами FOLFOX4 по сравнению с традиционным химиолучевым лечением и адъювантной химиотерапией), но более зрелые 8-летние данные [4] практически нивелировали разницу в результатах, как в отношении общей выживаемости (48,8% против 48,6%, p=0,35), так и безрецидивной выживаемости (42,6% против 41,0%, p=0,64) и риска локальных рецидивов и отдаленных метастазов. Авторы признают адекватность двух подходов в лечении больных местнораспространенным раком прямой кишки, тем не менее, делая акцент на преимуществе 2 варианта стратегии TNT (ХЛТ с последующей ХТ и операцией) по причине лучших показателей полных патоморфологических ответов. В целом интенсификация неоадъювантного этапа лечения приобретает все большую популярность, обещая вскоре стать стандартом лечения.
Позволю себе добавить в список еще пару исследований.
3 Проспективное рандомизированное исследование китайских авторов PORT-C [5], на мой взгляд, в очередной раз поставило многоточие на проблеме послеоперационного облучения больных с резектабельным НМРЛ III стадии с поражением лимфоузлов средостения (N2). Более подробная информация об исследовании – на сайте и в августовском номере газеты RUSSCO. С одной стороны, китайские исследователи, как и их коллеги из исследования Lung ART, не показали преимуществ добавления адъювантного облучения средостения при N2: 3-летняя общая выживаемость была 78,3% в группе PORT против 82,8% в контроле, без значимых различий. Но при этом нельзя назвать исследование полностью негативным: слишком явно расходятся кривые ВБП в пользу PORT, хоть и без статистической достоверности. Авторами показано, что PORT, как локальный метод воздействия, достигает своей цели: вносит вклад в локальный контроль, улучшает ВБП и выживаемость без локального прогрессирования (66,5% против 59,7% за 3 года), снижает риск локальных рецидивов за 3 года (9,5% в группе PORT против 18,3% при наблюдении), хоть это, увы, и не отражается на общей выживаемости. Но НМРЛ IIIA pN2 стадии – это особая ситуация, где рассчитывать только на качественное локальное лечение не приходится, необходима адекватная и, скорее всего, более эффективная системная терапия. В любом случае, результаты исследования китайских авторов снова заставляют нас скрупулезно взвешивать все за и против при назначении PORT нашим пациентам и ожидать более четких рекомендаций от профессиональных сообществ в отношении того, кто же в первую очередь будет выигрывать от проведения послеоперационного облучения.
4 Наконец, исследование, способное сломать существующие подходы и потому – номер 1 для меня в уходящем 2021 году.
Немного предыстории. В 2000 году FDA одобрила применение стереотаксической лучевой терапии (SBRT, SABR) у больных ранним раком легкого, и это коренным образом изменило судьбу особо хрупкой категории больных раком легкого – пожилых пациентов в возрасте старше 75 лет, которым зачастую, ввиду сопутствующей патологии, отказывали в проведении любого лечения (рис.1) [6]. По мере накопления опыта проведения SBRT пропорция возрастных пациентов с ранним раком легкого, получивших лучевую терапию, начала возрастать и даже потеснила группу оперированных пациентов.
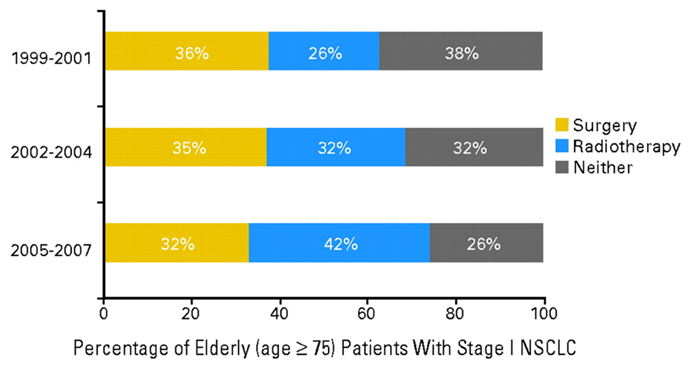
Рисунок 1. Распределение больных раком легкого I стадии в возрасте >75 лет по типу лечения в 1999-2007 годах [6].
По данным Национальной раковой базы данных США – крупнейшего хранилища информации по лечению больных раком легкого в мире, частота отказов от операции в пользу SBRT за период 2004-2016 гг. постепенно возрастала – но не достигла и 2%. Поэтому адекватно сравнить результаты лечения – хирургического и лучевого – на основании ретроспективных анализов было невозможно: слишком несопоставимы были группы больных по количеству. Крайне необходимы были проспективные сравнительные исследования, но три инициированных подобных исследования – STARS, ROSEL и RTOG 1021 – «захлебнулись» по причине плохого набора больных в группу лучевой терапии. Маловероятно, что тогда, в начале 2000-х, да и 2010-х, альтернатива в виде SBRT была адекватно описана пациентам, тем более что отбор производили хирурги. Авторитет хирурга в лечении раннего рака легкого всегда был непререкаем. Однако результаты лечения пациентов из 2 исследований (STARS и ROSEL) все же были проанализированы в совокупности и опубликованы в 2015 году [7] – и вызвали немало шума и волнений, иронии и споров со стороны разных представителей мирового онкологического сообщества. Практически по всем показателям SBRT выигрывала у операции: 3-летняя выживаемость без прогрессирования составила 86% против 80%, выживаемость без отдаленных метастазов за 3 года – 97% против 91%, не говоря уже о значительно более низкой токсичности. Да, частота как локальных, так и региональных рецидивов была выше в группе облучения (4% против 0% и 10% против 4% соответственно) – но это никак не сказалось на результатах общей выживаемости (86% против 80% за 3 года).
Последовали многочисленные аргументы от приверженцев хирургического метода, однако единственно весомыми, на которые они могли опираться, были лишь результаты ретроспективных сравнительных анализов, в лучшем случае – с сопоставлением данных по каким-либо параметрам. Подобных анализов в доступной литературе можно обнаружить массу. Что интересно: когда четкие доказательства превосходства того или иного метода (проспективные данные) отсутствуют, большую роль начинает играть способность автора интерпретировать имеющиеся данные и маневрировать меж ними так, как ему, автору, удобно, поэтому и выводы этих многочисленных анализов здорово различаются. Одни демонстрируют явное преимущество хирургического метода, другие показывают отсутствие различий в эффективности. Но самое главное – это то, что ретроспективный анализ, сколь много бы их ни было, никогда не сможет конкурировать по уровню доказательности с проспективными данными по причине «отобранности» больных, идущих на более агрессивное лечение, да и, повторюсь, число пациентов, пролеченных SBRT, несопоставимо с количеством прооперированных.
Можно привести не менее дюжины аргументов в пользу метода SBRT, развитие которого не стояло на месте эти годы, это тема для отдельного сообщения. Но главный аргумент появился в июне 2021 года в виде доклада профессора J. Chang на конгрессе ASCO 2021. Дело в том, что авторы исследования STARS после публикации совокупных результатов в 2015 году не бросили работу, а продолжили набор пациентов в группы SBRT и операции по прежнему протоколу! На момент доклада исследование включало уже свыше 300 больных, прослеженных более 5 лет. И тенденция полностью сохранилась: 5-летняя общая выживаемость оказалась достоверно лучше в группе лучевой терапии – 87% против 84%, p=0,012, HR 0,411 (95% CI 0,193-0,875; p=0,021). При этом отсутствовали различия между группами в БРВ, раково-специфической выживаемости, кумулятивной частоте рецидивов (рис.2). Результаты исследования были немедленно опубликованы в журнале Lancet Oncology [8].
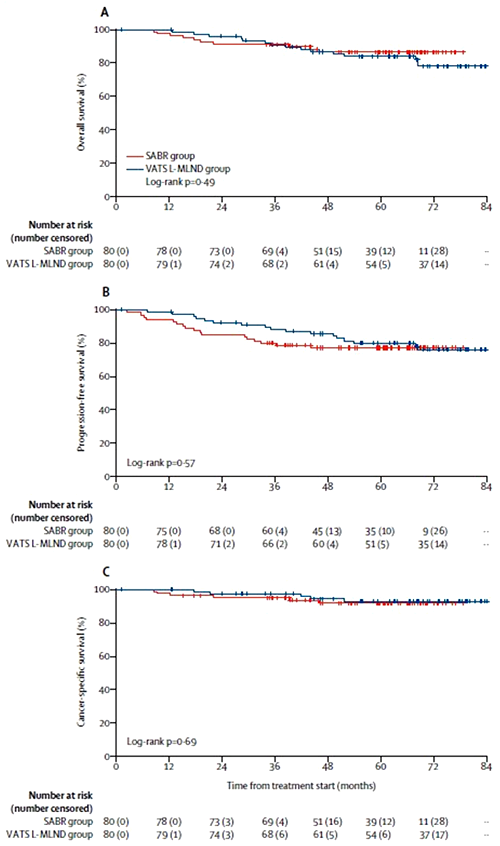
Рисунок 2. Общая выживаемость (А), выживаемость без прогрессирования (В) и раково-специфическая выживаемость (С) больных с НМРЛ I стадии после SABR или видеоассистированной лобэктомии с медиастинальной лимфодиссекцией [8].
Данные демонстрируют, что SBRT при раннем раке как минимум не хуже, чем операция. Есть большая уверенность, что в недалеком будущем консервативный метод лечения – SBRT – станет абсолютно адекватной альтернативой операции не только для тех пациентов, которые не способны ее перенести, но и у сохранных больных ранним НМРЛ без явной сопутствующей патологии, и выбор будет исключительно за пациентом.
Источники: