10.12.2021

Уходящий 2021 год ознаменовался для нас не только уникальной возможностью изучить греческий алфавит вследствие продолжающейся пандемии COVID-2019, но и многими событиями, которые сумели изменить к лучшему возможности лечения пациенток с онкогинекологическими заболеваниями. Рассмотрим некоторые из них.
Вторичные циторедукции при раке яичников: DESKTOP III – публикация результатов
2 декабря 2021 года в New England Journal of Medicine были опубликованы результаты рандомизированного исследования III фазы DESKTOP III (n=407), которое было посвящено изучению роли вторичных циторедуктивных операций при рецидивах рака яичников (РЯ). Включались пациентки с платиночувствительными рецидивами РЯ, соответствующие критериям AGO Score (ECOG 0, асцит ≤500 мл, ранее выполненная первичная полная циторедукция). Рандомизация осуществлялась в группу выполнения вторичной циторедукции с последующей химиотерапией или в группу только химиотерапии. Первичной конечной точкой исследования была общая выживаемость пациенток (ОВ) [1].
Полная циторедукция была достигнута у 75% пациенток в группе хирургического лечения. Медиана наблюдения составила 69,9 мес. По результатам исследования медиана ОВ составила 53,7 мес. в группе вторичных циторедукций по сравнению с 46,0 мес. в группе только химиотерапии (ОР 0,75; 95% ДИ 0,59-0,96; p=0,02), а медиана выживаемости без прогрессирования (ВБП) – 14,8 мес. и 14,0 мес. соответственно (ОР 0,66; 95% ДИ 0,54-0,82; p<0,05). При проведении дополнительного анализа было выявлено, что медиана ОВ составила 61,9 мес. среди пациенток после полной вторичной циторедукции по сравнению с 27,7 мес. после неполной циторедукции (рис.1).
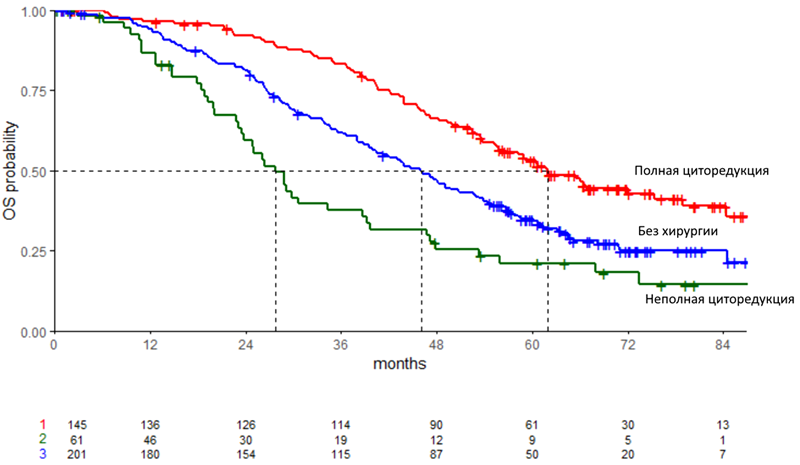
Рисунок 1. Общая выживаемость пациенток после полной вторичной циторедукции, без хирургического лечения и после неполной вторичной циторедукции.
Почему это интересно: в крупном проспективном и хорошо спланированном исследовании DESKTOP III было доказано, что выполнение вторичных циторедуктивных операций позволяет достигать лучших результатов лечения пациенток с рецидивами рака яичников – но с некоторыми оговорками. Только выполнение полной вторичной циторедукции улучшает результаты лечения пациенток. В то же время, неполное удаление рецидивной опухоли не только не улучшает выживаемость, но напротив – может приводить к ухудшению ОВ пациенток. Почему так? В настоящее время невозможно однозначно ответить на этот вопрос. В качестве одной из причин можно предположить более агрессивные биологические особенности опухолевого роста в тех ситуациях, когда выполнение полной циторедукции было невозможно. Тем не менее, нельзя исключить и прямой негативный эффект на выживаемость вследствие нерадикального хирургического вмешательства. Соответственно, представленные результаты указывают на необходимость тщательного отбора пациенток для хирургического лечения при рецидивах рака яичников.
Исследование III фазы KEYNOTE-826: пембролизумаб входит в стандарты I линии метастатического рака шейки матки
В исследование KEYNOTE-826, чьи результаты были представлены на ESMO 2021, включались пациентки с метастатическим или рецидивирующим РШМ, ранее не получавшие системной противоопухолевой терапии. Рандомизация осуществлялась в соотношении 1:1 в группу пембролизумаба 200 мг в/в капельно каждые 21 день или плацебо; пациентки в обеих группах получали до 6 курсов стандартной химиотерапии по схеме паклитаксел + карбоплатин (или цисплатин) ± бевацизумаб 15 мг/кг каждые 21 день. Терапия пембролизумабом/плацебо и бевацизумабом проводилась до прогрессирования заболевания или непереносимой токсичности. Стратификация осуществлялась в соответствии с PD-L1 статусом, применением бевацизумаба и наличием отдаленных метастазов на момент постановки диагноза. Первичной конечной точкой исследования были ВБП и ОВ пациенток среди PD-L1+ пациенток [2].
В исследование было включено 617 пациенток, у 88% из них была выявлена позитивная экспрессия PD-L1 (CPS≥1). По результатам исследования медиана ВБП среди PD-L1+ пациенток составила 10,4 мес. в группе пембролизумаба по сравнению с 8,2 мес. в группе химиотерапии (ОР 0,62; 95% ДИ 0,50-0,77; p<0,001), в общей популяции исследования данные показатели составили 10,4 и 8,2 мес. соответственно. Медиана ОВ не была достигнута в группе исследуемого препарат среди PD-L1+ пациенток и составила 16,3 мес. в группе плацебо (ОР 0,64; 95% ДИ 0,50-0,81; p<0,001), в общей популяции исследования – 24,4 мес. и 16,5 мес. соответственно (ОР 0,676; 95% ДИ 0,54-0,84% p<0,001).
Почему это интересно: первое рандомизированное исследование III фазы, продемонстрировавшее эффективность иммунотерапии в 1 линии лечения метастатического рака шейки матки – причем не только с точки зрения ВБП, но и ОВ пациенток. Оглядываясь назад, мы можем отметить, что развитие возможностей современной противоопухолевой терапии позволило удвоить выживаемость пациенток с метастатическим и рецидивирующим РШМ за последние 7 лет, а в историческом аспекте наблюдается постоянное улучшение отдаленных результатов лечения рака шейки матки (рис.2).
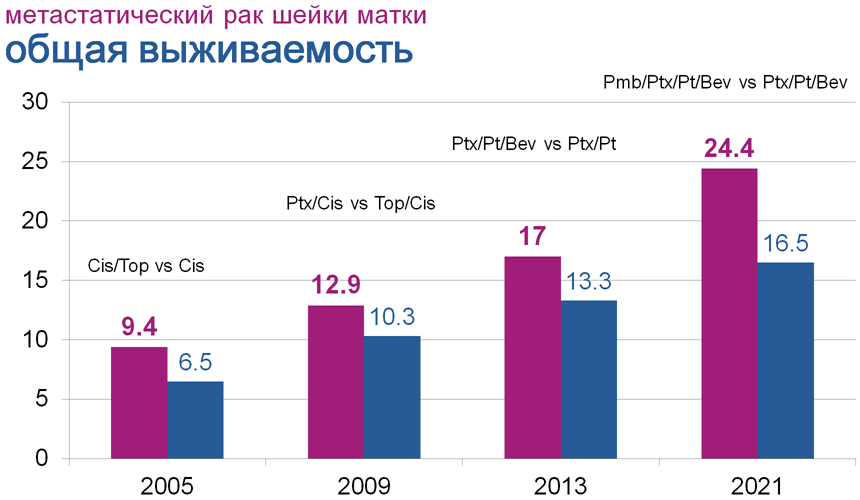
Рисунок 2. Общая выживаемость в пациенток с метастатическим/рецидивирующим раком шейки матки – первая линия терапии (в месяцах).
Вакцинация против ВПЧ и снижение риска развития рака шейки матки
В декабре 2021 года в журнале Lancet были опубликованы результаты крупного регистрового исследования, посвященного влиянию иммунизации против вируса папилломы человека (ВПЧ) на риски развития рака шейки матки и цервикальной in situ аденокарциномы (CIN3). В исследование включались пациентки, проходившие вакцинацию двухвалентной вакциной против ВПЧ 16 и 18 типов (Церварикс) в рамках программы рутинной иммунизации против ВПЧ в Англии. Авторами исследования было проведено сравнение заболеваемости раком шейки матки и CIN3 среди вакцинированных и невакцинированных женщин [3].
По результатам исследования расчетный показатель снижения риска развития рака шейки матки составил 34% (95% ДИ 25-41%) для пациенток, прошедших вакцинацию в возрасте 16-18 лет, 62% (95% ДИ 52-71%) – в возрасте 14-16 лет и 87% (95% ДИ 72-94%) – в возрасте 12-13 лет по сравнению с невацинированными женщинами. Соответствующие показатели снижения риска для CIN3 оставили 39% (95% ДИ 36-41%), 75% (95% ДИ 72-77%) и 97% (95% ДИ 96-98%) соответственно. В соответствии с расчетами авторов исследования, программа вакцинации позволила предотвратить 448 случаев рака шейки матки и 17235 случаев CIN3.
Почему это важно: в России на долю рака шейки матки приходится около 5% всех опухолей, возникающих у женщин; ежегодно эта опухоль диагностируется более чем у 17 тыс. пациенток, более 6 тыс. пациенток умирают. Каждый год. Эти цифры особенно трагичны с учетом того факта, что подавляющее большинство этих смертей может быть предотвращено. Результаты опубликованного исследования показывают, что вакцинация против ВПЧ позволяет резко снизить заболеваемость и, весьма вероятно, смертность от рака шейки матки.
С радостью отметим, что в России уже наметились серьезные позитивные сдвиги в этом направлении: в соответствии с распоряжением Правительства Российской Федерации от 29 марта 2021 года с 2024 года вакцинация против ВПЧ должна быть внесена в Национальный календарь прививок [4]. Это событие само по себе можно отнести к одним из наиболее важных событий года в онкогинекологии. Персонально для нашей страны.
KEYNOTE-775/Study 309: эффективность комбинации ленватиниба и пембролизумаба при метастатическом раке эндометрия в зависимости от гистотипа опухоли
На ESMO 2021 были представлены новые данные из рандомизированного исследования III фазы Study 309, в рамках которого сравнивалась комбинация пембролизумаба и ленватиниба по сравнению со стандартной химиотерапией в лечении рецидивов рака эндометрия. Обновленные данные относятся к анализу эффективности терапии в зависимости от гистотипа опухоли. У пациенток с микросателлитно стабильными (MSS) опухолями данные показатели оказались следующими (рис.3) [5]:
Почему это интересно: представленные на ESMO 2021 данные продемонстрировали крайне высокую эффективность данной терапевтической опции при «редких» гистотипах заболевания – серозном и, в особенности, светлоклеточном раке, при котором было отмечено относительное снижение риска смерти на 66%, что особенно важно в контексте низкой чувствительности данного гистотипа к «традиционным» вариантам противоопухолевой терапии.
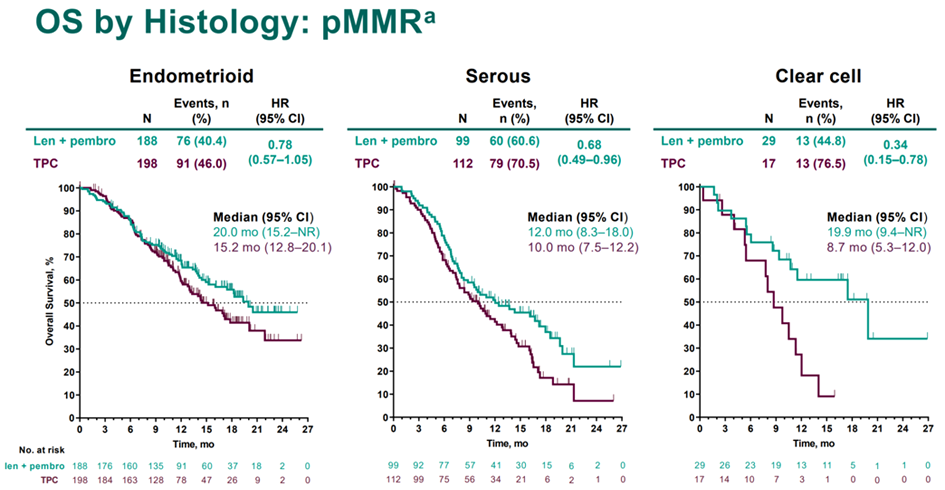
Рисунок 3. Медиана общей выживаемости пациенток с рецидивами рака эндометрия на фоне стандартной химиотерапии и комбинации пембролизумаба и ленватиниба.
Источники: