09.12.2021


В этом году на главных международных онкологических площадках было представлено несколько действительно важных исследований, демонстрирующих не только эффективность новых препаратов при терапии сарком, но и, главным образом, важность эпигенетического подхода в лечении орфанных заболеваний.
Результаты исследования II фазы SPEARHEAD-1 по оценке эффективности афамицела (афамитресген аутолейцел, ADP-A2M4) у пациентов с распространенной синовиальной саркомой или миксоидной/круглоклеточной липосаркомой были представлены на ASCO 2021 [1]. MAGE-A4 представляет собой антиген рака яичка, экспрессирующийся при множестве типов солидных опухолей и, по данным исследований, высоко экспрессируемый при синовиальной саркоме и миксоидной/круглоклеточной липосаркоме. Т-клетки SPEAR были разработаны для нацеливания на HLA-рестриктированный опухолевый антиген MAGE-A4. Рецепторы Т-клеток обладают способностью распознавать внутриклеточные опухолевые антигены, в отличие от Т-клеток CAR, которые могут распознавать только антигены на поверхности клеток. Однако встречающиеся в природе Т-клеточные рецепторы имеют низкую аффинность к большинству этих опухолевых антигенов. Таким образом, Т-клетки SPEAR имеют модифицированные рецепторы, которые обладают более высоким сродством к опухолевому антигену. В исследовании SPEARHEAD-1 пациенты должны были быть HLA-A2 положительными, опухолевая ткань должна была экспрессировать адекватное количество антигена MAGE-A4 (≥30%), а также требовалось наличие в анамнезе предшествующего системного лечения антрациклинами и/или ифосфамидом. Авторы исследования изучили данные 330 пациентов, из них выявили 176 пациентов с соответствующим типом HLA. В итоге в исследование было включено 59 больных, которым был проведен лейкоферез, 37 из этих пациентов на данный момент получили лечение Т-клетками. С точки зрения безопасности одним из нежелательных явлений, представляющих особый интерес, является синдром высвобождения цитокинов, что было зафиксировано у 59% пациентов, хотя 3 степень токсичности составила не более 3%. Другими наиболее частыми нежелательными явлениями были цитопении (нейтропения, тромбоцитопения, анемия), частота 3 степени токсичности для каждой не превышала 8% (анемия). Частота объективных ответов составила 39,4%, а частота контроля над заболеванием – 85% (рис.1).
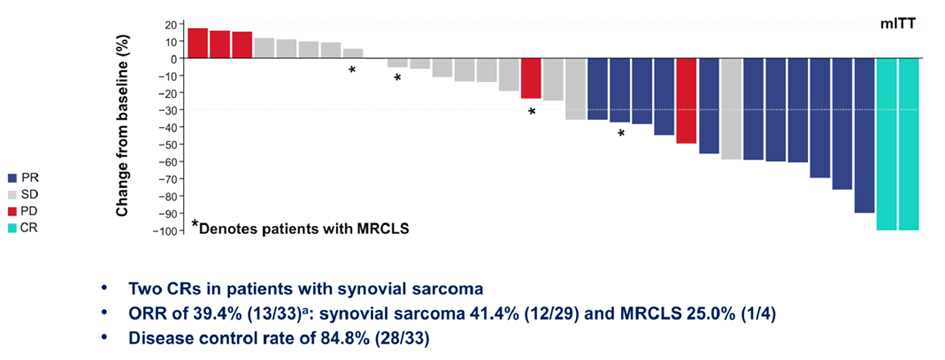
Рисунок 1. Sandra P. D'Angelo et al. SPEARHEAD-1.
Было оценено 29 пациентов с синовиальной саркомой и 4 пациента с миксоидной/круглоклеточной липосаркомой. У одного из пациентов с миксоидной/круглоклеточной липосаркомой и у 12 больных с синовиальной саркомой зафиксированы объективные ответы. При этом у 2 пациентов с синовиальной саркомой достигнут полный ответ. Средняя продолжительность ответа не достигнута, и наблюдение за этими пациентами продолжается. Таким образом, данное исследование показывает ранние, но обнадеживающие результаты с точки зрения эффективности и безопасности. Исследование продолжается, как и активный набор пациентов (NCT04044768). Результаты работы могут представлять собой многообещающую терапевтическую опцию для пациентов с соответствующим типом HLA и экспрессией антигена, что говорит о важности подбора соответствующей когорты больных. Открытым остается вопрос эффективности терапии при других гистологических подтипах сарком, не стоит забывать, что в данное исследование были включены те типы сарком, которые отличаются своей высокой чувствительностью к лекарственному лечению. Проведение соответствующего лечения требует развитой инфраструктуры и мощности клинического центра, что в очередной раз подтверждает: пациенты с саркомами должны получать лечение в референсных центрах.
Другое исследование II фазы по оценке эффективности олапариба и темозоломида при распространенной лейомиосаркоме матки основано на том, что лейомиосаркома матки связана с относительно высокой частотой дефицита гомологичной рекомбинации [2]. Примерно 20% лейомиосарком матки попадают в эту категорию, что выше, чем при других типах сарком в целом (9,3%) [3]. При дефиците гомологичной рекомбинации ингибиторы PARP являются эффективными или оказывают свое действие, блокируя репарацию PARP однонитевых разрывов ДНК. Эти разрывы ДНК могут происходить по разным причинам, включая лечение химиотерапевтическими препаратами, повреждающими ДНК, такими как темозоломид. Невосстановленные, однонитевые разрывы ДНК могут привести к двухнитевым разрывам или остановке репликативных вилок. Это дефекты, которые обычно устраняются путем гомологичной рекомбинации. Но в опухолях с дефицитом гомологичной рекомбинации эти повреждения ДНК могут привести к геномной нестабильности и гибели опухолевых клеток. Пациенты в данном исследовании должны были получить по крайней мере одну линию системной терапии по поводу диссеминированного заболевания. Первичной конечной точкой исследования была частота объективных ответов в течение шести месяцев. Лечение включало комбинацию перорального приема препаратов темозоломида (75 мг/м2) и олапариба (200 мг 2 раза в сутки), с 1-го по 7-й дни и интервалом в 21 день. Двадцать четыре пациента были включены в исследование в течение 6 месяцев в нескольких центрах. Средний возраст больных составил 55 лет; 59% пациентов прошли по крайней мере три предшествующих линии системного лечения. В исследовании токсичность чаще всего представляла собой цитопению (77%), с которой можно было справиться уменьшением дозы препаратов, она не являлась большой клинической проблемой. Исследование достигло своей основной конечной точки: у пяти (23%) пациентов наблюдался объективный ответ в течение первых шести месяцев лечения. У шести пациентов (27%) достигнут частичный ответ, у девяти пациентов (41%) – стабилизация. Медиана ВБП составила 6,9 месяца. Средняя продолжительность ответа составила 12 месяцев. Анализ биомаркеров продолжается.
Следующее исследование касается определения молекулярных предикторов ответа на селинексор при диссеминированной неоперабельной дедифференцированной липосаркоме [4]. Ингибиторы CDK4/6 не одобрены FDA для использования при этом заболевании. Но по данным некоторых исследований была выявлена активность данной группы препаратов при лечении недифференцированной липосаркомы (абемациклиб – медиана ВБП 30 недели, 3-месячная ВБП 76%; палбоциклиб – мВБП 17,9 недель, 3-месячная ВБП 57,2%, [5,6]). Exportin 1 или XPO1 – это ядерный экспортный белок, который жестко регулирует транспорт белков из ядра клетки. Exportin 1 гиперэкспрессируется при ряде злокачественных заболеваний. Гиперэкспрессия связана с нерегулируемым ядерным экспортом белков-супрессоров опухоли и белков регуляции клеточного цикла. Эта чрезмерная экспрессия связана с резистентностью к лечению и плохим прогнозом. Селинексор – селективный ингибитор ядерного экспорта, который подавляет XPO1. Это ингибирование приводит к накоплению в ядре супрессоров опухолевого роста, что приводит к остановке клеточного цикла и апоптозу. Эта активность была отмечена для ряда типов опухолей, а препарат одобрен FDA для лечения множественной миеломы и диффузной В-клеточной лимфомы. В исследовании I фазы с включением нескольких типов сарком было отмечено, что у 1/3 (33%) пациентов стабилизация заболевания продолжалась более 4 месяцев [7]. Были выделены пациенты с дедифференцированной липосаркомой: у 47% пациентов стабилизация заболевания длилась 4 месяца или более, у 40% пациентов отмечалось уменьшение размеров опухоли. Эти предварительные результаты явились предпосылкой к исследованию SEAL, которое представляет собой рандомизированное исследование II/III фазы с включением пациентов с распространенной дедифференцированной липосаркомой, у которых было не менее двух предшествующих линий системной терапии (NCT02606461). Пациенты были рандомизированы на две группы: селинексор или плацебо. Исследование достигло своей первичной конечной точки – выживаемости без прогрессирования заболевания. Но общие впечатления от улучшения выживаемости без прогрессирования заболевания, хоть и статистически значимые (p=0,0114), клинически были довольно скромными. ВБП в группе с селинексором составила 2,8 месяца, тогда как в группе плацебо – 2 (HR 0,70). Однако авторы исследования продолжили анализ уже внутри набранных пациентов с целью поиска биомаркера, идентифицирующего пациентов, у которых наиболее вероятно будет наблюдаться значимый клинический эффект при лечении селинексором. Были выделены группы пациентов, у которых при лечении селинексором опухоль явно увеличивалась или явно уменьшалась в размерах, и выполнен анализ на экспрессию генов. Ген CALB1, или кальбиндин, наиболее существенно экспрессировался у пациентов с резистентной опухолью. В то же время у пациентов с опухолями, чувствительными к селинексору, не выявлена экспрессия кальбиндина. Экспрессия кальбиндина коррелировала с мВБП у пациентов, получавших селинексор: для кальбиндин-отрицательных пациентов мВБП составила 6,9 месяца, для кальбиндин-экспрессируюших – 1,68 месяца (HR 0,45; p=0,033). В настоящее время продолжаются и другие исследования по оценке эффективности селинексора, однако определение экспрессии CALB1 выглядит потенциально ценным биомаркером, который может позволить нам увеличить терапевтическую пользу для пациентов от данной терапии.
И заключительная работа, на которой хочется остановить свое внимание, – это исследование III фазы APROMISS (AL3818) по оценке эффективности анлотиниба/катеквентиниба в монотерапии по сравнению с дакарбазином при диссеминированной синовиальной саркоме [8]. Катеквентиниб/анлотиниб (AL3818) представляет собой множественный ингибитор тирозинкиназы (ТКI) для перорального применения, нацеленный на VEGFR1-3, FGFR1-3, PDGFR-β и cKIT. Критерием включения, помимо гистологического типа, было предшествующее системное лечение, включающее антрациклины. Важным нюансом была возможность включать пациентов, которые ранее получали пазопаниб (также относящимся к мультиингибиторам тирозинкиназ). Катеквентиниб 12 мг/сут. принимался ежедневно в течение двух недель, далее неделя перерыва; таким образом, цикл составлял 21 день. Дакарбазин в дозе 1000 мг/м2 вводился в/в 1 раз в 21 день. В результате в группе катеквентиниба наблюдалась более длительная мВБП, чем в группе дакарбазина: 2,89 и 1,64 месяца соответственно (HR 0,449; p=0,0015). Токсичность, наблюдаемая в исследовании, характерна для класса препаратов VEGF-TKI в целом: диарея, гипертензия. Данное рандомизированное исследование является первым, сравнивающим VEGF-TKI при саркомах мягких тканей с активным препаратом. В этом исследовании VEGF-TKI оказался лучше дакарбазина с точки зрения ВБП. Улучшение выживаемости без прогрессирования было умеренным, но статистически значимым. Что действительно интересно, так это сравнение эффективности других ингибиторов тирозинкиназы с пазопанибом, одобренным для пациентов с диссеминированными саркомами мягких тканей. Исследования, сравнивающие эти препараты, не проводились. В настоящее время не существует надежного биомаркера для выявления пациентов, которым эти препараты с наибольшей вероятностью принесут пользу. Возможно исследования, сочетающие ингибиторы тирозинкиназ с такими методами лечения, как ингибирование иммунных контрольных точек, покажут дальнейшие успехи в этой области.
Ссылки: