19.10.2021

28 сентября и 5 октября 2021 года в онлайн формате состоялся мастер-класс ESTRO FALCON по стереотаксической лучевой терапии рака легкого. Целями мастер-класса, в котором приняли участие более 40 радиотерапевтов и радиационных онкологов из разных стран мира, были обозначены улучшение навыков контуринга таргетных и критических структур при стереотаксической радиотерапии (SBRT) рака легкого, а также анализ и сравнение контуров участников с гайдлайнами ESTRO и контурами экспертов. В ходе мастер-класса и последующей дискуссии были определены основные показания к SBRT (на этот раз с поправками на условия пандемии COVID-19), клинические сценарии при планировании SBRT рака легкого и обсуждены основные проблемы, возникающие при прецизионном оконтуривании.
Эксперт Ahmed Salem из онкологического центра The Christie NHS Foundation Trust (Манчестер, Великобритания) предлагает следующие критерии для отбора пациентов на SBRT рака легкого:
При выполнении вышеописанных критериев отбора был предложен следующий сценарий окончательного принятия решения о проведении SBRT рака легкого (мнение онкологического центра The Christie):
Смена режимов и суммарных очаговых доз (СОД) также возможна на усмотрение лечащего врача в зависимости от коморбидного фона или статуса общего состояния пациента (например, отказ от рекомендуемой трехфракционной схемы в пользу пятифракционной или восьмифракционной). Однако туморицидный эффект может быть реализован только при условии достижения биологической эффективной дозы на первичную опухоль (BED10) ≥100 Гр (рис.1).
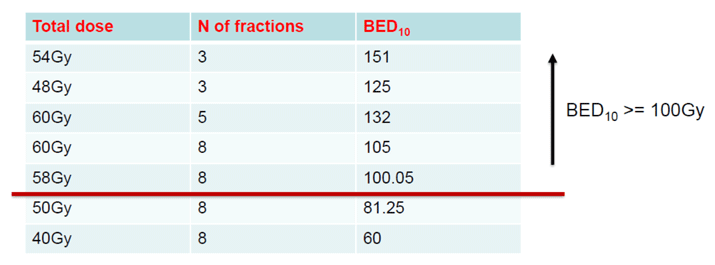
Рисунок 1. Оптимальные туморицидные СОД и BED10 при гипофракционированной лучевой терапии и SBRT рака легкого.
В настоящее время методика SBRT находится в условиях дефицита убедительных руководств и гайдлайнов по оконтуриванию таргетных и критических структур: всего 6% (8 из 142) гайдлайнов по состоянию на 2020 год посвящены определению объемов облучения при лучевой терапии рака легкого и опухолей грудной клетки, из них всего 2 руководства посвящены оконтуриванию как первичной опухоли, так и органов риска, и только 1 руководство посвящено SBRT [2]. Эксперт Jose Lopez из университетской клиники Virgen del Rocio (Севилья, Испания) с опорой на атлас Kong et al. [3] рекомендует к оконтуриванию при SBRT рака легкого следующие критические структуры: сердце, пищевод, легкие, спинной мозг, проксимальный отдел бронхиального дерева, плечевое сплетение, грудную стенку, крупные сосуды, печень и желудок, кардиостимулятор.
Единых стандартов к оконтуриванию сердца на данный момент не существует, что связано с большим количеством разночтений и проблем при определении необходимого объема оконтуривания: невозможность достаточно точно графически определить объемы миокарда, клапанов сердца, коронарных артерий и прочих из-за погрешностей при дыхательных движениях, отсутствия данных о дозных ограничениях на сердечные подструктуры, разночтений в принципиальных подходах к оконтуриванию (включение или исключение из объема сердца перикарда и крупных сосудов). Позитивный вклад в выживаемость пациентов без острого коронарного синдрома при ограничении доз на левый желудочек, левое предсердие, переднюю нисходящую ветвь левой коронарной артерии достаточно изучен и сомнений не вызывает (чему был посвящен целый раздел номера 152 журнала Radiotherapy & Oncology за ноябрь 2020 года [4]). Однако данных о дозных ограничениях на вышеуказанные структуры при SBRT на сегодняшний момент все еще не существует. Рекомендации NCCN 2021 года по дозным ограничениям при SBRT предписывают лимиты доз только на сердце/перикард и крупные сосуды [5]. Важно отметить, что дозные ограничения на критические структуры, регламентированные Американской ассоциацией медицинских физиков (доклад TG101 от 2010 года), более не используются.
В случае SBRT рака легкого и наличия у пациента кардиостимулятора рекомендованы обязательный осмотр кардиолога, тщательный расчет дозы на кардиостимулятор, дислокация поля облучения в случае прохождения через кардиостимулятор, наличие протокола мероприятий в случае ургентной кардиологической ситуации во время лучевой терапии.
Необходимость оконтуривания грудной стенки при SBRT, по мнению Jose Lopez, также остается спорным моментом ввиду недостаточности данных крупных исследований [6], однако UK SABR Consortium 2019 версии 6.1 в исчерпывающем объеме описывает технологию оконтуривания и дозные ограничения для данной критической структуры.
Оконтуривание ребер в качестве критических структур имеет большое значение при опухолях, располагающихся в непосредственной близости от грудной стенки или инвазирующих последнюю в случае T3. Риск перелома ребра в случае покрытия его объема 2 см3 в дозе 16 Гр за 3 фракции возрастает до 50% [7].
Мастер-класс FALCON продемонстрировал значительные различия в оконтуривании участниками как первичного опухолевого объема (учитывая даже дополнительные данные ПЭТ), так и практически всех заявленных критических структур. Разница в определении объемов пищевода и трахеи была минимальной. Наибольшие трудности вызвал контуринг проксимального отдела бронхиального дерева, сердца и плечевого сплетения (даже при использовании метода Тиммермана с контурингом пространства между ключицей и первым ребром [8]). Различия в оконтуривании представлены на рисунках 2-4.
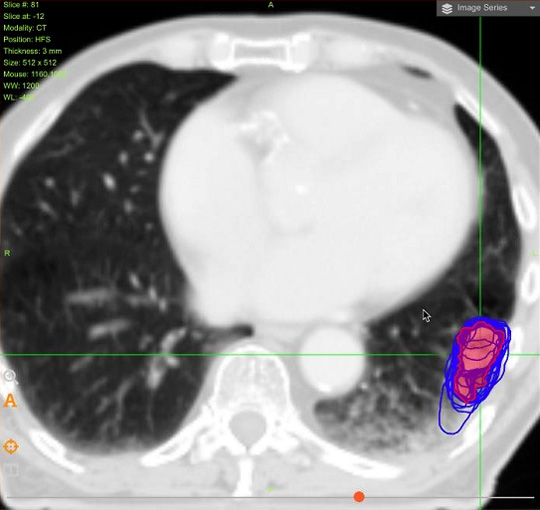
Рисунок 2. Отличия в оконтуривании GTV участниками мастер-класса (синие контуры) и объема эксперта (розовый).
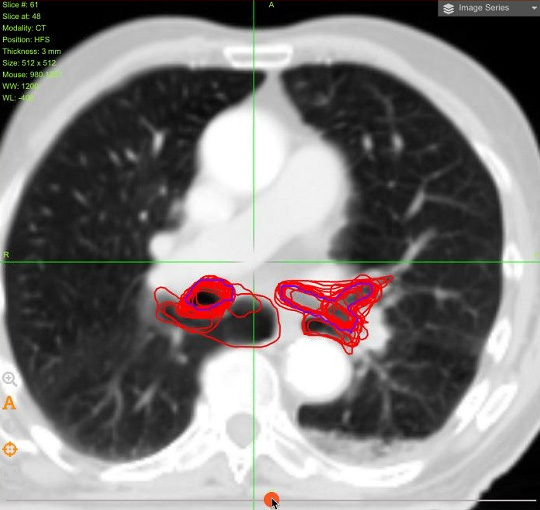
Рисунок 3. Различия в оконтуривании проксимального отдела бронхиального дерева участниками мастер-класса (красные контуры).
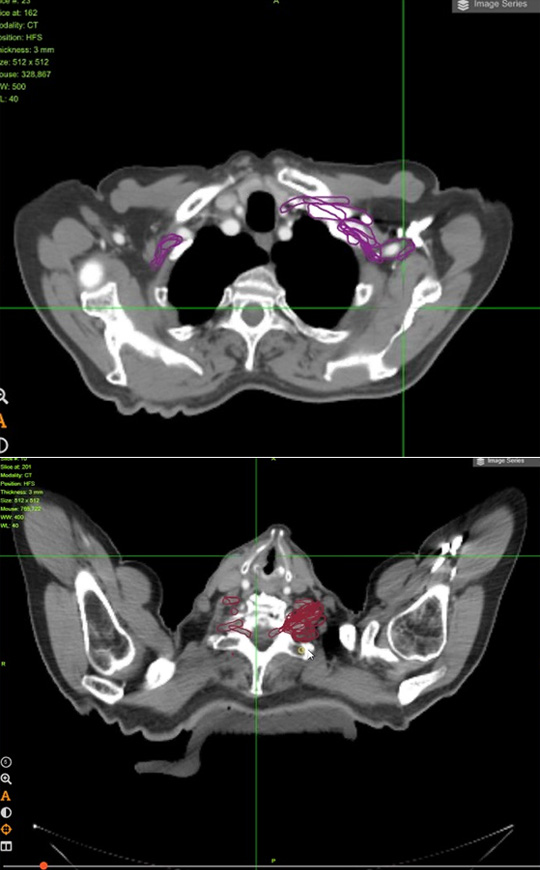
Рисунок 4. Различия в оконтуривании левого плечевого сплетения участниками мастер-класса (фиолетовые и коричневые контуры).
SBRT немелкоклеточного рака легкого в настоящий момент – метод выбора радикального лечения пациентов ранних стадий, не подлежащих хирургическому лечению. В России тренд на внедрение и активное использование SBRT в последние годы особенно заметен, что связано с появлением весомой доказательной базы эффективности методики и существенным апгрейдом радиотерапевтической аппаратуры в рамках Федерального проекта не только в крупных исследовательских институтах, но и в региональных онкологических службах. Заслуживает пристального внимания обеспечение качества проводимой подготовки к SBRT на этапах оконтуривания целевых и критических структур, подбора режима фракционирования и оценки дозной нагрузки с прогнозированием возможных осложнений. Появление отечественных гайдлайнов и протоколов, регламентирующих выполнение вышеозначенных этапов, должно привести к более взвешенной и качественной имплементации метода SBRT в рутинную радиотерапевтическую практику.
Источники: