А.Н. Махсон, Н.Б. Брандт, С.Г. Алексеев, Е.Н. Новожилова, М.В. Новожилов,
Г.А. Миронова, А.Н. Баранов, С.В. Главацкий, М.В. Скориков, Л.Н. Ривнячок
Московская городская клиническая онкологическая больница № 62,
МГУ им. М.В. Ломоносова, Москва
В России, как и в большинстве развитых стран мира, отмечается тенденция к неуклонному росту заболеваемости злокачественными новообразованиями и смертности от них. Абсолютное число ежегодно заболевших злокачественными опухолями в нашей стране составляет около полумиллиона человек. Причем от 60% до 80% онкологических больных обращаются за медицинской помощью с наличием запущенных (III-IV) стадий заболевания, когда возможности радикального лечения весьма ограничены. Поэтому, несмотря на разработку и применение новых методов лечения, в течение 1 года после установления диагноза умирают около 50% пациентов. Таким образом, для населения России злокачественные опухоли являются острой медицинской и социальной проблемой.
Одним из приоритетных направлений в борьбе со злокачественными опухолями является разработка принципиально новых методов ранней диагностики новообразований. Несмотря на большое количество современных диагностических методик, универсального экспресс-метода формирования групп онкологического риска при массовом скрининговом обследовании населения не существует.
По определению ВОЗ под скринингом подразумевается «обследование пациентов, которое может проводиться быстро и в массовом порядке и приводить к сортировке пациентов и отделению «возможно больных» от «возможно здоровых». Большинство методов диагностики не могут быть использованы в скрининге из-за трудоемкости и дороговизны. Существующие методы скрининга малоэффективны и позволяют выявить опухоли не более чем у 2% обследованных лиц.
Разработанный нами способ формирования группы онкологического риска и аппаратура для его реализации основаны на использовании одного из методов лазерной корреляционной спектроскопии водных растворов нативной сыворотки крови.
Благодаря успехам иммунологии и молекулярной биологии за последние 10-15 лет существенно расширились наши представления о механизмах возникновения и развития опухолей. Процесс онкогенеза в сжатой форме можно представить следующим образом. В результате воздействия различных факторов (химических, физических, эмоциональных, гормональных, вирусных и др.) в клетке происходят поломки в геноме, что приводит в свою очередь к изменению структуры белка. Нет сомнений в том, что нарушения функции онкогенов и антионкогенов являются важнейшими в процессе малигнизации. Особенности метаболизма раковых клеток обуславливают синтез веществ разной природы: антигенов, гормонов, эктопических ферментов, гликопротеидов и гликопротеинов, патологических белков, метаболитов, продуктов деградации и репарации отдельных элементов опухолевых клеток. Мы предположили, что при всех видах злокачественных опухолей в крови образуется неспецифический комплекс онкомаркеров. Низкая иммуногенность белков комплекса обеспечивает их накопление в крови на самых ранних стадиях заболевания.
Количество неспецифических онкогенов в крови можно оценивать, считая, что оно по порядку величины, соответствует количеству специфических онкогенов. На ранних стадиях заболевания концентрация онкогенов столь мала, что не может быть обнаружена оптическими методами. Мы предположили, что комплекс онкогенов взаимодействует с нормальными макромолекулами сыворотки крови и вызывает в них специфические изменения, которые можно регистрировать биофизическими методами.
Нами были проведены исследования сыворотки крови 460 пациентов методами классической корреляционной и обычной спектроскопии, и было установлено, что величина интенсивности и функция распределения частиц по размерам непрерывно изменяется во времени и зависит как от технологии приготовления сыворотки, так и от индивидуальных особенностей каждого человека. При этом нет четкой и устойчивой корреляции с заболеваниями и физиологическими состояниями пациентов. Кроме того, было установлено, что все параметры, связанные с трансляционной подвижностью макромолекул обладают низкой диагностической эффективностью.
В ходе научных экспериментов было установлено, что белковые молекулы сыворотки крови здоровых людей и больных со злокачественными опухолями по разному реагируют на воздействия внешних химических и физических факторов (кислоты и щелочи, СВЧ-воздействие). Таким образом, если в норме после действия внешнего раздражителя белковые молекулы возвращаются в свое прежнее пространственное (конформационное) состояние, то у больных со злокачественными опухолями они не могут принять свое прежнее пространственное соотношение, что приводит к изменению их внутренней динамики.
На основании проведенных нами исследований сыворотки крови методами корреляционной, романовской и обычной спектроскопии, люминесцентными методами, а также методами триплет-триплетного переноса электронного фотовозбуждения было установлено, что наиболее специфическими и устойчивыми для онкологии являются следующие изменения свойств макромолекул:
Следует отметить, что в диагностических целях до сих пор, насколько нам известно, эти параметры не использовались.
Нами был разработан и создан специальный лазерный корреляционный спектрофотометр «Онрис-1», позволяющий непосредственно получать информацию об указанных выше свойствах макромолекул сыворотки крови без привлечения каких-либо априорных предположений или моделей.
Практически определяются 14 параметров, характеризующих изменения свойств макромолекул в водных растворах сыворотки крови в зависимости от воздействия на нее третьих компонентов (два химических реактива и СВЧ-воздействие). Эти параметры для удобства представляются в виде одного обобщенного цифрового показателя и на двухмерной диаграмме.
«Онрис-1» отличается высокой степенью автоматизации, полностью исключающей влияние оператора на результаты тестирования, малым количеством сыворотки крови (0,5 мл.), необходимой для диагностики, малогабаритностью (вес около 6 кг) и не имеет аналогов в медицинской практике. Время одного тестирования 8 минут.
Основной задачей исследования было определение возможностей данного метода в диагностике злокачественных опухолей.
Исследование проводилось на базе Московской городской клинической онкологической больницы №62 слепым методом. Клинический диагноз злокачественной опухоли у всех больных был подтвержден морфологически. Образцы крови перед лабораторным исследованием зашифровывались, и после специальной подготовки сыворотка подвергалась исследованию. После завершения обследования производилось сравнение клинического диагноза и результатов лабораторного заключения.
В исследование включены 700 человек в возрасте от 17 до 84 лет (средний возраст составил 46+2,3 года): 508 женщин и 192 мужчины. Все испытуемые были разделены на 2 группы. Основную группу составили 613 больных, которые поступили в больницу с подозрением на опухоль. Вторую группу составили 87 добровольцев без каких-либо жалоб (сотрудники больницы и их родственники). В процессе обследования было установлено, что у 448 из 613 пациентов, госпитализированных в больницу, имели место злокачественные опухоли, у 143 - доброкачественные, у 23 выявлены неопухолевые заболевания. Данные о локализации злокачественных опухолей представлены в табл. 1.
Таблица 1.
Локализации злокачественных опухолей.
| Локализация опухоли | Количество больных | % |
|---|---|---|
| Молочные железы | 86 | 19,2 |
| Женские половые органы | 108 | 24,2 |
| Желудочно-кишечный тракт | 61 | 13,7 |
| Мочеполовая система | 51 | 11,4 |
| Кожа | 17 | 3,9 |
| Системные заболевания | 18 | 4,0 |
| ЛОР-органы | 52 | 11,7 |
| Щитовидная железа | 24 | 5,3 |
| Легкие | 30 | 6,6 |
| Всего | 448 | 100 |
Таблица 2.
Локализация доброкачественных опухолей.
| Локализация опухолей | Количество больных | R* | N** |
|---|---|---|---|
| Мягкие ткани | 17 | 14 | 3 |
| Женские половые органы | 29 | 26 | 3 |
| Молочные железы | 44 | 36 | 8 |
| Кожа | 9 | 7 | 2 |
| Щитовидная железа | 8 | 6 | 2 |
| Почки | 10 | 8 | 2 |
| Слюнные железы | 4 | 4 | - |
| ЛОР-органы | 7 | 5 | 2 |
| Легкие | 15 | 10 | 5 |
| Всего | 143 (100%) | 116 (81,1%) | 27 (18,2%) |
На основе обобщенного цифрового параметра исследования сыворотки крови прибор выдает два варианта ответов: «R» – риск заболевания злокачественной опухолью и «N» – отсутствие риска заболевания злокачественной опухолью. Результаты могут быть графически отображены на координатной плоскости: если значения диагностических показателей находились в правом секторе, то это трактовалось как норма. Значения с противоположной стороны от пограничной линии соответствовали патологии (рис. 1).
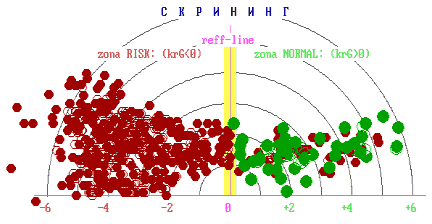
Принимая во внимание только ответ «R», мы получали информацию о наличии или отсутствии патологического процесса по обобщенному цифровому параметру, однако не могли провести дифференциальную диагностику доброкачественных опухолей от злокачественных. Для решения этого вопроса на втором этапе потребовалась оценка формы спектров. При этом мы получили дополнительную информацию, которая позволила нам отличить доброкачественную опухоль от злокачественной. В процессе работы нами были выявлены некоторые закономерности: наиболее рельефно различия выглядели в группе здоровых добровольцев и больных со злокачественными опухолями. Так у здоровых людей формируются спектры в виде одного максимума, при доброкачественных опухолях - в виде двух-трех плавных максимумов, при злокачественных новообразованиях - «многогорбые широкие спектры» (рис. 2).
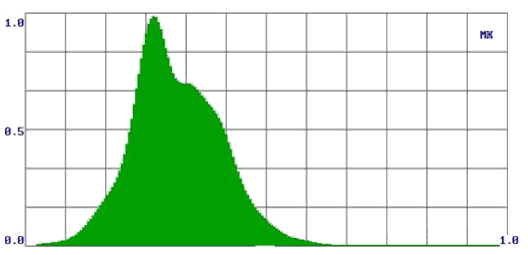
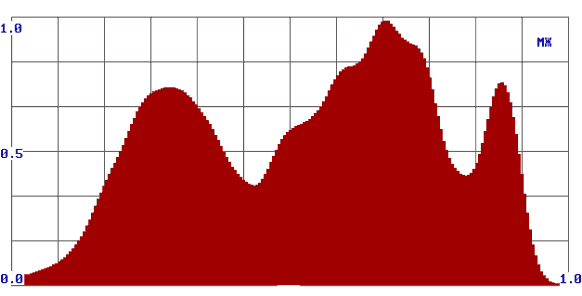
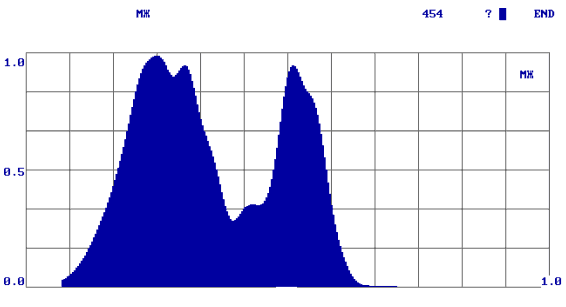
Рис. 2.
Формы спектров при различных видах патологии (а – здоровые лица; б – злокачественные опухоли; в – доброкачественные опухоли).
Для количественной оценки диагностических возможностей метода использовались критерии чувствительности и специфичности. Чувствительность - способность диагностировать онкологическое заболевание при обследовании онкологических пациентов. Специфичность - способность диагностировать отсутствие заболевания при обследовании неонкологических больных и практически здоровых людей. Мы изучали влияние ряда клинических параметров на результат исследования.
Оценка результатов теста в зависимости от стадии опухоли позволила придти к заключению, что величина опухоли существенно не влияет на результаты исследования, т.е. метод не обладает стадиоспецифичностью. Ложноотрицательные результаты встречалась примерно с одинаковой частотой при всех стадиях, что наиболее ценно для диагностики так называемых «малых ранних раков» (табл. 3).
Таблица 3.
Частота ложноотрицательных результатов при разных стадиях опухолевого процесса.
| Стадии | I | II | III | IV | Всего |
|---|---|---|---|---|---|
| Количество | 102 | 159 | 113 | 74 | 448 |
| Ложноотрицательные результаты (%) | 1918,6% | 1610% | 1916,8% | 79,5% | 6113,6% |
Изучили также влияние морфологического строения опухоли на результат исследования. Известно, что наиболее часто встречаются плоскоклеточные и железистые раки. В качестве модели плоскоклеточных раков мы проанализировали группу больных раком легкого (30 человек) и группу больных с опухолями головы и шеи (52 человека).
Для больных раком легкого чувствительность метода составила 90%, ложноотрицательных ответов было 10%. При раке органов головы и шеи наличие опухоли лабораторным путем было подтверждено у 92,4% больных. Следует отметить, что для плоскоклеточных раков этот метод характеризуется высокой достоверностью и не обладает выраженной органоспецифичностью. Для сравнения мы проанализировали сравнительно большую группу больных раком молочной железы (86 человек). Чувствительность метода в этой группе составила-94,2% (ложноотрицательных. ответов - 5,8%). При изучении группы больных с опухолями женских половых органов (аденокарциномы эндометрия - 102 человека) диагностическая ценность метода была ниже и составила 81,4%. В то время как для опухолей желудка и кишечника (аденокарциномы - 61 человек) чувствительность оказалась равной 83,6%. Для светлоклеточных раков почки (40 человек) чувствительность составила 90% (табл. 4).
Таблица 4.
Чувствительность метода в зависимости от морфологии злокачественной опухоли.
| Морфологическая форма | Локализация | Число больных | Чувствительность метода | Ложноотрицательные результаты (%) |
|---|---|---|---|---|
| Железистые | Молочные железы | 86 | 94,2% | 5 (5,8%) |
| Тело матки и яичники | 102 | 81,4% | 19 (18,6%) | |
| Желудочно-кишечный тракт | 61 | 83,6% | 10 (16,3%) | |
| Плоскоклеточные | ЛОР-органы | 52 | 92,4% | 4 (7,6%) |
| Легкое | 30 | 90,0% | 3 (10,0%) | |
| Почечно-клеточные | Почка | 40 | 90,0% | 4 (10,0%) |
| Высокодифференцированные | Щитовидная железа | 24 | 84% | 4 (16,6%) |
| Прочие гистологические формы | 53 | 92,5% | 4 (7,5%) | |
| Всего | 448 | 88,2% | 53 (11,8%) |
При лазерной корреляционной спектроскопии у 10 из 87 добровольцев был установлен риск опухолевой патологии. После детального обследования у 3 из них выявлены злокачественные опухоли (рак яичников, базально-клеточный рак слизистой перегородки носа и меланома кожи пальца кисти с метастазами в подмышечные лимфоузлы), а у 2 - доброкачественные опухоли (аденома щитовидной железы, фолликулярная киста яичника). У остальных 5 человек опухолевой патологии на момент обследования не выявлено, и они оставлены под динамическим наблюдением. Таким образом, число ложно-положительных ответов среди добровольцев составило 8% (7 человек).
Мы попытались оценить возможности метода в мониторинге эффективности лечения. В процессе лечения были обследованы 23 больных со злокачественными опухолями различных локализаций. Все больные оперированы, и диагноз подтвержден морфологически. Забор крови для исследования поводили перед началом лечения, через 10 дней и 1 мес. после операции. Следует отметить, что на 10-ые сутки после операции у всех больных лабораторный показатель оставался в зоне риска, хотя имелась тенденция к его улучшению (приближению к норме). Через 1 месяц у половины обследованных больных лабораторные показатели нормализовались.
Таким образом, отмечена эффективность и высокая чувствительность метода в выявлении злокачественных опухолей человека. Даже с помощью пока недостаточно отработанных начальных исследований в клинике, ложноотрицательные результаты получены лишь в 4-18% случаев, а ложноположительные ответы у здоровых людей не превышали 7%. Метод отличается низкой себестоимостью, малогабаритностью, аппаратуры, высокой скоростью исследований. Развитие его имеет ряд перспектив как при массовом обследовании здоровых людей в режиме скрининга, так и в сочетании с традиционными методами диагностики онкологических заболеваний, а так же для оценки эффективности лечения. Учитывая все вышеизложенное, необходимо расширить исследования в этой области с целью дальнейшего изучения возможностей применения метода и скорейшей разработки и внедрения в клиническую практику стандартных методик, приемлемых для любых медицинских учреждений.