
13-17 мая 2005 года, Орландо, США
Трякин А.А.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Рак желудка
Адъювантная терапия рака желудка и пищеводно-желудочного перехода.
Доложенные в 2001г результаты Intergroup study 0116 установили в США новый стандарт адъювантной терапии у больных раком желудка [1]. В этом исследовании послеоперационная лучевая терапия (СОД 45Гр) на фоне химиотерапии 5-фторурацилом и лейковорином достоверно улучшила результаты одного хирургического лечения. Однако эти результаты подвергаются справедливой критике. Так, D2 и D1 лимфодиссекция была выполнена 10% и 36% больным соответственно, а у половины пациентов ее уровень составил D0! Поэтому значение адъювантной химиолучевой терапии у оптимально прооперированных (D2 лимфодиссекция) больных остается не определенным.
На ASCO 2005 Cunningham представил обновленные результаты исследования MAGIC, в котором больные с операбельной аденокарциномой желудка, пищеводно-желудочного перехода и нижнегрудного отдела пищевода рандомизировались в группу оперативного лечения ± химиотерапия [2]. Программа химиотерапии включала предоперационно 3 курса режима ECF (эпирубицин 50 мг/м² и, цисплатин 60 мг/м² 1 день каждые 3 недели, 5-фторурацил 200 мг/м²/день непрерывная постоянная инфузия,) и 3 курса после оперативного вмешательства. За 8 лет в исследование было включено 503 пациента. Химиотерапия достоверно уменьшила риск прогрессирования на 34% и риск смерти на 25% по сравнению с хирургическим лечением только. Удалось достоверно повысить 5-летнюю ОВ с 23% до 36% за счет уменьшения частоты как локорегионарных, так и отдаленных рецидивов. В настоящее время в США проводится исследование, в котором к ECF добавлена лучевая терапия в попытке дальнейшего улучшения результатов, полученных в исследовании Intergroup 0116.
Системная терапия распространенного рака пищевода и рака желудка
На сегодняшний день нет общепринятого режима для лечения распространенного рака желудка. Используются различные комбинации на основе фторпиримидинов и цисплатина. В США это режим PF (цисплатин 100 мг/м², 5-фторурацил 1000 мг/м²/день – 120-часовая инфузия), в Европе – упомянутый выше ECF. Из новых препаратов свою активность при раке желудка продемонстрировал доцетаксел. В исследовании ТАХ 325 стандартная комбинация PF сравнивалась с режимом доцетаксел (75 мг/м²) + цисплатин (75 мг/м²) + 5-фторурацил (750 мг/м²/день – 120-часовая инфузия) [3]. 457 пациентов участвовало в исследовании, их средний возраст составил 55 лет, у 96% имелись отдаленные метастазы. Добавление доцетаксела позволило увеличить время до прогрессирования с 3,7 мес. до 5,6 мес. (р = 0,0004), что выразилось в виде снижения риска прогрессирования на 32%. Экспериментальный режим также достоверно увеличил и 2-летнюю общую выживаемость с 9% до 18% (р = 0,02). Ценой этому была большая частота нейтропении, что, однако, не привело к повышению числа летальности от токсичности. Вероятнее всего, режим с доцетакселом необходимо использовать у молодых больных в хорошем общем состоянии.
В другом рандомизированном исследовании сравнивались комбинация IF (иринотекан 80 мг/м² 30-минутная инфузия, лейковорин 500 мг/м² 2-часовая инфузия, 5-фторурацил 2000 мг/м² 22-часовая инфузия, еженедельно, 6 недель) и режим цисплатин + 5-фторурацил (PF) [4]. 332 больных раком желудка и пищеводно-желудочного перехода приняли участие в исследовании. Основной задачей исследования было зафиксировать улучшение времени до прогрессирования. Комбинация с иринотеканом продемонстрировала большую частоту объективного ответа, чем режим PF – 32% и 25%. Однако время до прогрессирования достоверно улучшить не удалось – 5 мес. и 4,2 мес (р = 0,088) соответственно. Как и следовало ожидать, в группе IF наблюдалась большая частота диареи (22% и 7%). Полученные результаты свидетельствуют о возможности «безболезненной» замены цисплатина на иринотекан у больных, не подходящих по ряду причин (общее состояние, поражение почек) для терапии цисплатином.
Из существующих на сегодняшний день пероральных фторпиримидинов, наиболее известны капецитабин и UFT. Относительно новое производное четвертого поколения S-1 содержит 2 биохимических модулятора, позволяющих усиливать эффект 5-фторурацила. Японский опыт применения S-1 в монотерапии при распространенном раке желудка, включающий более 4000 пациентов, показал эффективность этого препарата – медиана выживаемости составила 8,3 мес., а 1-годичную выживаемость 33% [5]. На ASCO 2005 доложены результаты американского и европейского исследования использования комбинации S-1 с цисплатином [6]. Эффективность терапии была оценена у 41 пациента и составила 44%, а медиана времени до прогрессирования – 4,8 мес. Эти данные, вкупе с умеренной токсичностью, явились основанием для начала III фазы рандомизированного исследования, в котором сравниваются комбинации цисплатина + S-1 и цисплатин + 5-фторурацил.
Рак толстой кишки
Адъювантная терапия
Известно, что профилактический прием аспирина позволяет уменьшить риск развития рака толстой кишки (РТК), а на животных моделях он (как и другие ингибиторы СОХ2) способен ингибировать рост опухолей. Однако эффект аспирина в случае уже развившегося РТК неизвестен. Была проанализирована сопутствующая терапия у 830 больных III стадией РТК, участвовавших в рандомизированном исследовании (5-фторурацил/лейковорин ± иринотекан) [7]. Прием в течение полугода после операции аспирина и других ингибиторов COX-2 (но не парацетамола) сопровождался снижением риска рецидива и смерти вдвое. Однако до подтверждения этих результатов в рандомизированном проспективном исследовании нет оснований рекомендовать прием ингибиторов COX2 в качестве адъювантной терапии РТК.
С начала 1990-х годов стандартом адъювантной химиотерапии III стадии РТК являлась комбинация 5-фторурацила/лейковорина, назначаемая чаще всего в виде режима Мейо в течение 6 месяцев после операции. Появление новых препаратов, таких как оксалиплатин и иринотекан, показавших свою активность при метастатическом РТК, привело к изучению их роли в адъювантных программах (таблица 1). В 2004г были опубликованы результаты исследования MOSAIC [8]. 6 месяцев адъювантной химиотерапии комбинацией FOLFOX4 сопровождались достоверным улучшением 4-летней безрецидивной выживаемости (БРВ) на 8,7% при III стадии по сравнению с режимом LV5FU2 (снижение риска рецидива на 25%). При II стадии FOLFOX привел к снижению риска редукции на 20%, но различия не достигли статистической достоверности.
Таблица 1.
Основные режимы на основе 5-фторурацила, иринотекана и оксалиплатина, применяемые при раке толстой кишки.
| Режим | Схема |
|---|---|
| Мейо | Лейковорин (LV) 20 мг/м² в/в струйно с последующим стрйным введением 5-ФУ 425 мг/м², 1-5 дни. Интервал 28 дней. |
| Roswell Park | LV 500 мг/м² в/в 2-часовая инфузия с последующим струйным введением 5-ФУ 500 мг/м².Еженедельно в течение 6 недель. Интервал 8 недель. |
| LV5FU2 (режим De Gramont) | LV 200 мг/м² в/в в течение 2 часов с последующим струйным введением 5-ФУ 400 мг/м² и 22-часовой инфузией 5-ФУ 600 мг/м². Аналогичное лечение проводится и на второй день.Интервал 14 дней. |
| AIO | LV 500 мг/м² в/в в течение 2 часов с последующей 24-часовой инфузией 5-ФУ 2600 мг/м².Еженедельно, длительно. |
| FOLFIRI (упрощенный) | иринотекан 180 мг/м² 2-часовая инфузия в 1-й день, LV 400 мг/м² в/в в течение 2 часов с последующим болюсом 5-ФУ 400 мг/м² и 46-часовой инфузией 5-ФУ 2400-3000 мг/м². Интервал 14 дней. |
| FOLFOX 4 | Оксалиплатин 85 мг/м² 2-часовая инфузия в 1-й день, LV 200 мг/м² в/в в течение 2 часов с последующим струйным введением 5-ФУ 400 мг/м² и 22-часовой инфузией 5-ФУ 600 мг/м². Во второй день повторяется аналогичное введение LV и 5-ФУ. Интервал 14 дней. |
| FOLFOX 6 | Оксалиплатин 100 мг/м² 2-часовая инфузия в 1-й день, LV 400 мг/м² в/в в течение 2 часов с последующим струйным введением 5-ФУ 400 мг/м² и 46-часовой инфузией 5-ФУ 2400-3000 мг/м². Интервал 14 дней. |
Результаты MOSAIC были подтверждены в другом исследовании, доложенном на ASCO 2005. 2407 больных с II (28,6%) и III стадией РТК были рандомизированы на 3 курса (6 месяцев) режимом Roswell Park или аналогичный режим + оксалиплатин 85 мг/м² 1,3,5 недели каждого курса [9]. Токсичность обоих режимов существенно не различалась. Комбинация с оксалиплатином достоверно увеличила 3-летнюю БРВ с 71,6% до 75,6% (р < 0,004), уменьшив риск рецидива на 21%. Подтвердив аналогичную с MOSAIC редукцию риска рецидива, представленный режим с оксалиплатином является более удобным, чем FOLFOX, так как не требует постановки центральных венозных катетеров и портов, а также применения инфузионных помп, что гарантирует его широкое распространение.
К ASCO 2005г «поспели» два других рандомизированных исследования с иринотеканом. В первом из них, 400 пациентов с III стадией РТК получали комбинацию FOLFIRI либо LV5FU2 [10]. Группы больных были плохо сбалансированы по основным факторам прогноза, большее число пациентов с негативными прогностическими признаками (число пораженных лимфоузлов, сосудистая инвазия, периневральный рост) оказалось в группе FOLFIRI. Добавление иринотекана привело к большей гематологической токсичности. Различий в показателях БРВ выявлено не было. Интерпретация полученных результатов затруднительна.
Во втором исследовании (PETACC 3) 3278 пациентов с II/III стадией рандомизировались на 5-фторурацил/лейковорин (в виде режима AIO либо LV5FU2) ± иринотекан (80 мг/м² еженедельно либо 180 мг/м² каждые 2 недели, соответственно) [11]. Режим с иринотеканом несколько улучшил 3-летнюю БРВ в сравнении с 5-фторурацилом, однако различия не достигли статистической достоверности – 62,9% и 59,9% (р=0,076). Токсичность экспериментального режима была несколько выше.
На ASCO 2005 были представлены обновленные результаты ранее опубликованного исследования X-ACT, в котором больные III стадией РТК получали адъювантную химиотерапию режимом Мейо или капецитабином [12]. При медиане наблюдения 51 мес. была выявлена тенденция к улучшению БРВв группе капецитабина, которая почти достигла статистической достоверности (HR=0.87 [95% CI, 0.75–1.00], p=0.0525). Кроме того, токсичность капецитабина была значительно меньшей, чем болюсного 5-фторурацила.
Анализируя приведенные выше исследования, можно сделать следующие выводы:
Однако следует помнить, что вследствие недостаточности «зрелости» результатов, в исследованиях с оксалиплатином была улучшена лишь БРВ, но не общая выживаемость. Только достоверный выигрыш в последней позволяет с уверенностью рекомендовать новые режимы к рутинному применению. Кроме того, необходим поиск новых молекулярно-биологических прогностических факторов, позволяющих выделить те подгруппы пациентов II и III стадиями РТК, которые выигрывают от адъювантной химиотерапии. Эффективность таргетных препаратов (прежде всего, бевацизумаба) при метастатическом РТК, диктует необходимость их изучения в адъювантных программах.
Метастатический рак толстой кишки
С каждым годом успехи таргетной терапии удивляют нас все больше и больше. Вслед за иматинибом, трастузумабом и ритуксимабом арсенал врачей пополнился другими препаратами, среди которых применение при РТК нашли бевацизумаб (Авастин®) и цетуксимаб (Эрбитукс®). Наиболее интересные исследования при РТК, представленные на ASCO 2005, были связаны именно с этими двумя препаратами.
Бевацизумаб прошел необычный путь в лечении РТК. В отличие от других препаратов, которые последовательно доказывают свою эффективность в третьей, второй и лишь затем в первой линии терапии, бевацизумаб сразу завоевал позиции в первой линии. Так, в двух исследованиях добавление бевацизумаба к болюсному 5-фторурацилу/лейковорину [13] и режиму IFL (иринотекан и болюсный 5-фторурацил еженедельно) [14] позволило существенно повысить частоту объективного ответа и выживаемость (рис. 1). Следующим шагом стало подтверждение эффективности бевацизумаба во второй и третьей линиях терапии.

Рис. 1. Исследования III фазы применения бевацизумаба в I линии терапии РТК.
Исследование ECOG 3200.
На ASCO 2005 были сообщены результаты исследования ECOG3200, в котором пациенты, получавшие ранее иринотекан-содержащий режим (в основном IFL), были рандомизированы на 3 группы: FOLFOX4, FOLFOX4 + бевацизумаб и монотерапия бевацизумабом (рис. 2.) [15]. В данном исследовании использовались высокие дозы бевацизумаба (10 мг/кг каждые 2 недели вместо обычных 5 мг/кг). Этот выбор был обусловлен экспериментальными данными, свидетельствующих о дозозависимом эффекте бевацизумаба.
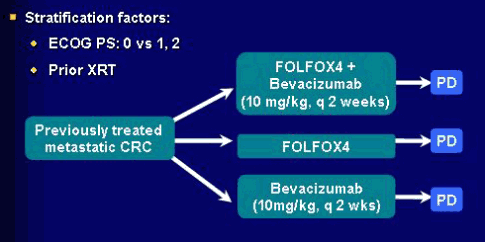
Рис. 2. Дизайн исследования ECOG 3200.
Добавление бевацизумаба к стандартному FOLFOX достоверно повысило частоту объективного ответа и показатели выживаемости (табл. 2). Монотерапия бевацизумабом оказалась малоэффективной.
Таблица 2.
Результаты исследования ECOG 3200.
| FOLFOX+bev | FOLFOX | Bevacizumab | |
|---|---|---|---|
| N больных | 282 | 279 | 228 |
| ОЭ# (%) | 21,8 | 9,2 | 3,0 |
| ВДП* (мес.) | 7,2 | 4,8 | 2,7 |
| ОВ (мес.) | 12,9 | 10,8 | 10,2 |
#ОЭ – общая эффективность, *ВДП – время до прогрессирования.
Анализ токсичности показал безопасность комбинации бевацизумаба с FOLFOX: бевацизумаб несколько увеличил частоту артериальных гипертензий, не повысив риска тромбозов/эмболий и кровотечений в сравнении с FOLFOX.
Исследование BOND-2
Результаты других исследований показали, что бевацизумаб не только усиливает эффективность химиотерапии, но также обладает синергизмом с другим таргетным препаратом – цетуксимабом. Как известно, последний обладает способностью восстанавливать чувствительность к иринотекану. В ранее проведенном большом европейском исследовании BOND-1 [16] больным с прогрессированием после иринотекана назначался цетуксимаб или цетуксимаб + иринотекан [17]. Комбинированный режим удвоил частоту объективных эффектов и почти утроил длительность времени до прогрессирования.
В исследовании BOND-2 пациенты (n=81) метастатическим РТК, рефрактерные к иринотекану, были рандомизированы на две группы: бевацизумаб (5 мг/кг каждые 2 недели) + цетуксимаб (400 мг/м² и далее 250 мг/м² еженедельно) и бевацизумаб + цетуксимаб + иринотекан (в том же режиме, что пациент получал ранее).
Кроме иринотекана, более 85% пациентов ранее уже получали и оксалиплатин. Добавление бевацизумаба позволило улучшить частоту объективных эффектов и времени до прогрессирования (табл. 3). Однако лучше эти результаты понимаются в призме данных BOND-1.
Таблица 3.
Результаты исследований BOND-1 и BOND-2.
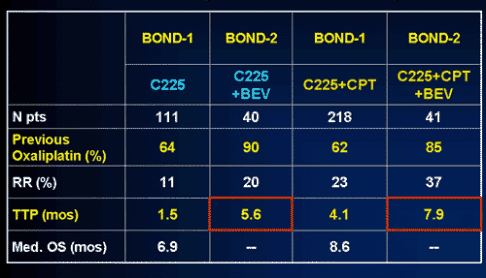
Хотя трудно и недостаточно корректно сравнивать последовательные исследования II фазы, вероятнее всего, добавление бевацизумаба усилило эффективность одного цетуксимаба и его комбинации с иринотеканом по показателям непосредственной эффективности и, даже более существенно, времени до прогрессирования. Последнее выглядит особенно весомо (5,6 мес.) в сравнении с мизерным 1,5-месячным временем до прогрессирования при монотерапии цетуксимабом. Сходный эффект наблюдается и группе цетуксимаб+иринотекан (4,1 мес. и 7,9 мес.). Несмотря на меньшую, по сравнению с исследованием E3200, дозу (5 мг/кг вместо 10 мк/кг), бевацизумаб сохранил свою эффективность.
Для изучения роли обоих препаратов в первой линии химиотерапии РТК в настоящее время начинается рандомизированное исследование CALGB 80405, в котором пациенты будут получать FOLFOX/FOLFIRI с цетуксимабом, бевацизумабом или с комбинацией обоих антител.
Известно, что бевацизумаб способен вызывать тромбозы и эмболии. С другой стороны, достаточное большое число пожилых больных длительно принимают аспирин как антиагрегант по поводу сопутствующей кардиальной патологии. С целью изучения безопасности одновременного применения бевацизумаба с аспирином был предпринят ретроспективный анализ результатов 3 рандомизированных исследований [18]. Оказалось, что совместный прием двух препаратов не увеличивает риска кровотечений. Более того, в группе больных высокого риска (> 65 лет с тромбозами/эмболиями в анамнезе) наблюдался даже некоторый протективный эффект. Однако для окончательного ответа о пользе применения аспирина у больных, получающих бевацизумаб, необходимо дальнейшие наблюдения.
Равнозначен ли капецитабин инфузиям 5-фторурацила?
В свое время капецитабин был создан как препарат, имитирующий инфузии 5-фторурацила, однако до сих пор не было прямых сравнительных исследований, доказывающих их эквивалентную эффективность. На ASCO 2005 стали доступны результаты сразу 3 исследований, посвященных данному вопросу.
В первом, небольшом исследовании III фазы из Италии, 100 пациентов в качестве первой линии химиотерапии получали режим FOX (5-фторурацил 250 мг/м²/день непрерывная инфузия + оксалиплатин 130 мг/м² каждые 3 недели) либо XELOX (капецитабин 2000 мг/м² 1-14 дни + оксалиплатин 130 мг/м² каждые 3 недели) [19]. Токсичность обоих режимов была практически идентична. Частота объективного эффекта в группах XELOX и FOX также не различалась (45,2% и 51,5%), но в режиме с капецитабином наблюдалась большая медиана времени до прогрессирования (9 мес.) в сравнении с 6 мес. группы FOX. Небольшое число больных и малый срок наблюдения за больными не позволяет судить о статистической достоверности полученных различий.
Arkenau H. с соавт. доложили результаты другого большого исследования [20]. Рандомизация осуществлялась между двумя группами: CAPEOX (оксалиплатин 70 мг/м² 1,8 дни + капецитабин 2000 мг/м² 1-14 дни) и FUFOX (оксалиплатин 50 мг/м², лейковорин 500 мг/м², 5-фторурацил 2000 мг/м² 24-часовая инфузия 1 раз в неделю). 476 пациентов приняло участие в исследовании. Оба режима показали схожую частоту объективного ответа (таблица 4), однако была выявлена тенденция к улучшению времени до прогрессирования при режиме FUFOX (8,0 мес. и 7,0 мес, р = 0,11). И хотя формально разница в 1 месяц статистически недостоверна, это, все же, заставляет задуматься о действительной равнозначности капецитабина и инфузий 5-фторурацила в комбинации с оксалиплатином.
Таблица 4.
Результаты исследований, сравнивающих капецитабин с инфузиями 5-фторурацила.
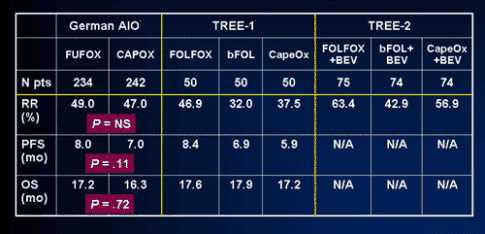
Результаты двух последовательных исследований TREE-1 и TREE-2 доложил Hochster H. с соавт. [21]. Первоначально было инициировано исследование TREE-1, в котором сравнивалось три оксалиплатин-содержащих режима, включающих инфузионный 5-фторурацил (FOLFOX: оксалиплатин 85мг/м², лейковорин 350 мг/м², 5-фторурацил 400 мг/м² болюсно с последующей 46-часовой инфузией 2400 мг/м², каждые 2 недели), болюсный 5-фторурацил (bFOL: оксалиплатин 85мг/м² 1,15 дни, лейковорин 20 мг/м², 5-фторурацил 500 мг/м² болюсно, еженедельно) и капецитабин (CapeOx: оксалиплатин 130 мг/м² дни, капецитабин 1000 мг/м² 1-14 дни, каждые 3 недели). После того, как FDA одобрила применение бевацизумаба в первой линии химиотерапии, он был добавлен ко всем трем режимам (в дозе 5 мг/кг каждые 2 недели или 7,5 мг/кг каждые 3 недели) и исследование продолжилось под литерой TREE-2. Из-за высокой частоты диарей в режиме CapeOx+Bev суточная доза капецитабина была снижена до 1700 мг/м².
Даже принимая во внимание сложность в сравнении последовательных исследований, можно констатировать, что добавление бевацизумаба к оксалиплатин-содержащим комбинациям позволило существенно повысить частоту объективного ответа без значимого усиления токсичности (табл. 4). Данные по выживаемости доступны лишь с исследования TREE-1. Общая выживаемость во всех трех режимах была идентична. Как и в исследовании из Германии обращает на себя внимание меньшее время до прогрессирования в группе CapeOx (5,9 мес.), чем в FOLFOX (8,4 мес.), однако малое число больных не позволяет статистически сравнить эти результаты.
Исследование CONFIRM-1: не все ингибиторы ангиогенеза одинаковы.
До настоящего времени единственным ингибитором ангиогенеза, который тестировался в рандомизированных исследованиях при РТК, был бевацизумаб. Кроме антител, блокирующих сосудистый эндотелиальный фактор роста (VEGF), существует и другой путь воздействия на ангиогенез – низкомолекулярные ингибиторы тирозинкиназ, связанных с рецептором VEGF. Выключение тирозинкиназ, приводит к прекращению передачи сигнала с рецептора в ядро клетки.
Одним из таких препаратов является PTK787 (ваталаниб), который блокирует тирозинкиназы не только всех известных рецепторов VEGF, но также тромбоцитарного фактора роста и с-kit. На основании обнадеживающих результатов I-II фаз исследований, было инициировано рандомизированное плацебо-контролируемое исследование (CONFIRM-1), в котором больным метастатическим РТК в качестве первой линии терапии назначался FOLFOX4 ± ваталаниб [22]. 1168 пациентов приняло участие в программе. Основными задачами исследования являлись снижение риска прогрессирования на 25% и повышение 1-годичной ОВ с 71% до 76%. Добавление ваталаниба сопровождалось некоторым ростом частоты ТЭЛА (6%) в сравнении с FOLFOX (1%) и артериальных гипертензий, однако эффективность в обеих группах была одинакова как по частоте объективного эффекта (42% и 46%), так и по выживаемости без прогрессирования (7,7 мес. и 7,6 мес.). Однако первоначально непредусмотренный протоколом анализ выявил достоверное улучшение выживаемости без прогрессирования в подгруппе больных плохого прогноза (высокий уровень ЛДГ (> 1,5 норм) и статусом ECOG 1/2) (табл. 5).
Таблица 5.
Результаты исследования CONFIRM-1.
| FOLFOX + PTK/ZK | FOLFOX + плацебо | p-value | |
|---|---|---|---|
| Число больных | 585 | 583 | |
| Время до прогрессирования (мес., все больные) Время до прогрессирования (мес.) высокий уровень ЛДГ низкий уровень ЛДГ |
7.7 (7.7- 9.2)
7.7 (7.1- 9.6) |
7.6 (7.5- 7.7)
5.8 (5.6- 7.4) |
0.118
0.010 |
Не смотря на положительные результаты в подгруппе плохого прогноза, основные задачи исследования достигнуты не были. Одной из причин неудач может быть неоптимальный режим дозирования препарата: при времени полужизни 3-6 часов он назначался лишь один раз в день. Возможно, для достижения стойкого антиангиогенного эффекта необходимо постоянное воздействие, как в случае с бевацизумабом, время полужизни которого исчисляется днями.
Заключение
Хотя данные, представленные на ASCO 2005, не претендуют на смену сложившихся стандартов лечения, тем не менее, они подтверждают:
Однако новые данные ставят перед нами новые вопросы:
Литература
1. Macdonald JS, Smalley SR, Benedetti J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med. 2001;345:725-730.
2. Cunningham D, Allum WH, Stenning SP, Weeden S. Perioperative chemotherapy in operable gastric and lower oesophageal cancer: final results of a randomised, controlled trial (the MAGIC trial, ISRCTN 93793971). Proc Am Soc Clin Oncol. 2005;23:308s. Abstract 4001.
3. Moiseyenko VM, Ajani J, Tjulandin A, et al. Final results of a randomized controlled phase III trial (TAX 325) comparing docetaxel (T) combined with cisplatin (C) and 5-fluorouracil (F) to CF in patients (pts) with metastatic gastric adenocarcinoma (MGC). Proc Am Soc Clin Oncol. 2005;23:308s. Abstract 4002.
4. Dank M, Zaluski J, Barone C, et al. Bugat Randomized phase 3 trial of irinotecan (CPT-11) + 5FU/folinic acid (FA) vs CDDP + 5FU in 1st-line advanced gastric cancer patients. Proc Am Soc Clin Oncol. 2005;23:308s. Abstract 4003.
5. Nagashima F, Ohtsu A, Yoshida S, Ito K. Japanese nationwide post-marketing survey of S-1 in patients with advanced gastric cancer. Gastric Cancer. 2005;8(1):6-11.
6. Ajani JA, Phan A, Yao JC, et al. Multi-center phase II study of S-1 plus cisplatin in patients with advanced gastric carcinoma (AGC). Proc Am Soc Clin Oncol. 2005;23:313s. Abstract 4024.
7. Fuchs C., Meyerhardt J. A., Heseltine D. L., et al. Influence of regular aspirin use on survival for patients with stage III colon cancer: Findings from Intergroup trial CALGB 89803. ASCO Meeting Abstracts Jun 1 2005: 3530.
8. Andre T, Boni C, Mounedji-Boudiaf L, et al. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med. 2004;350:2343-2351.
9. Wolmark N., Wieand H. S., Kuebler J. P., et al. A phase III trial comparing FULV to FULV + oxaliplatin in stage II or III carcinoma of the colon: Results of NSABP Protocol C-07. ASCO Meeting Abstracts Jun 1 2005: LBA 3500.
10. Ychou M., Raoul J., Douillard J., et al. A phase III randomized trial of LV5FU2+CPT-11 vs. LV5FU2 alone in adjuvant high risk colon cancer (FNCLCC Accord02/FFCD9802). ASCO Meeting Abstracts Jun 1 2005: 3502.
11. Van Cutsem E., Labianca R., Hossfeld D., et al. Randomized phase III trial comparing infused irinotecan / 5-fluorouracil (5-FU)/folinic acid (IF) versus 5-FU/FA (F) in stage III colon cancer patients (pts). (PETACC 3). ASCO Meeting Abstracts Jun 1 2005: LBA8.
12. Twelves, A. Wong, M. Nowacki, et al. Updated efficacy findings from the X-ACT phase III trial of capecitabine (X) vs. bolus 5-FU/LV as adjuvant therapy for patients (pts) with Dukes’ C colon Cancer. ASCO Annual Meeting Proceedings. Vol 23, No 16S, 2005: 3521.
13. Kabbinavar F, Schulz J, McCleod M, et al. Phase II, Randomized Trial Comparing Bevacizumab Plus Fluorouracil (FU)/Leucovorin (LV) With FU/LV Alone in Patients With Metastatic Colorectal Cancer. Journal of Clinical Oncology, Vol 21, Issue 1 (January), 2003: 60-65.
14. Hurwitz H., Fehrenbacher L., Novotny W., et al. Bevacizumab plus Irinotecan, Fluorouracil, and Leucovorin for Metastatic Colorectal Cancer. N Engl J Med 2004; 350:2335-2342.
15. Giantonio B. J., Catalano P. J., Meropol N. J., et al. High-dose bevacizumab improves survival when combined with FOLFOX4 in previously treated advanced colorectal cancer: Results from the Eastern Cooperative Oncology Group (ECOG) study E3200. Proc Am Soc Clin Oncol. 2005;23:259s. Abstract 2.
16. Saltz L., Lenz H., Hochster H., et al. Randomized Phase II Trial of Cetuximab/Bevacizumab/Irinotecan (CBI) versus Cetuximab/Bevacizumab (CB) in Irinotecan-Refractory Colorectal Cancer. Proc Am Soc Clin Oncol. 2005;23:259s. Abstract 3508.
17. Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med. 2004;351:337-345.
18. Hambleton J, Skillings J, Kabbinavar F, et al. Safety of low-dose aspirin (ASA) in a pooled analysis of 3 randomized, controlled trials (RCTs) of bevacizumab (BV) with chemotherapy (CT) in patients (pts) with metastatic colorectal cancer (mCRC). Proc Am Soc Clin Oncol. 2005;23:259s. Abstract 3554.
19. Martoni A., Pinto C., Di Fabio F., et al. PHASE II RANDOMIZED TRIAL ON PROTRACTED 5-FLUOROURACIL INFUSION PLUS OXALIPLATIN (FOX) VERSUS CAPECITABINE PLUS OXALIPLATIN (XELOX) AS FIRST LINE TREATMENT IN ADVANCED COLORECTAL CANCER (ACRC): PRELIMINARY RESULTS OF THE ITALIAN FOCA STUDY. Proc Am Soc Clin Oncol. 2005;23:259s. Abstract 3617.
20. Arkenau H., Schmoll H., Kubicka S., et al. Infusional 5-fluorouracil/folinic acid plus oxaliplatin (FUFOX) versus capecitabine plus oxaliplatin (CAPOX) as first line treatment of metastatic colorectal cancer (MCRC): Results of the safety and efficacy analysis. Proc Am Soc Clin Oncol. 2005;23:259s. Abstract 3507.
21. Hochster H. S., Welles L., Hart L. et al. Safety and efficacy of bevacizumab (Bev) when added to oxaliplatin/fluoropyrimidine (O/F) regimens as first-line treatment of metastatic colorectal cancer (mCRC): TREE 1 & 2 Studies. Proc Am Soc Clin Oncol. 2005;23:259s. Abstract 3515.
22. Hecht J. R., Trarbach T., Jaeger E., et al. A randomized, double-blind, placebo-controlled, phase III study in patients (Pts) with metastatic adenocarcinoma of the colon or rectum receiving first-line chemotherapy with oxaliplatin/5-fluorouracil/leucovorin and PTK787/ZK 222584 or placebo (CONFIRM-1). Proc Am Soc Clin Oncol. 2005;23:259s. LBA3.