Новости онкологии Прочти об этом раньше, чем твой пациент
18.04.2024
Иммунотерапия стала важным компонентом системного противоопухолевого лечения, характеризующимся высокой длительностью терапии, достигающей у ряда больных нескольких лет. При этом подобная длительность лечения «привязывает» пациента к лечебному учреждению, вынуждая его совершать регулярные визиты для проведения очередной многочасовой инфузии, что приводит к определенному снижению качества жизни и лишнему напоминанию о факте заболевания. Сегодня, в эру прецизионной медицины и персонализации медицинской помощи, улучшение качества и комфорта жизни онкологических больных является не менее важным направлением развития науки, чем увеличение показателей выживаемости, что мотивировало активное изучение возможностей сокращения длительности инфузии и отказа от парентеральных форм введения в пользу транскутанного.
Впервые возможность подкожного введения иммунотерапевтических агентов была показана на примере атезолизумаба в августе 2023 года в исследовании III фазы IMscin001 [1]. В данный протокол были включены пациенты с нерезектабельным немелкоклеточным раком легкого (НМРЛ) III-IV ст., с противопоказаниями к проведению химиолучевой терапии, отсутствием предшествующей иммунотерапии в анамнезе и/или неэффективностью первой линии платиносодержащей химиотерапии. Атезолизумаб вводился подкожно (экспериментальная группа, n=247) в дозе 1875 мг (15 мл, 125 мг/мл) или внутривенно (контрольная группа, n=124) в дозе 1200 мг 1 раз в 3 недели. Авторы показали, что атезолизумаб характеризовался схожей биодоступностью через 8 часов после 1 курса в группах подкожного и внутривенного введения со средней концентрацией 89 нг/мл (коэффициент вариации (CV) – 43%) и 85 нг/мл (CV – 33%) соответственно (рис.1).
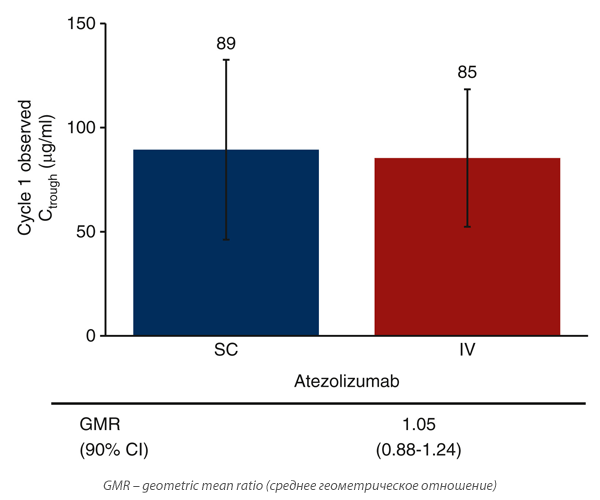
Рисунок 1. Средняя концентрация атезолизумаба через 8 часов после первого введения.
Эффективность терапии также достоверно не различалась. При медиане наблюдения в 4,7 мес. медиана выживаемости без прогрессирования составила 2,7 мес. в экспериментальной группе против 2,8 мес. в группе контроля (ОР 1,08; 95% ДИ 0,82-1,41), а объективный ответ опухоли был выявлен у 12% и 10% пациентов соответственно (рис.2). Профиль безопасности был сопоставим между группами с общей частотой нежелательных явлений (НЯ), связанных с терапией, 37,7% в экспериментальной группе и 37,9% в группе контроля. В то же время подкожное введение ассоциировалось с несколько меньшей частотой НЯ 3-4 ст. – 17,8% против 25,8%, но сопровождалось большим числом местных реакций в зоне введения (4,5% против 0%).
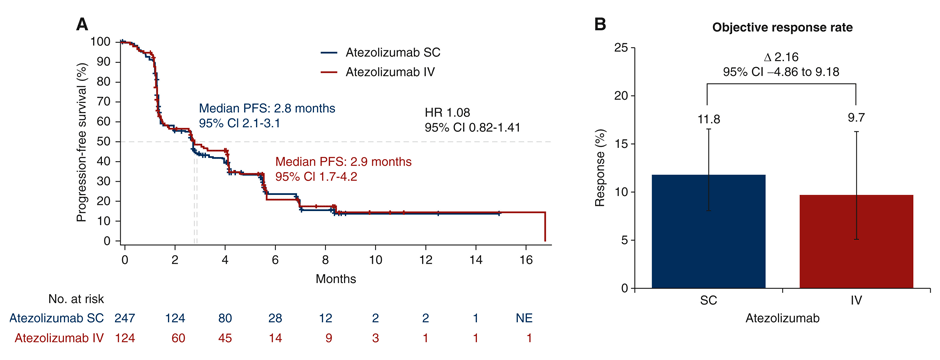
Рисунок 2. Медианы выживаемости без прогрессирования и частота объективных ответов.
Продолжением данной работы стало исследование IMscin002, представленное в марте 2024 года на конференции ELCC (European Lung Cancer Conference) [2]. Авторы показали, что подкожное введение препарата являлось предпочтительным вариантом терапии среди 70,3% пациентов по сравнению с 21,1% больных, выбравших продолжение внутривенных введений. В качестве основных преимуществ транскутанной формы терапии пациенты отмечали сокращение длительности пребывания в клинике (64,4%), меньший дискомфорт при введении препарата (46%) и снижение чувства тревоги (29,9%) (рис.3).
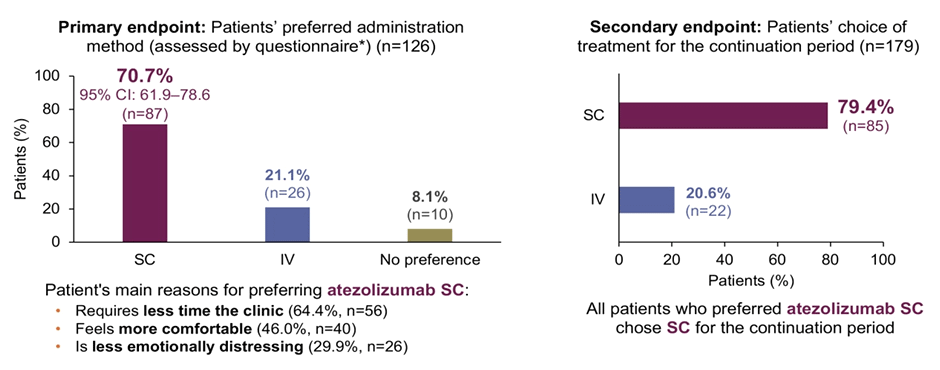
Рисунок 3. Наиболее предпочтительная форма проведения иммунотерапии по результатам IMscin002.
Таким образом, отказ от внутривенного введения препаратов в пользу подкожных форм является предпочтительным вариантом терапии, не приводящим (в отношении атезолизумаба) к ухудшению онкологического прогноза больных или увеличению риска нежелательных явлений и ассоциирующимся с улучшением субъективной переносимости лечения. Конечно, для полноценного смещения парадигмы потребуется проведение большего числа работ с подтверждением отсутствия негативного влияния на показатели выживаемости, однако имеющиеся данные уже демонстрируют перспективность и значимость данного направления научной мысли.
Источники:
Материал подготовил И.М. Боровков