22.02.2024

Активное изучение биологических особенностей немелкоклеточного рака легкого (НМРЛ) привело к появлению новых терапевтических опций как в первой, так и в последующих линиях лечения. Результаты таких работ, как LIBRETTO-431 и MARIPOSA, сфокусировались на изучении первой линии лечения пациентов с различными драйверными мутациями. Но будет ли сохраняться эффективность таргетной терапии у диссеминированных больных, ранее уже получавших системное противоопухолевое лечение?
Исследование II фазы PHAROS взялось оценить эффективность двойной таргетной блокады препаратами энкорафениб (450 мг 1 раз в день) и биниметиниб (45 мг два 2 раза в день) у пациентов с метастатическим BRAFV600E-мутантным НМРЛ в первой и второй линиях терапии [1]. Авторы включили 98 пациентов, из которых 59 впервые направлялись на системное лечение (первая группа), а 39 уже ранее получали 1 линию химио- или иммунотерапии (вторая группа). Пациенты с предшествующей анти-BRAF терапией в исследование не включались. В качестве первичной конечной точки была выбрана частота объективных ответов (ЧОО), а вторичные конечные точки включали длительность объективного ответа и выживаемость без прогрессирования (ВБП). При медиане лечения в 9,2 мес. для энкорафениба и 8,4 мес. для биниметиниба применение BRAF и MEK ингибиторов приводило к объективному ответу у 75% пациентов в первой линии терапии (полный ответ – 15%, частичный ответ – 59%, стабилизация – 17%) и у 46% пациентов во второй линии (полный ответ – 15%, частичный ответ – 59%, стабилизация – 17%), а длительность ответа свыше 6 и 12 мес. определялась, соответственно, у 64% и 59% пациентов из первой группы и у 41% и 33% из второй группы. Безрецидивная выживаемость также была достоверно выше в группе 1 линии лечения – медиана ВБП не была достигнута при средней длительности наблюдения в 18,2 мес., а показатель медианы ВБП у предлеченных больных, в свою очередь, составил 9,3 мес. (рис.1). Лечение характеризовалось удовлетворительной переносимостью, нежелательные явления (НЯ) 3-4 ст. были выявлены у 31% больных и проявлялись, преимущественно, увеличением уровня трансаминаз печени (АЛТ – 5%, АСТ – 7%), диареей (4%) и тошнотой (3%). Среди НЯ 1-2 ст. чаще всего выявлялись тошнота (50%) и диарея (43%).
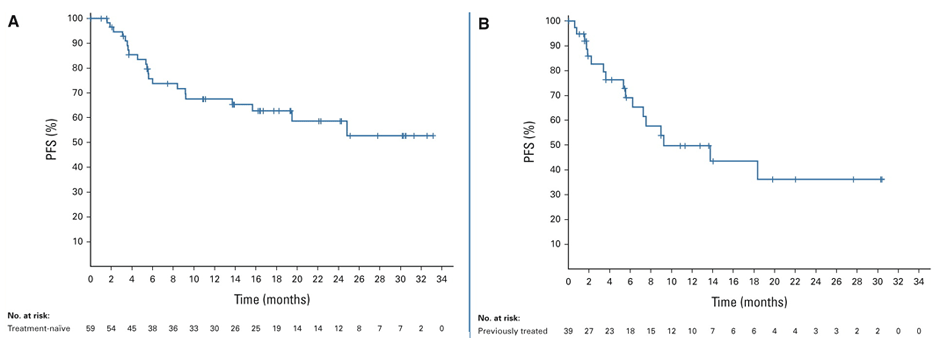
Рисунок 1. Выживаемость без прогрессирования в 1 (А) и 2 (B) линиях терапии в исследовании PHAROS.
При этом, анализируя показатель ВБП в данной работе, уместно вспомнить исследование REVEL, продемонстрировавшее большую эффективность терапии доцетакселом и рамуцирумабом во второй линии по сравнению с монотерапией доцетакселом с достижением медианы ВБП 4,5 и 3,0 мес. соответственно [2]. Однако мутационный профиль и размеры выборок предлеченных больных в REVEL (n=628, пациенты не стратифицировались по драйверным мутациям) и PHAROS (n=39, больные только с BRAFV600E-мут. НМРЛ) не сопоставимы, что затрудняет даже непрямое сравнение данных подходов. Тем не менее, высокие результаты терапии и удовлетворительная переносимость в исследовании PHAROS позволили FDA зарегистрировать двойную таргетную блокаду BRAF и MEK для лечения больных с подтвержденным BRAFV600EE-мут. распространенным НМРЛ [3]. Вопрос влияния подобного лечения на общую выживаемость, особенно во 2 линии, все еще остается открытым.
Стремление сместить с пьедестала «короля второй линии» доцетаксела и присвоить себе лавры «standard of care» в 2023 году не остановилось на PHAROS, найдя свое продолжении в исследовании III фазы TROPION-Lung01 [4]. Авторы исследовали новый препарат датопотамаб дерукстекан, представляющий конъюгат моноклонального антитела к TROP2 датопотамаба и ингибитора топоизомеразы I типа дерукстекана. Для начала стоит сказать пару слов про мишень препарата. TROP2 является трансмембранным гликопротеином, впервые выявленным в клетках человеческого трофобласта, участвующим в регуляции процессов клеточного роста и опосредующим опухолевую инвазию. Данный белок также активно экспрессируется на поверхности опухолевых клеток при ряде высокоагрессивных злокачественных новообразований. Так, при НМРЛ его экспрессия определяется у абсолютного большинства пациентов с плоскоклеточным раком и у 64% с аденокарциномой, что коррелирует с ухудшением прогноза больных [5].
Исследование III фазы TROPION-Lung01 включило 604 предлеченных пациента, среди которых 299 были объединены в экспериментальную группу (преимущественно неплоскоклеточный рак, n=232, датопотамаб деркукстекан 6 мг/кг 1 раз в 3 недели), а 305 – получали доцетаксел (75 мг/м2 1 раз в 3 недели) в качестве терапии контроля [4]. Важным критерием включения являлось обязательное наличие в анамнезе предшествующей одномоментной химиоиммунной терапии или 2 последовательных линий лечения с использованием данных групп препаратов (43,1%). Авторам удалось добиться достоверного увеличения медианы выживаемости без прогрессирования (первичная конечная точка) в экспериментальной группе до 4,4 мес. по сравнению с 3,7 мес. в группе контроля (ОР 0,75; 95% ДИ 0,62-0,91; p=0,004) (рис.2).
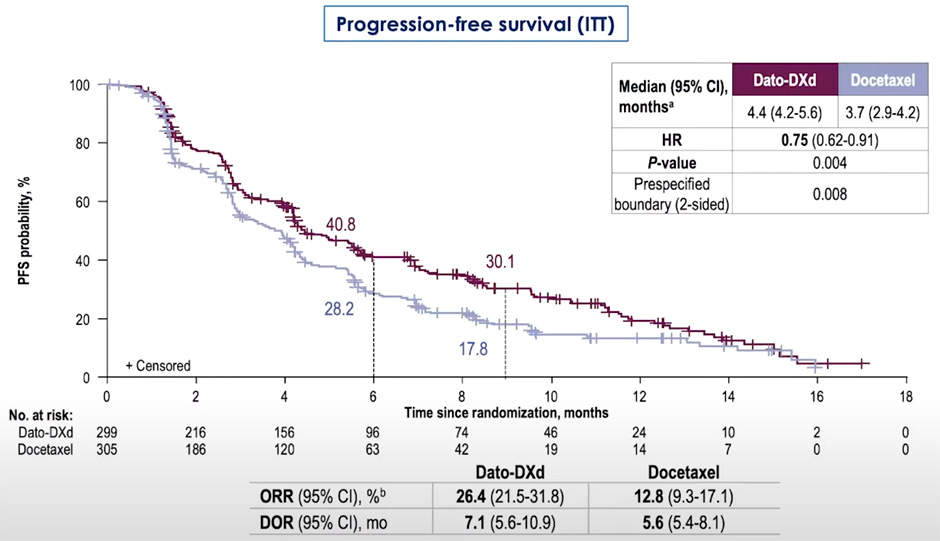
Рисунок 2. Выживаемость без прогрессирования в общей популяции больных.
При этом большая медиана ВБП отмечалась именно в подгруппе неплоскоклеточного рака – 5,6 против 3,7 мес. (ОР 0,63; 95% ДИ 0,51-0,78) в экспериментальной и контрольной группах соответственно. Пациенты с плоскоклеточным раком, напротив, демонстрировали меньшую медиану ВБП по сравнению с неплоскоклеточными формами заболевания – 2,8 мес. в группе конъюгата против 3,9 мес. в группе доцетаксела (ОР 1,38; 95% ДИ 0,94-2,02) (рис.3).
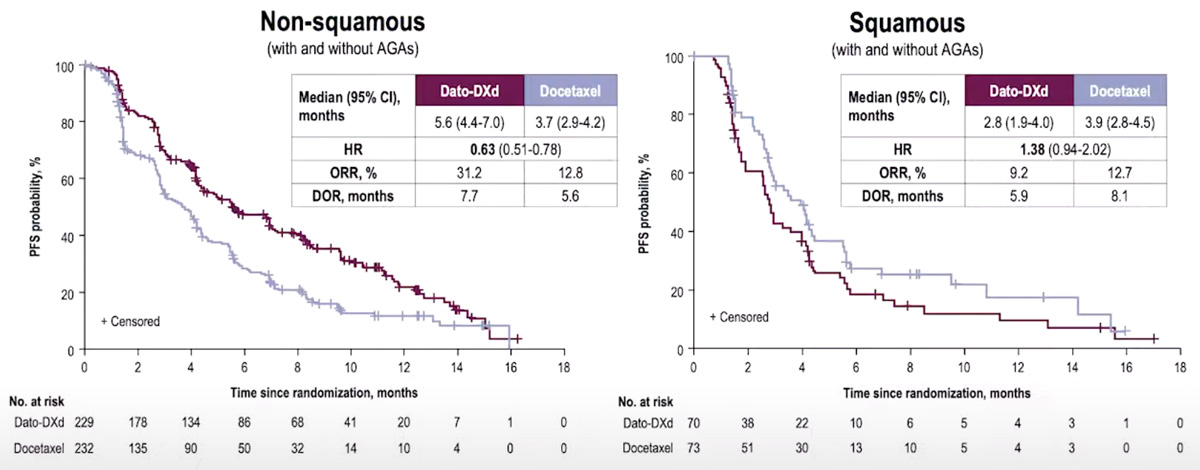
Рисунок 3. Выживаемость без прогрессирования в зависимости от гистологического варианта.
Применение конъюгата также ассоциировалось с увеличением частоты объективных ответов (вторичная конечная точка) до 26,4% по сравнению с 12,8% у пациентов, получавших доцетаксел. Медиана длительности приема препаратов составила 4,2 мес. в группе датопотамаба дерукстекана и 2,8 мес. в группе доцетаксела. Профиль безопасности терапии конъюгатом являлся более благоприятным, чем при использовании доцетаксела, и характеризовался развитием НЯ ≥3 ст. у 24,6% пациентов по сравнению с 41,4%. В то же время НЯ 1-2 ст. развивались с аналогичной частотой в обеих группах (86,5% и 86,9%) и проявлялись в экспериментальной группе чаще всего в виде стоматита (49,2%) и тошноты (37%).
Несмотря на положительные результаты, нельзя не заметить, что группа сравнения в данном исследовании ограничилась монотерапией доцетакселом и не стала включать его комбинацию с рамуцирумабом (или нинтеданибом при неплоскоклеточном раке и раннем прогрессировании?), что, несомненно, несколько дискредитирует полученные данные по выживаемости и не позволяет сделать однозначные выводы о применимости предлагаемого вида лечения у функционально сохранных больных. В то же время наличие выраженной сопутствующей патологии, делающей проведение сочетанной химиотаргетной терапии невозможным, представляет конъюгат в более выгодным свете по сравнению с монотерапией доцетакселом, демонстрируя лучшие показатели ВБП и меньшую токсичность. Таким образом, при аккумуляции научных данных и демонстрации окончательных результатов исследования TROPION-Lung 01 применение данного препарата может занять определенную нишу в лечении больных с неплоскоклеточным немелкоклеточным раком легкого.
Take-home Message:
Источники: