15.02.2024
Длительное время наиболее информативным методом радионуклидной диагностики в общей популяции онкологических больных являлась позитронно-эмиссионная томография, совмещенная с КТ и использованием фтордезоксиглюкозы (18Ф-ФДГ ПЭТ/КТ). Данная технология основывается на детекции повышенного поглощения меченой глюкозы в тканях с активным делением клеток и гиперметаболизмом, что является характерным признаком большинства злокачественных опухолей. Однако глюкоза является необходимым ресурсом для всех клеток, находящихся в состоянии активного деления, в частности, клеток эпителия желудочно-кишечного тракта, среди которых всегда отмечается физиологическое накопление 18Ф-ФДГ. Напротив, ряд анатомических структур, таких как, например, лимфатические узлы, печень и брюшина, отличается пониженным поглощением фармпрепаратов на основе глюкозы. Все эти факторы вместе лимитируют «универсальность» метода 18Ф-ФДГ ПЭТ/КТ, мотивируя поиск новых, более чувствительных компараторов для диагностики опухолевых заболеваний.
Сегодня в клиническую практики активно входит использование нового меченого препарата – ингибитора фактора активации фибробластов (fibroblast activation protein inhibitor, FAPI). Теоретической основой высокой чувствительности FAPI в качестве радиофармпрепарата служит тот факт, что злокачественные клетки неразрывно связаны с окружающей их стромой, содержащей большое количество фибробластов, находящихся в норме в неактивном состоянии. В результате каскада молекулярных взаимодействий происходит их активация и трансформация в опухоль-ассоциированные фибробласты, отличающиеся более высокой пролиферативной активностью, «иммунитетом» к апоптозу и крайне высокой экспрессией на своей поверхности белка – фактора активации фибробластов (FAP). Так, по данным литературы, данный белок определяется в строме более чем 90% типов злокачественных опухолей, что делает использование меченого ингибитора к FAP крайне перспективным направлением ядерной медицины [1,2]. В недавнем небольшом китайском исследовании уже было показано, что данный метод обладает большей чувствительностью по сравнению с 18Ф-ФДГ ПЭТ/КТ при диагностике немелкоклеточного рака легкого и позволяет боле эффективно идентифицировать метастатическое поражение лимфатических узлов (93,0% [53/57] против 86,0% [49/57]), печени (100% [4/4] против 25% [1/4]) и костей (97,6% [41/42] против 83,3% [35/42]) (рис.1). При этом частота ложноположительных результатов также была ниже в группе FAPI – 1 против 5 «пораженных» лимфоузлов [3]. Закономерным является вопрос, сохранится ли аналогичная эффективность 68Ga-FAPI ПЭТ/КТ при диагностике опухолей ЖКТ?
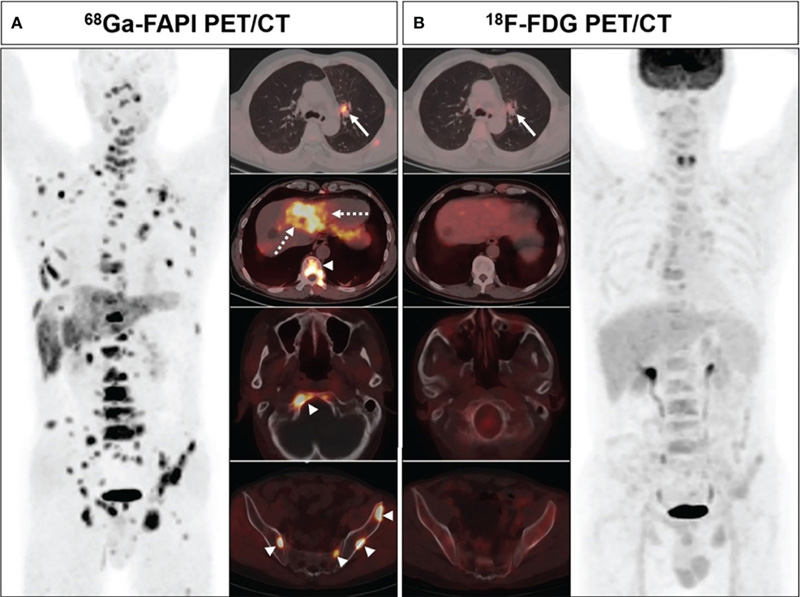
Рисунок 1. Эффективность 68Ga-FAPI и 18Ф-ФДГ при оценке распространенности НМРЛ.
В январе 2024 года были опубликованы результаты проспективного исследования, включившего 112 пациентов с впервые выявленными (n=69) или прогрессирующими (n=43) злокачественными новообразованиями желудка (аденокарцинома: n=44; перстневидно-клеточный рак: n=5), печени (n=39) или поджелудочной железы (n=24) [4]. Дизайн работы предполагал последовательное выполнение 18Ф-ФДГ ПЭТ-КТ и 18Ф-FAPI ПЭТ-КТ с интервалом в одну неделю и последующей верификацией выявленных очагов при помощи гистологического исследования (n=69) или альтернативных методов инструментальной диагностики.
Использование FAPI при раке желудка обеспечило большую чувствительность в идентификации первичной опухоли (88% против 64%), пораженных лимфоузлов (88% против 55%, p<0,001) и перитонеальных метастазов (100% против 64%, p<0,001). При этом интенсивность накопления РФП в абдоминальных и наддиафрагмальных лимфоузлах также была достоверно выше в группе FAPI – SUVmax составил 6,2 против 2,9 (p<0,001) и 4,4 против 2,6 (p=0,0010) (рис.2).
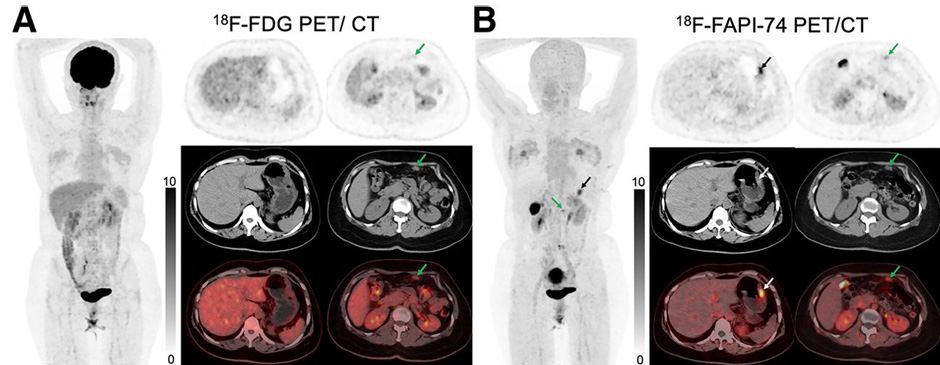
Рисунок 2. Эффективность 18Ф-ФДГ и 18Ф-FAPI при оценке распространенности перстневидно-клеточного рака желудка.
Аналогичные результаты были получены в отношении опухолей печени (гепатоцеллюлярный рак: n=31; внутрипеченочная холангиокарцинома: n=8) – использование FAPI ассоциировалось с большей выявляемостью первичной опухоли (100% против 82%), метастатического поражения печени (90% против 53%, p<0,001), брюшины (100% против 25%, p=0,031) и лимфатических узлов (97% против 43%, p<0,001) (рис.3).
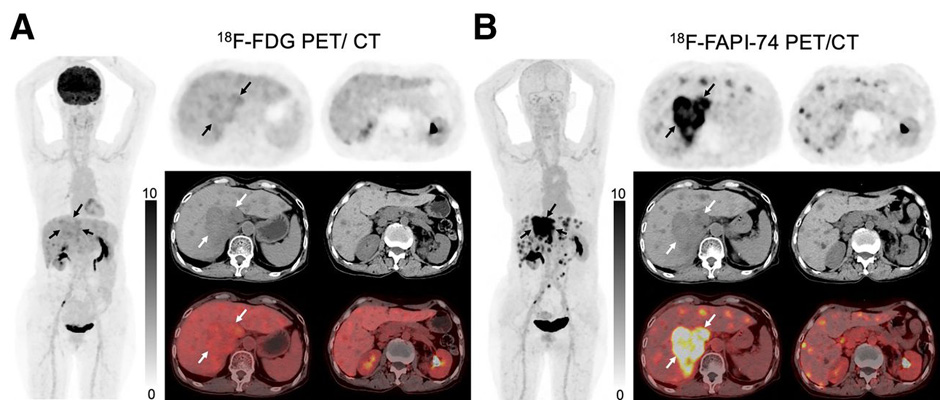
Рисунок 3. Эффективность 18Ф-ФДГ и 18Ф-FAPI при оценке распространенности внутрипеченочной холангиокарциномы.
Опухоли поджелудочной железы были представлены внутрипротоковой аденокарциномой (n=21), плоскоклеточный раком (n=1), муцинозной аденокарциномой (n=1) и недифференцированным раком (n=1). Применение FAPI, как и в предыдущих группах, характеризовалось более высокой интенсивностью накопления РФП (медиана SUVmax 16,5 против 7,3), большей частотой выявления метастазов в печени (100% против 55%, p<0,001) и по париетальной брюшине (100% против 44%, p<0,001), а также большим количеством потенциально-метастатических лимфатических узлов (97% против 41%, p<0,001) (рис.4).
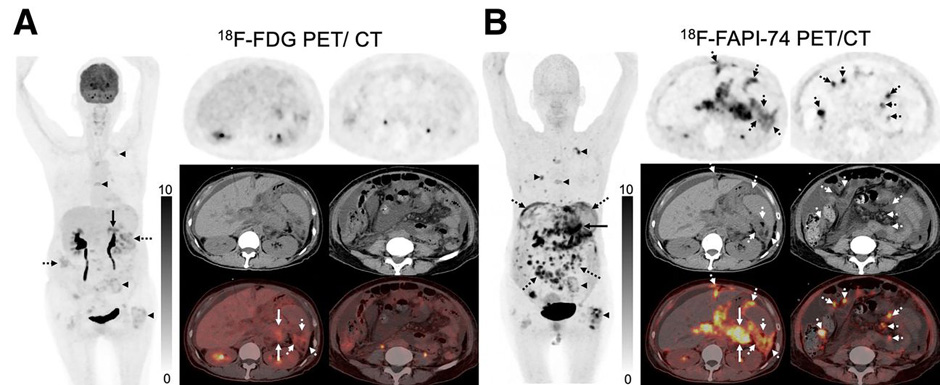
Рисунок 4. Эффективность 18Ф-ФДГ и 18Ф-FAPI при оценке распространенности внутрипротоковой аденокарциномы поджелудочной железы.
Гистологическое исследование выявленных очагов, выполненное у 69 пациентов, подтвердило высокую эффективность FAPI. Так, выявленные первичные опухоли были морфологически верифицированы у 96% по сравнению с 75% в группе ФДГ (p<0,001), а биопсия лимфоузлов показала, что показатели чувствительности, специфичности и точности при их идентификации составили 71%, 95% и 92% в группе FAPI и 40%, 96% и 88% в группе ФДГ соответственно (p<0,001). Интересен также тот факт, что при использовании ФДГ определялась корреляция между размером лимфатического узла, интенсивностью накопления РФП и вероятностью его метастатического поражения (p=0,036), а при использовании FAPI подобной связи выявлено не было (p=0,219).
Дополнительное выполнение FAPI ПЭТ/КТ после ФДГ в данном исследовании привело к повышению стадии заболевания по системе TNM у 25% (рак желудка: n=7; рак печени: n=6; рак поджелудочной железы: n=4) и коррекции тактики лечения у 9% пациентов.
Таким образом, использование ингибиторов фактора активации фибробластов в качестве радиотрейсера является высокоэффективным и информативным методом диагностики как локализованных, так и распространенных форм злокачественных опухолей органов желудочно-кишечного тракта.
Источники:

При назначении пациенту того или иного диагностического теста необходимо понимать цель данного назначения и могут ли потенциально его результаты повлиять на тактику лечения. Если с этих позиций рассмотреть результаты исследования по сравнению ПЭТ/КТ с использованием в качестве радиотрейсера нового фармпрепарата – ингибитора фактора активации фибробластов (FAPI) – и с классической 18Ф-ФДГ ПЭТ/КТ, то результаты приведенной работы спорные.
В исследование включались пациенты с целью первичного стадирования или подтверждения рецидива заболевания. Во втором случае интенсификация наблюдения за пациентами с помощью внедрения более чувствительных методов детекции проявлений болезни при различных опухолях ЖКТ в рамках рандомизированных исследований III фазы провалилась, поэтому появление ПЭТ/КТ с новым трейсером ситуации не изменит, нужно будет повторять данные исследования. Также, если думать о применении данного подхода в оценке эффективности лечения в процессе химиотерапии, следует вспомнить, что в рутинной практике и даже в исследованиях мы используем обычную компьютерную томографию или МРТ, а в случае ограничения доступности обходимся обычным УЗИ. Это обусловлено тем, что применение более чувствительных методов детекции метастазов не меняет тактику, и мы ориентируемся на состояние пациента и динамику таргетных очагов. Кроме этого, следует принять во внимание, что в процессе развития опухоли и в процессе лечения могут происходить изменения в экспрессии FAPI.
Более интересно рассмотреть новый трейсер в рамках первичного стадирования, и тут лучше подходить индивидуально к каждой локализации. Почему индивидуально? Напомню, что в этом же журнале 8 февраля 2024 года Himras N. с соавторами опубликовали похожее исследование, но при опухолях различных локализаций, в котором диагностическая точность FAPI ПЭТ/КТ была ниже 18Ф-ФДГ ПЭТ/КТ при опухолях мочевого пузыря, раке почки, лимфомах и не отличалась при раке молочной железы и опухолях головы и шеи, что можно объяснить различной степенью выраженности хронического воспаления и отличиями стромального компонента опухолей различных локализаций.
При раке желудка чувствительность в плане выявления первичной опухоли составила 88%, но здесь нас может выручить ФГДС с эндоУЗИ, а вот чувствительность в детекции перитонеальных метастазов составила все 100%. Это сразу наводит на мысль о прорыве в диагностической тактике больных раком желудка – отказ от диагностической лапароскопии. Однако кроме небольшой выборки в 25 пациентов нужно вспомнить о необходимости помимо визуальной оценки состояния брюшины выполнять смывы и биопсию, чтобы морфологически исключить перитонеальную диссеминацию. При этом по частоте выявления отдаленных метастазов вне брюшины отличий от 18Ф-ФДГ ПЭТ/КТ не обнаружено. Поэтому данный подход следует продолжить изучать уже на большей выборке больных, и пока он не поменяет диагностические подходы при раке желудка.
При опухолях печени (включено с целью первичного стадирования 22 пациента с ГЦР или ХЦР) подтверждающий метод в виде МРТ был выполнен лишь 14 пациентам, то есть для оценки чувствительности в отношении состояния паренхимы печени сравнивали с обычным МРТ, и в этом аспекте ничего не изменится. А вот в отношении отдаленного метастазирования – другая ситуация: FAPI ПЭТ/КТ демонстрирует лучшие результаты. Однако они получены на 22 пациентах, и нет данных в сравнении со стандартными подходами, куда не входит, на секундочку, 18Ф-ФДГ ПЭТ/КТ. То есть – будем ждать новых исследований.
В когорту больных раком поджелудочной железы для оценки первичного стадирования было включено 22 пациента. Новый трейсер чаще выявлял отдаленные метастазы и пораженные регионарные лимфоузлы. То есть при повышенном риске метастазирования (например, при высоком СА 19-9) данный метод видится перспективным. Однако в рамках оценки первичной опухоли различий не отмечено, и для оценки различий между резектабельными и потенциально-резектабельными опухолями поджелудочной железы данный метод не изменит ситуацию.
Также следует вспомнить, что для перечисленных опухолей ПЭТ/КТ входит в рекомендации как стандарт первичной диагностики только при раке желудка и при высоком риске рака поджелудочной железы. Таким образом, опуская методологические огрехи, отсутствие статистической гипотезы, малые выборки пациентов и принимая во внимание только клинические находки, представленная работа лишь дает предпосылки к новым исследованиям. Тем не менее, в клинической разработке фигурируют как минимум 8 трейсеров на основе FAPI, и данный метод рано или поздно войдет в нашу практику, но не как замена тех или иных диагностически процедур, а скорее как уточняющее дополнение в определенных клинических ситуациях и при некоторых нозологиях.