14.02.2024

2023 год значительно расширил спектр опций консервативного лечения как локализованного, так и распространенного рака легкого, что во многом обусловлено публикацией летом 2023 года положительных результатов исследования ADAURA, продемонстрировавшего улучшение ОВ в общей популяции больных с Ib-IIIa ст. (ОР 0,49; 95,03% ДИ 0,33-0,73; p<0,001) [1]. Эта работа не только показала высокую эффективность осимертиниба у пациентов с активирующими мутациями EGFR (делеция в 19 экзоне или L858R), но и открыла целое новое направление развития клинической и экспериментальной онкологии – применение таргетных препаратов в адъювантном режиме.
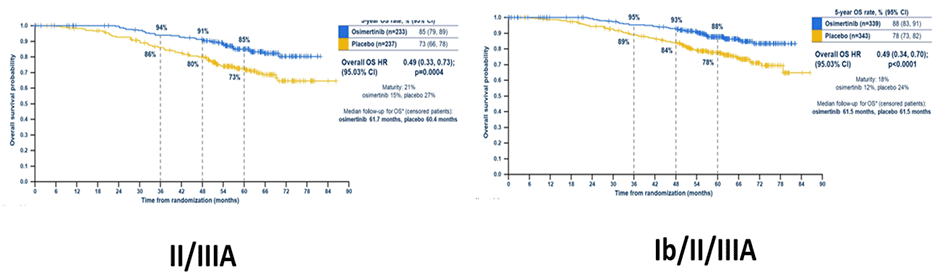
Рисунок 1. Общая выживаемость в исследовании ADAURA.
Одним из первых идейных наследников ADAURA стало исследование III фазы ALINA, включившее 257 пациентов с резектабельным НМРЛ Ib-IIIa ст. и мутацией ALK [2]. После радикального хирургического лечения пациенты рандомизировались в экспериментальную группу с алектинибом (600 мг 2 раза в день в течение 2 лет, n=130) и контрольную группу с проведением 4 курсов платиносодержащей химиотерапии на выбор исследователя. Стратификация проводилась по стадии заболевания (II и IIIa ст.) и расе пациентов (азиаты и не азиаты), а первичной конечной точкой являлась оценка показателя выживаемости без прогрессирования (ВБП). При медиане наблюдения в 27,9 мес. 2-летняя ВБП составила 93,8% в группе алектиниба против 63% в группе АПХТ (ОР 0,24; 95% ДИ 0,13-0,45), а ВБП в ЦНС – 98,4% против 85,8% (ОР 0,22; 95% ДИ 0,08-0,58) (рис.2). Стадия заболевания не оказывала клинически значимого влияние на эффективность алектиниба (табл.1). Токсичность лечения была сопоставима между группами: нежелательные явления (НЯ) 3-4 ст. выявлялись у 38% пациентов при применении алектиниба и 37% при проведении химиотерапии. Непереносимая токсичность в группах алектиниба и АПХТ являлась причиной отмены лечения у 5% и у 12,5% больных, а необходимость редукции доз лекарственных препаратов была выявлена в 26% и 10% случаев соответственно. Однако отсутствие данных по влиянию на общую выживаемость пока не позволяет сделать окончательный вывод об эффективности применения алектиниба в адъювантном режиме. При этом FDA уже присвоило данному исследованию статус «приоритетного рассмотрения», а обсуждение целесообразности регистрации данной схемы лечения запланировано на май 2024 года [3]. Помимо исследования ALINA, целесообразность адъювантной терапии алектинибом на данный момент изучается в исследованиях II фазы NAUTIKA1 и ALNEO и в исследовании III фазы HORIZON-01.
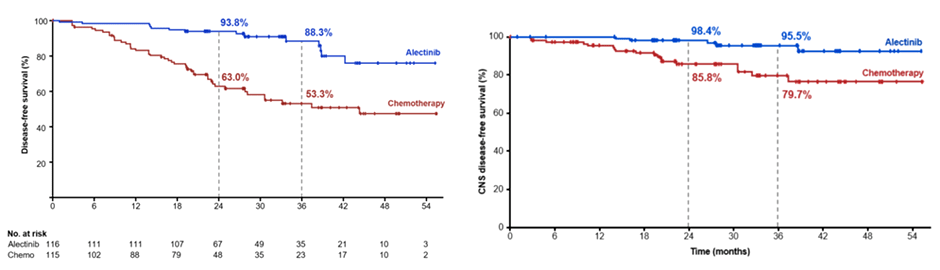
Рисунок 2. Выживаемость без прогрессирования и выживаемость без прогрессирования в ЦНС в исследовании ALINA.
Таблица 1. Влияние стадии заболевания на выживаемость без прогрессирования.
| 2-летняя ВБП, % (95% ДИ) | Стадия IB (n=26) |
Стадия II (n=92) |
Стадия IIIA (n=139) |
|---|---|---|---|
| Алектиниб | 92,3 (77,8-100,0) | 95,6 (89,5-100,0) | 92,7 (86,4-98,9) |
| Платиносодержащая ХТ | 71,6 (44,2-99,0) | 66,3 (51,7-81,0) | 60,7 (47,9-73,5) |
| ОР† (95% ДИ) | 0,21 (0,02-1,84) | 0,24 (0,09-0,65) | 0,25 (0,12-0,53) |
Не менее ожидаемым является исследование III фазы LIBRETTO-432, изучающее влияние адъювантного применение селперкатиниба у пациентов с Ib-IIIa ст. НМРЛ и транслокацией гена RET [4]. Предположение о высокой эффективности подобного подхода основывается на результатах недавнего исследования LIBRETTO-431, показавшего целесообразность использования селперкатиниба в качестве препарата первой линии терапии у RET-положительных больных с IIIb-IV ст. неплоскоклеточного НМРЛ, не получавших ранее какого-либо системного лечения [5].
Пациентам в экспериментальной группе назначался селперкатиниб в дозе 160 мг два раза в день (n=159). В качестве группы контроля была выбрана ПХТ по схеме карбоплатин/
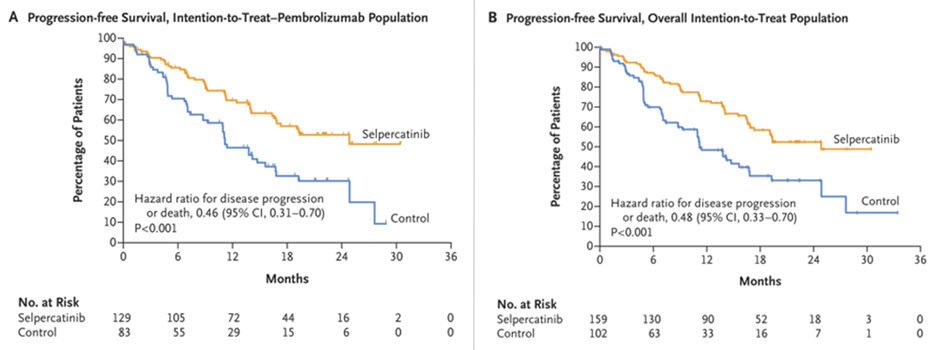
Рисунок 3. Выживаемость без прогрессирования в исследовании LIBRETTO-431.
Как в экспериментальной, так и в контрольной группах лечение сопровождалась выраженной токсичностью с высокой распространенностью НЯ ≥3 степени (70% против 57% соответственно). Терапия селперкатинибом чаще приводила к удлинению интервала QT (9%), росту трансаминаз печени (13-22%) и развитию артериальной гипертензии (20%), а проведение ПХТ преимущественно сопровождалось нейтропенией (28%) и анемией (10%). Явления токсичности потребовали редукции доз препаратов у 51% и 29% пациентов в экспериментальной и контрольной группе, а также стали непосредственной причиной остановки лечения у 10% и 2% пациентов соответственно. Таким образом, профиль безопасности селперкатиниба сложно назвать полностью управляемым, что может потенциально ограничить популяцию больных, претендующих на данный вид терапии, а отсутствие данных по влиянию препарата на общую выживаемость, как и в случае с исследованием ALINA, пока не позволяет делать окончательные выводы. Тем не менее, FDA уже сообщило о рассмотрении данного режима в рамках протокола ускоренного одобрения (accelerated approval) [6].
Переходя к обсуждению таргетной терапии распространенных форм НМРЛ, нельзя не упомянуть исследования FLAURA2 и MARIPOSA. Успех исследования ADAURA неизбежно возродил интерес сообщества к ингибиторам EGFR и, в частности, изучению возможностей сочетания осимертиниба с химиотерапией у EGFR-положительных больных с метастатическим НМРЛ, что легло в основу протокола FLAURA2 [7]. Исследование включало пациентов без предшествующего системного лечения. Первичной конечной точкой данной работы служила ВБП, а вторичные конечные точки включали оценку ОВ, частоту объективных ответов и токсичность лечения. Пациентам в экспериментальной группе (n=279) проводилось 4 курса платиносодержащей химиотерапии с пеметрекседом и осимертинибом (80 мг 1 раз в день) с последующим переходом на поддержку пеметрекседом и осимертинибом до прогрессирования или непереносимой токсичности, а группа контроля получала только осимертиниб в аналогичных дозах. Авторы показали, что комбинированный подход позволяет достоверно увеличить 2-летнюю ВБП до 57% по сравнению c 41% при монотерапии осимертинибом, а медиана ВБП в группах составила 25,5 мес. против 16,7 мес. (ОР 0,62; 95% ДИ 0,49-0,79; p<0,0001). При этом наибольшее расхождение кривых выживаемости отмечалось в группе с исходным поражением ЦНС до начала лечения – 24,9 мес. против 13,8 мес. (ОР 0,47; 95% ДИ 0,33-0,66). Для сравнения, в группе без метастазов в ЦНС медиана ВБП составила 27,6 мес. на фоне химиотаргетной терапии и 21,0 мес. при монотерапии осимертинибом (ОР 0,75; 95% ДИ 0,55-1,03) (рис.4).
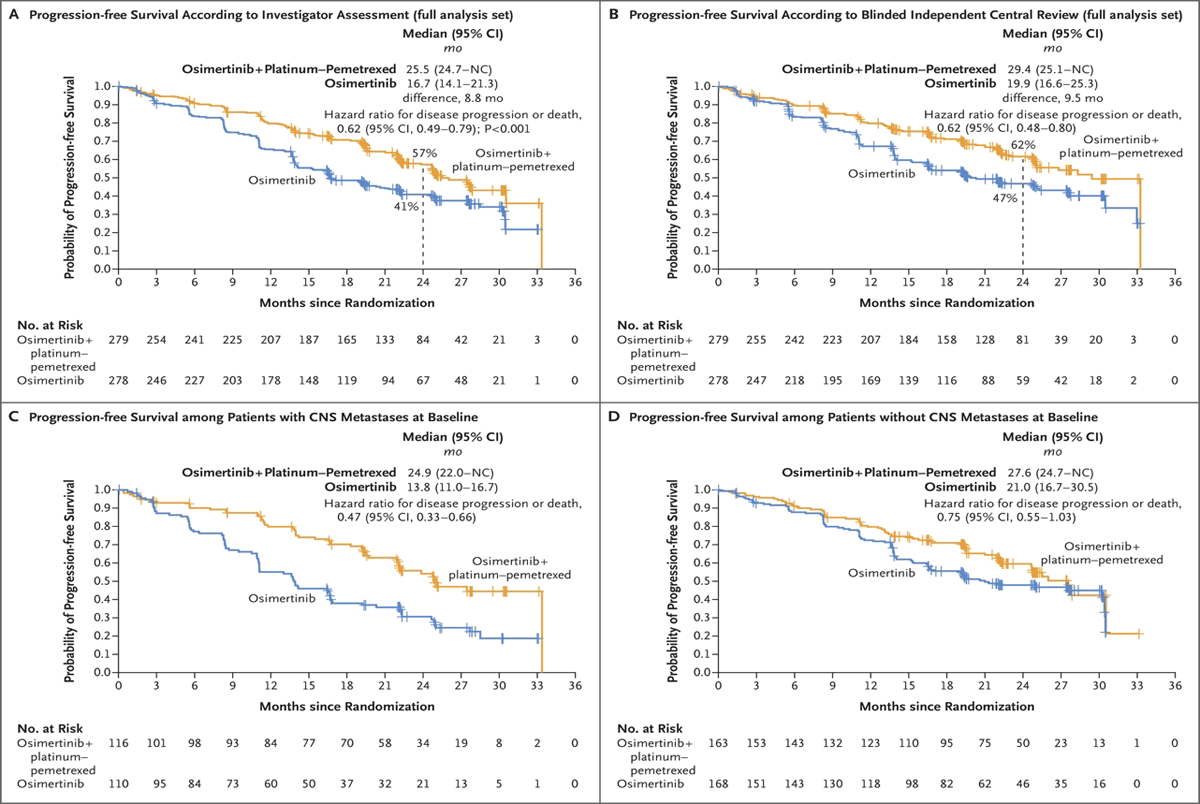
Рисунок 4. Выживаемость без прогрессирования в исследовании FLAURA2.
Комбинированная терапия чаще приводила к развитию объективных ответов (83% против 76%), а также ассоциировалась с большей его длительностью, чем в группе монотерапии осимертинибом (24 мес. против 15,3 мес.). Однако высокая эффективность подобного подхода стоила также и кратного увеличения токсичности с развитием НЯ ≥3 ст. (преимущественно гематологического характера) у 64% больных в группе комбинированного лечения против 27% в группе контроля, что явилось причиной прекращения терапии у 11% и 6% пациентов соответственно. Таким образом, сочетание осимертиниба с конвенциональной химиотерапией может служить хорошей опцией лечения для пациентов с диссеминированным EGFR-мутированным НМРЛ без предшествующего лечения и высоким функциональным статусом, особенно при наличии поражения ЦНС, но требует тщательного контроля со стороны химиотерапевта для своевременного выявления и коррекции НЯ.
Идейным наследником этого протокола стало исследование MARIPOSA, авторы которого взялись изучить эффективность комбинированной таргетной терапии ингибиторами EGFR (лазертениб) и MEK (амивантанаб) при EGFR-мутированном диссеминированном НМРЛ [8]. В качестве группы контроля, как и во FLAURA2, выступала монотерапия осимертинибом. Было показано, что сочетание данных препаратов приводит к достоверному увеличению медиану ВБП до 23,7 мес. по сравнению с 16,6 мес. в группе контроля (ОР 0,70; 95% ДИ 0,58-0,85; p<0,001) (рис.5). Данных по достоверному улучшению общей выживаемости на данный момент получено не было (ОР 0,80; 95% ДИ 0,61-1,05; p=0,1), как и не была представлена в открытый доступ полная картина профиля безопасности терапии, что не позволяет однозначно рекомендовать данную схему всем пациентам. Тем не менее, полученные результаты предполагают, что комбинация таргетных препаратов, несмотря на ожидаемо более высокую стоимость, может служить альтернативой химиотаргетной терапии у пациентов с наличием противопоказаний для проведения химиотерапии, а это, несомненно, является ценным приобретением в копилке лечебных опцией диссеминированного НМРЛ.
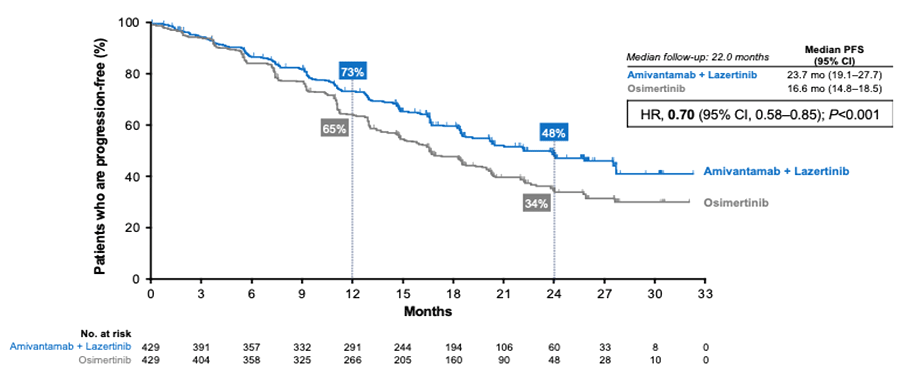
Рисунок 5. Выживаемость без прогрессирования в исследовании MARIPOSA.
Take-home Message:
Источники: