06.02.2024

Несмотря на заметные достижения консервативных подходов, наиболее эффективной опцией радикального лечения по-прежнему остается хирургическое вмешательство. Основными направлениями развития торакальной онкологии сегодня являются минимизация хирургической травмы за счет внедрения малоинвазивных методик и уменьшение хирургической агрессии за счет разработки паренхима-сберегающих техник.
Отсутствие негативного влияния малоинвазивного доступа на онкологический прогноз пациентов с раком легкого было неоднократно доказано в крупных систематических обзорах и метаанализах. Проведенный в 2019 году метаанализ Ng C., включивший 145 исследований и 16200 пациентов, показал не только высокую безопасность торакоскопических вмешательств (частота осложнений в группе видеоторакоскопии 36% против 42% в группе торакотомии, р<0,0001; рис.1), но и их положительное влияние на отдаленные результаты лечения (5-летняя общая выживаемость – 72% против 67%, ОР=1,35, р<0,0001; рис.2) [1].

Рисунок 1. Частота послеоперационных осложнений.

Рисунок 2. Пятилетняя общая выживаемость.
Аналогичные данные были представлены в опубликованном в 2021 году метаанализе Yang C., в ходе которого были обобщены результаты хирургического лечения 1559 пациентов со II стадией НМРЛ. Авторам не удалось выявить каких-либо достоверных различий ни по частоте и структуре послеоперационных осложнений, ни по влиянию операционного доступа на онкологический прогноз больных [2].
Вопрос применимости торакоскопического доступа при разных стадиях немелкоклеточного рака легкого также детально изучался в работе Кононца П.В. [3]. Было показано, что полностью малоинвазивные вмешательства ассоциируются с улучшением качества выполняемой лимфодиссекции (среднее количество удаленных лимфоузлов – 25,4 против 19,8; р=0,0002), снижением частоты послеоперационных осложнений (9,1% против 21,0%; р=0,0001) и улучшением отдаленных результатов лечения при II стадии НМРЛ. Так, в группе видеоторакоскопии отмечалось увеличение 5-летней ОВ до 77,8% по сравнению с 45,4% при открытом доступе (p=0,0306). При этом подгрупповой анализ IIa и IIb стадий показал, что статистическая достоверность различий была достигнута за счет улучшения показателей выживаемости именно при IIb стадии (ОВ: р=0,0015; БРВ: р=0,0324). Среди пациентов со IIa стадией достоверных различий выявлено не было (ОВ: р=0,9356; БРВ: р=0,9548).
Не меньший интерес вызывают возможности уменьшения объема хирургического вмешательства без потери онкологического радикализма. Данное направление мысли является закономерным эволюционным этапом хирургической онкологии. Стоит вспомнить, что история хирургии рака легкого планомерно смещала границы «минимального объема операции» от пневмонэктомии в 30-х годах XX века к лобэктомии в 1960 году и, наконец, к аккуратному изучению эффективности сублобарных резекций в 1995 году. Несмотря на это, длительное время споры об эффективности паренхима-сберегающих подходов не утихали, что не позволяло им занять прочное место в клинической практике онкологов до момента публикации в 2022-2023 годах результатов исследований III фазы CALGB140503/
Авторы исследования CALGB140503/
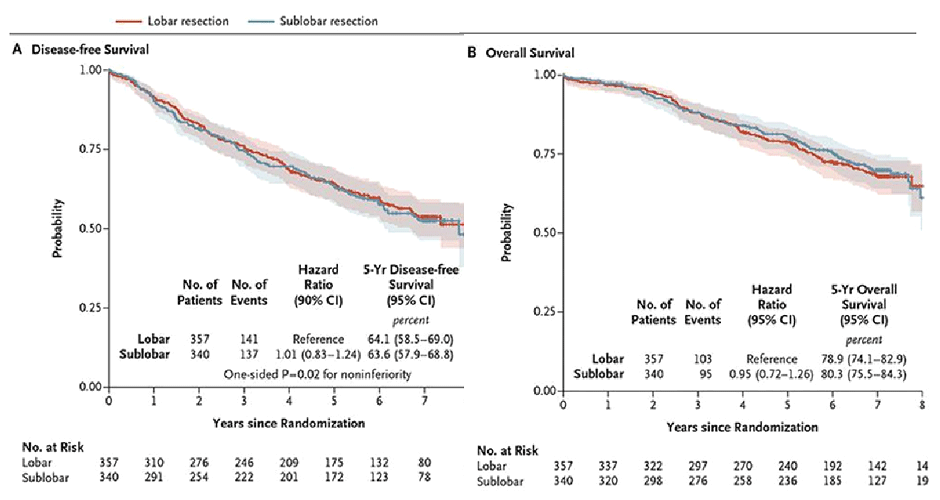
Рисунок 3. Выживаемость без прогрессирования (а) и общая выживаемость (б) в исследовании CALGB 140503.
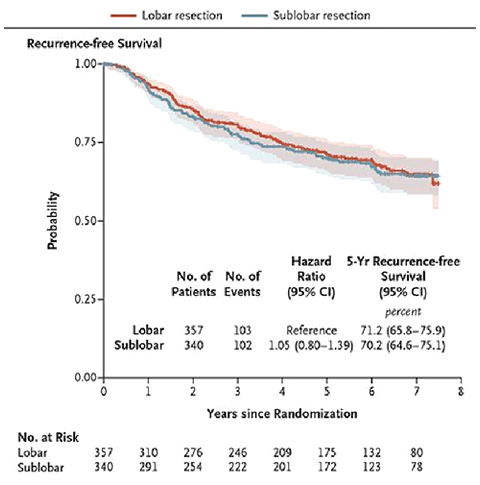
Рисунок 4. Частота местных рецидивов в исследовании CALGB 140503.
При этом между группами практически отсутствовали различия по показателям функции внешнего дыхания через 6 месяцев после операции. В группе сублобарных резекций отмечалось снижение ОФВ1 в среднем на 4% (95% ДИ 5,0-2,0), а в группе лобэктомий – на 6% (95% ДИ 8,0-5,0).
Полученные результаты соотносятся с данными опубликованного в 2022 году исследования JCOG0802 [5], авторы которого показали отсутствие достоверных различий по частоте послеоперационных осложнений и улучшение показателя 5-летней ОВ (94,3% по сравнению с 91,1%; р<0,0001) в группе сегментэктомий по сравнению с лобэктомиями (рис.5). Респираторная функция легких также была несколько выше в группе сублобарных резекций: после сегентэктомий и лобэктомий отмечалось снижение показателя ОФВ на 8,5% и 12% соответственно (р<0,0001) [5].
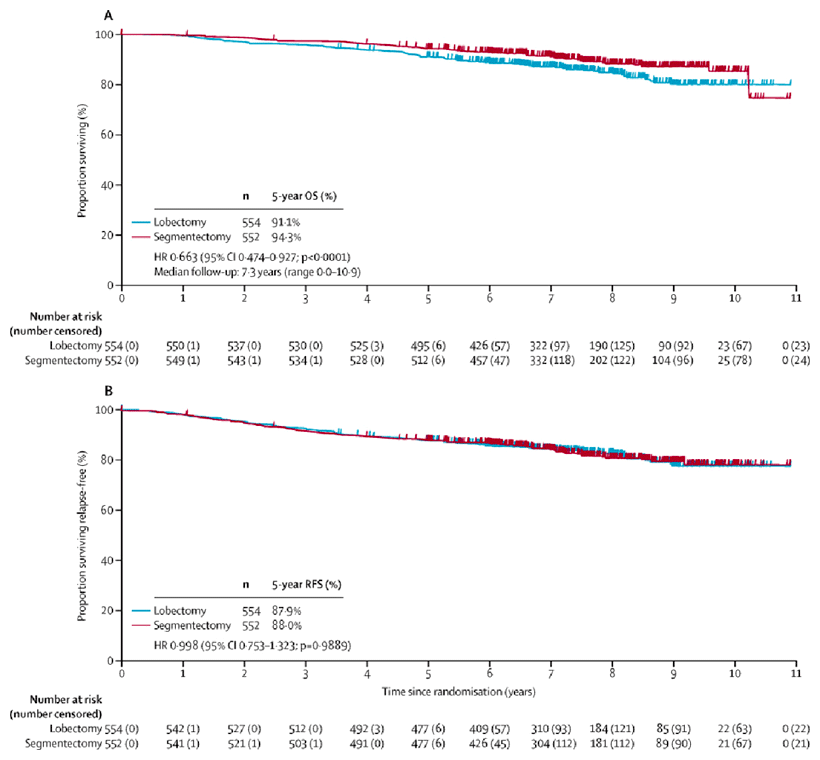
Рисунок 5. Общая (а) и безрецидивная (b) выживаемость в исследовании JCOG0802.
В январе 2024 года были опубликованы обновленные результаты исследования CALGB 140503 [6]. Более детальный анализ влияния объема сублобарных резекций (атипичная или анатомическая) на отдаленные результаты лечения не выявил достоверных различий между изучаемыми подгруппами: 5-летняя выживаемость без прогрессирования в группах сегментэктомий и атипичных резекций составила 63,8% против 62,5% соответственно (p=0,888). Помимо оценки результатов лечения, авторы также проанализировали частоту выявления в популяции больных вторых первичных злокачественных новообразований легких. Было показано, что за 7 лет наблюдения повторный рак легкого был диагностирован у 15,9% пациентов в общей группе, 17,2% в группе сублобарных резекций и 14,7% в группе лобэктомий, что подчеркивает необходимость строгого динамического наблюдения за пациентами даже после радикального лечения [7].
Стоит еще раз подчеркнуть, что вышеуказанные исследования включали только пациентов с самыми ранними стадиями периферических опухолей. На сегодняшний день отсутствуют рандомизированные работы по изучению применимости подобных вмешательств при опухолях II-III ст., а эффективность и целесообразность выполнения сэмплинг-биопсии (или доле-специфичной лимфодиссекции) и вовсе ставится под большой вопрос в виду непредсказуемости лимфодренирования и наличия развитой системы лимфатических коллатералей. Более того, несмотря на отсутствие в ряде работ негативного влияния сэмплинг-биопсии на отдаленные результаты лечения, в реальной клинической практике мы бы не рекомендовали отказываться от выполнения полноценной системной медиастинальной лимфодиссекции в связи с высокой прогностической и стратегической ценностью правильного хирургического N-стадирования.
Иной перспективной опцией паренхима-сберегающих вмешательств при опухолях >2 см являются анатомические зональные резекции, выполняемые при локализации опухоли в пределах одной изолированной анатомической зоны (S1-3 слева, S4-5 слева, базальная пирамида с обеих сторон) и отсутствии пораженных корневых лимфоузлов [3]. Тем не менее, данный вид вмешательств пока не был достаточно изучен в рандомизированных исследованиях и, как следствие, может рассматриваться в первую очередь у пациентов со значительным снижением респираторной функции легких и пограничной переносимостью операции.
Take-home Message:
Источники: