01.02.2024


В начале декабря 2023 года в городе Сан Антонио (штат Техас, США) прошел 46 ежегодный симпозиум по раку молочной железы. Одна из крупнейших в мире конференций собрала около 10 000 участников из 102 стран. Основными темами, которые были освещены в рамках симпозиума, стали деэскалация локорегионарных методов воздействия и индивидуализация лечения с использованием таргетных препаратов.
Деэскалация локорегионарного лечения
Интересными с точки зрения снижения объема лечебного воздействия на аксиллярную область без ухудшения онкологических результатов стали результаты исследований SENOMAC и NRG Oncology/
В соответствии с результатами исследования SENOMAC возможно отказаться от выполнения аксиллярной лимфодиссекции (АЛД) у пациентов, которым первым этапом выполнено оперативное вмешательство и у которых выявлены метастазы в 1 или 2 сигнальных лимфоузлах, в том случае, если в дальнейшем возможно проведение лучевой терапии.
В исследование включались пациенты с диагнозом рак молочной железы (РМЖ) сТ1-3N0M0, которым в качестве первого этапа лечения выполнялось хирургическое вмешательство; 89% пациентов в обеих группах в последующем подверглись лучевой терапии, включая облучение лимфоузлов. Всего в исследование было включено 2540 больных с 1-2 пораженными сигнальными лимфатическими узлами, которые были рандомизированы в две группы: группа аксиллярной лимфодиссекции (n=1205) и группа без аксиллярной лимфодиссекции (n=1335).
Цель исследования, крупнейшего на сегодняшний день по данному вопросу, состояла в том, чтобы заполнить пробелы в существующих данных. Аналогичные результаты были получены в исследовании ACOSOG Z0011 около десяти лет назад, но обширные критерии исключения вызвали вопросы об экстраполяции полученных данных на общую популяцию пациентов. Отталкиваясь от этого, формировались критерии включения в исследование SENOMAC. Мастэктомия была выполнена у 36,2% пациенток, наличие экстранодального распространения наблюдалось у 34,3%, Т3 стадия была в 5,8% случаев, почти 20% пришлось на дольковую карциному, 40% были в возрасте 65 лет и старше, а медианный размер опухоли составил 20 (0,2-155) мм.
При медиане наблюдения 47 месяцев безрецидивная выживаемость (БРВ) была практически идентичной в обеих группах: рецидивы наблюдались у 8% пациентов в группе выполнения лимфодиссекции и у 7,1% в группе без лимфодиссекции. Рассчитанная 5-летняя БРВ составила 88,7% в группе АЛД против 89,7% в группе без АЛД (HR 0,89; 95% ДИ 0,66-1,19; non-inferiority р<0,001) (рис.1).
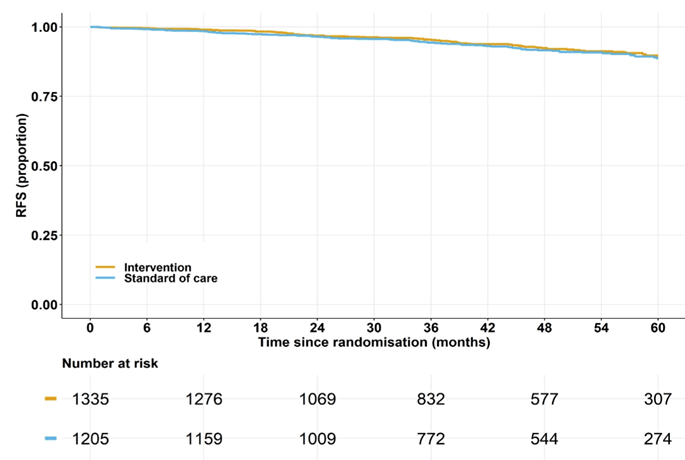
Рисунок 1. Результаты исследования SENOMAC: рассчитанная 5-летняя безрецидивная выживаемость.
В течение 2 лет ожидаются данные по общей выживаемости, которая является первичной конечной точкой исследования. По данным подгруппового анализа результаты исследования не зависели от объема операции, стадии, возраста, количества пораженных лимфоузлов и биологического подтипа опухоли. Таким образом, у пациентов с первичным РМЖ стадии Т1-3N0 с 1 или 2 метастатически пораженными лимфоузлами возможно отказаться от выполнения аксиллярной лимфодиссекции вне зависимости от объема оперативного вмешательства на молочной железе, при условии, что в дальнейшем будет проведена лучевая терапия.
На этой же сессии был представлен доклад Совместной группы по исследованию раннего рака молочной железы (Early Breast Cancer Trialists’ Collaborative Group, EBCTCG), известной в онкологическом сообществе крупными метаанализами. Продемонстрированы результаты метаанализа, включавшего 20285 женщин из почти 30 различных исследований, в котором сравнивалось влияние объема хирургического вмешательства на частоту рецидивов и на частоту осложнений.
Объем хирургического вмешательства был разделен на «больший объем» и «меньший объем» в связи с тем, что в метаанализе использовались исследования за период с 1950 по 2010 гг. В течение этого времени аксиллярная хирургия прошла через несколько ключевых периодов, включая период исследований до изучения биопсии сигнальных лимфатических узлов (БСЛУ), период исследований непосредственно БСЛУ и период после БСЛУ (рис.2).
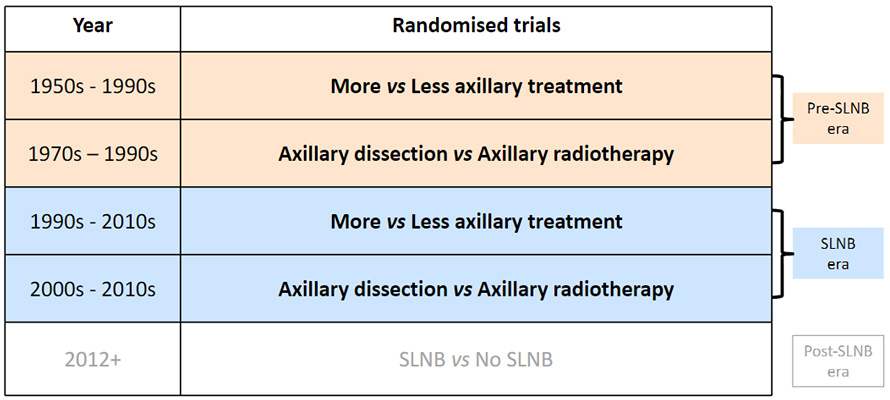
Рисунок 2. Метаанализ EBCTCG: распределение проанализированных исследований на периоды.
При медиане наблюдения 10 лет частота локорегионарных рецидивов не отличалась между пациентами, перенесшими более или менее обширную операцию на аксиллярной области (RR 0,91; 95% ДИ 0,78-1,06; Р=0,22). Авторы продемонстрировали аналогичные результаты в отношении отдаленных рецидивов, смертности от рака молочной железы и смерти от любых причин. Однако колоссальная разница наблюдалась в частоте осложнений. Для оценки частоты развития лимфедемы авторы оценивали относительно недавние исследования, которые наиболее релевантны в плане современного лечения.
Частота развития лимфедемы в группе более обширного хирургического вмешательства была в 2,5 раза больше по сравнению с менее обширным хирургическим вмешательством (OR 2,43; 95% ДИ 2,13-2,78) (рис.3).
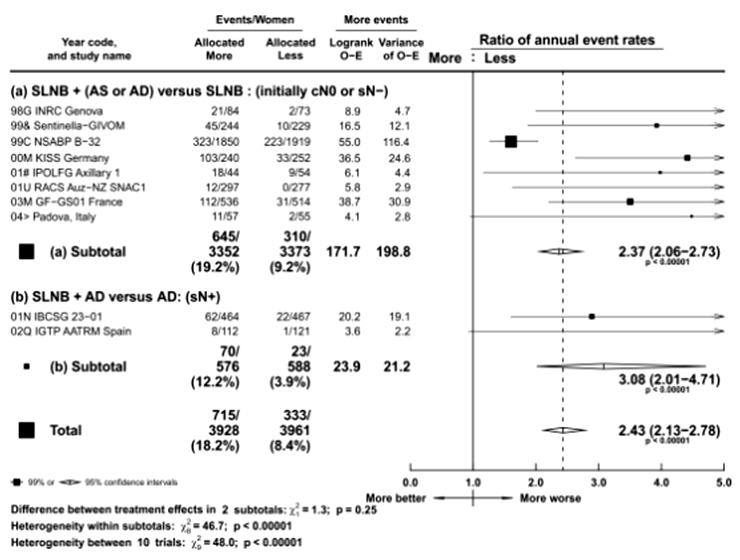
Рисунок 3. Метаанализ EBCTCG: риск развития лимфедемы в зависимости от объема выполненного хирургического вмешательства.
Еще одним важным исследованием в области регионарного лечения, результаты которого были представлены на SABCS 2023, является NRG Oncology/
У всех пациенток статус лимфатических узлов соответствовал стадии cN1, что подтверждалось с помощью биопсии на момент постановки диагноза. Для включения в исследование по результатам послеоперационного гистологического заключения статус лимфоузлов должен был соответствовать стадии ypN0. В качестве первичной конечной точки оценивался интервал без инвазивного рецидива рака молочной железы (Invasive Breast Cancer Recurrence-free Interval, IBCRFI). По результатам исследования статистически значимой разницы между группами не наблюдалось. Так, в группе облучения IBCRFI составил 92,7%, а в группе без облучения – 91,8% (HR 0,88; 95% ДИ 0,60-1,29; p=0,51) (рис.4).
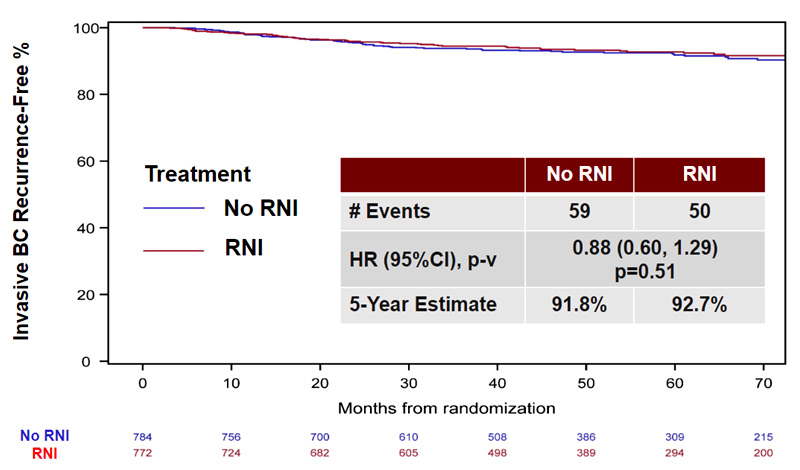
Рисунок 4. Результаты исследования NRG Oncology/
5-летняя выживаемость без заболевания (disease-free survival, DFS) также статистически значимо не отличалась между подгруппами: 88,5% в группе облучения и 88,3% в группе без облучения регионарных лимфоузлов (HR 1,06; 95% ДИ 0,79-1,44; p=0,69).
HER2-позитивный рак молочной железы
Окончательные результаты исследования KATHERINE подтвердили преимущество адъювантного назначения препарата трастузумаб-эмтанзин (T-DM1) по сравнению со стандартным трастузумабом у пациентов с резидуальной опухолью после неоадъювантной терапии по поводу HER2-позитивного РМЖ.
В исследование было включено 1486 пациентов, которые были рандомизированы 1:1 в группу T-DM1 или в группу трастузумаба. В 2018 году были представлены первые результаты, согласно которым назначение T-DM1 приводило к статистически значимому улучшению показателей 3-летней выживаемости без инвазивного заболевания по сравнению с трастузумабом (88,3% против 77%). Однако для оценки общей выживаемости требовалось более длительное наблюдение. Представленный на SABCS окончательный анализ позволил заполнить этот пробел и подтвердить эффективность назначения T-DM1.
Семилетняя выживаемость без инвазивного заболевания составила 80,8% в группе T-DM1 против 67,1% в группе трастузумаба (HR 0,54; 95% ДИ 0,44-0,66; p<0,0001). Семилетняя общая выживаемость составила 89,1% против 84,4% в группе T-DM1 и в группе трастузумаба соответственно (HR 0,66; 95% ДИ 0,51-0,87; p=0,0027) (рис.5).
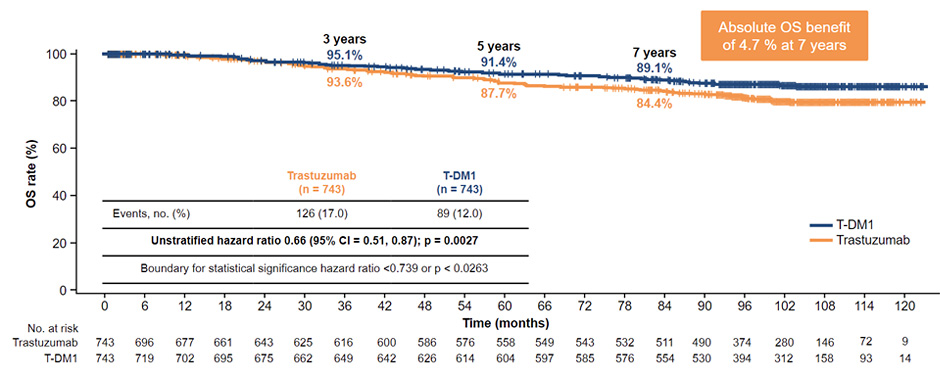
Рисунок 5. Результаты исследования KATHERINE: 7-летняя общая выживаемость.
Анализ безопасности не показал новых побочных эффектов при более длительном наблюдении, а нежелательные явления 3 степени и выше наблюдались только у 0,4% пациентов в обеих группах.
Интересными данными в рамках постерной сессии поделились авторы исследования APHINITY. Представлен подгрупповой анализ эффективности назначения двойной таргетной блокады в адъювантном режиме по сравнению с назначением только трастузумаба в зависимости от статуса рецепторов эстрогена (ER) и рецепторов HER2. В анализ были включены 4782 пациента. Польза от добавления пертузумаба наблюдалась во всех подгруппах (HR 0,77; 95% ДИ 0,65-0,92). Наибольший выигрыш наблюдался в подгруппе пациентов с HER2 FISH low/ER+ опухолями (рис.6).
HER2 FISH классифицировался на следующие категории: low (2≤FISH<5) и high (FISH≥5). Обе категории в соответствии с алгоритмами Колледжа американских патологов классифицируют РМЖ как HER2-позитивный.
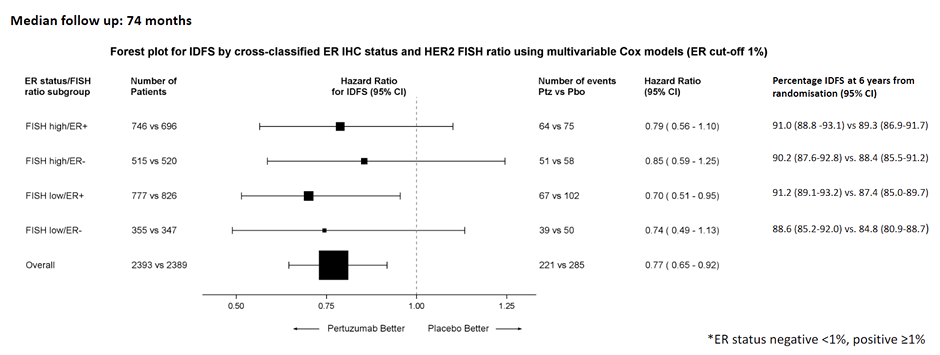
Рисунок 6. Результаты исследования APHINITY: forest plot для выживаемости без инвазивного заболевания.
HR-позитивный рак молочной железы
Одной из самых обсуждаемых тем стало представление результатов исследования INAVO120, в котором изучалась роль препарата инаволисиба в комбинации с палбоциклибом и фулвестрантом в качестве 1 линии терапии у пациентов с PIK3CA-мутированным HR-позитивным HER2-негативным местнораспространенным или метастатическим раком молочной железы. В группе сравнения пациенты получали плацебо в комбинации с палбоциклибом и фулвестрантом. Обязательным критерием включения было прогрессирование заболевания во время лечения или в течение 12 месяцев после завершения адъювантной гормонотерапии и отсутствие предшествующей терапии по поводу метастатического заболевания.
В исследование включено 325 пациентов. В качестве первичной конечной точки оценивалась выживаемость без прогрессирования (ВБП), которая составила 15,0 мес. в группе инаволисиба и 7,3 мес. в группе плацебо (HR 0,43, 95% ДИ 0,32-0,59; p<0,0001) (рис.7). Период наблюдения был недостаточным для оценки общей выживаемости, тем не менее, наблюдался позитивный тренд в пользу применения инаволисиба (stratified HR 0,64; 95% ДИ 0,43-0,97; p=0,0338 (заложенный статистически значимый порог p<0,0098)).
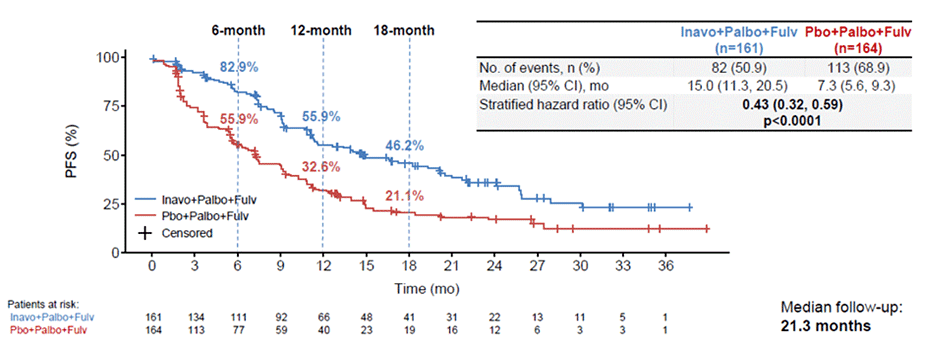
Рисунок 7. Результаты исследования INAVO120: выживаемость без прогрессирования.
В рамках этой же сессии были представлены окончательные результаты исследования NATALEE. В это исследование было включено 1748 пациентов с HR+/HER2- ранним РМЖ (стадия II и III). Пациенты были рандомизированы 2:1 в группу адъювантного назначения препарата из группы ингибиторов ароматазы в комбинации с рибоциклибом и в группу назначения только ингибиторов ароматазы (анастразол или летрозол). Представленные 3-летние результаты продемонстрировали преимущество назначения рибоциклиба в отношении выживаемости без инвазивного заболевания: 90,7% против 87,6% (HR 0,749; 95% ДИ 0,628-0,829; p=0,0006) (рис.8).
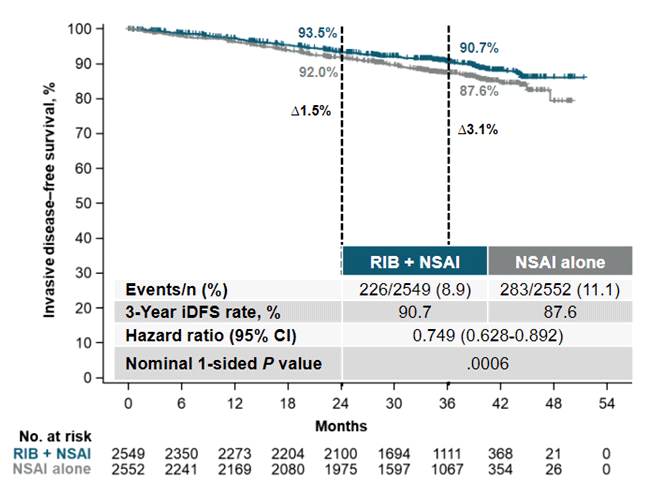
Рисунок 8. Результаты исследования NATALEE: 3-летняя выживаемость без инвазивного заболевания.
В 3-летних показателях общей выживаемости (HR 0,892; 95% ДИ 0,661-1,203) не было показано статистически значимых различий. Однако для достоверной оценки требуется более длительное наблюдение.
Представлены результаты исследования MONARCH-3, в котором изучалась роль ингибитора CDK4/6 абемациклиба в комбинации с одним из ингибиторов ароматазы в качестве первой линии терапии постменопаузальных женщин с распространенным HR+/HER2- РМЖ. Ранее опубликованные данные по выживаемости без прогрессирования: 28,2 мес. в группе абемациклиба и 14,8 мес. в группе только ингибитора ароматазы (HR 0,540; 95% ДИ 0,418-0,698; p=0,000002) привели к повсеместному одобрению для рутинного применения регуляторными органами по всему миру.
Показатели общей выживаемости были представлены на SABCS 2023 и составили 66,8 мес. в группе применения абемациклиба и 54,7 мес. в группе без абемациклиба (HR 0,804; 95% ДИ 0,637-1,015; p=0,0664) (рис.9).
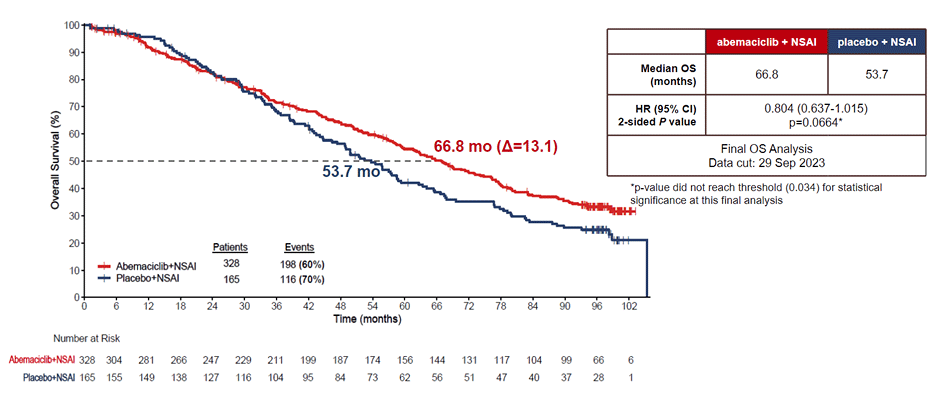
Рисунок 9. Результаты исследования MONARCH-3: общая выживаемость.
Несмотря на то, что разница между группами составила 13,1 мес. и клиническая значимость применения абемациклиба не вызывает сомнений, достичь статистически значимых различий исследователям не удалось.
Иммунотерапия при раннем раке молочной железы
На данный момент существуют данные об эффективности иммунотерапии только при трижды негативном РМЖ. На SABCS 2023 были представлены предварительные результаты исследований KEYNOTE-756 и Checkmate-7FL, в которых иммунотерапия применяется при HR-позитивном РМЖ.
В исследовании KEYNOTE-756 препарат пембролизумаб используется в неоадъювантном режиме в комбинации с химиотерапией по сравнению с плацебо в комбинации с химиотерапией у пациентов с ранним HR+/HER2- РМЖ. В качестве первичных конечных точек оценивается частота достижения полного патоморфологического ответа (pCR) и бессобытийная выживаемость (EFS). Представленные результаты промежуточного анализа демонстрируют частоту pCR 24,3% в группе пембролизумаба и 15,6% в группе плацебо (∆ 8,5 [4,2–12,8]; p=0,0005). В подгрупповом анализе в зависимости от экспрессии PD-L1 наибольшая частота достижения pCR наблюдалась при PD-L1 CPS ≥20 и составила 53,6% в группе пембролизумаба против 36,4% в группе плацебо (∆ 17,4 [5,1–29,1]).
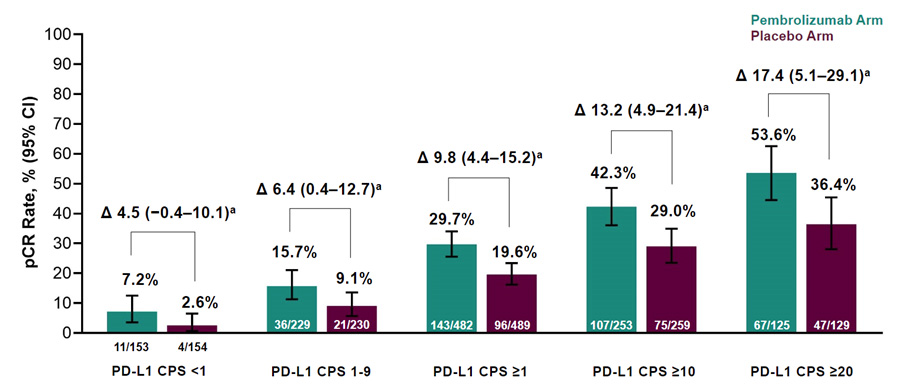
Рисунок 10. Результаты исследования KEYNOTE-756: частота достижения pCR в зависимости от экспрессии PD-L1.
Похожие результаты наблюдаются в исследовании Checkmate-7FL, в котором изучается роль применения препарата ниволумаб в неоадъювантном режиме в комбинации с химиотерапией по сравнению с группой плацебо с химиотерапией у пациентов высокого риска с HR+/HER2- РМЖ низкой степени дифференцировки. В качестве первичной конечной точки оценивалась частота достижения pCR. Предварительные результаты были доложены на конгрессе ESMO 2023: частота pCR в группе ниволумаба составила 24,5% против 13,8% в группе только химиотерапии (∆ 10,5 [4,0–16,9]; p=0,0021). В рамках SABCS 2023 доложены результаты подгруппового анализа эффективности в зависимости от различных биомаркеров, в том числе в зависимости от используемого метода определения PD-L1. Частота достижения pCR при использовании метода Ventana PD-L1 SP142 и при результате PD-L1 ≥1 составила 44,3% в группе ниволумаба и 20,2% в группе плацебо (∆ 24,1 [10,1–36,7]). Частота достижения pCR при использовании метода Dako 28-8 алгоритм CPS и при результате CPS ≥20 составила 78,9% в группе ниволумаба и 26,7% в группе плацебо (∆ 52,3 [18,6–72,4]).
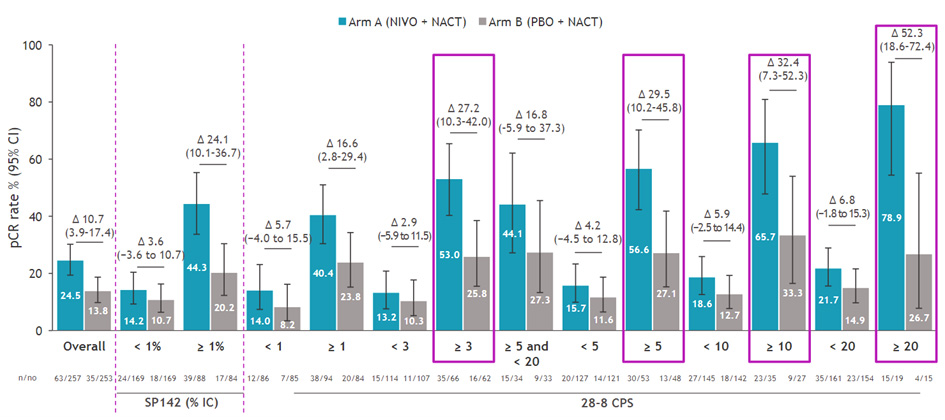
Рисунок 11. Результаты исследования Checkmate-7FL: частота достижения pCR в зависимости от экспрессии PD-L1 и от используемого метода определения экспрессии PD-L1.
Источники: