30.01.2024

Одной из наиболее обсуждаемых тем прошедшего года стало появление новых возможностей комбинированного лечения немелкоклеточного рака легкого (НМРЛ) с проведением периоперационной химиоиммунной терапии.
Идея сочетания двух направлений системного лечения не нова и была представлена еще в исследовании CheckMate 816 [1]. Данная работа включала пациентов с IB-IIIA ст. с резектабельными опухолями и отсутствием драйверных мутаций ALK и EGFR. Больные были рандомизированы в экспериментальную группу с химиоиммунотерапией (3 курса ниволумаба 360 мг 1 раз в 3 недели + платиносодержащая ХТ на выбор исследователя) и контрольную группу (плацебо и платиносодержащая ХТ 3 курса 1 раз в 3 недели), с последующим хирургическим лечением в обеих группах. Было показано, что применение комбинированной терапии приводит не только к достоверному увеличению частоты полных патоморфологических ответов (pCR 24% против 2,2%; ОШ 13,94; 99% ДИ 3,49-55,75; p<0,001), но и к улучшению непосредственных онкологических результатов лечения (рис.1). Медиана бессобытийной выживаемости (event-free survival, EFS) в экспериментальной группе (ниволумаб + химиотерапия) составила 31,6 мес. против 20,8 мес. в группе контроля (ОР 0,63; 97,38% ДИ 0,43-0,91; p=0,005). При этом профиль безопасности лечения оставался удовлетворительным с частотой нежелательных явлений (НЯ) 3-4 ст. 33,5% и 36,9% в экспериментальной и контрольной группах соответственно. Проведенный подгрупповой анализ показал, что данная схема лечения была наиболее эффективна среди пациентов с положительной экспрессией PD-L1 (>1%) и IIIa ст. заболевания.
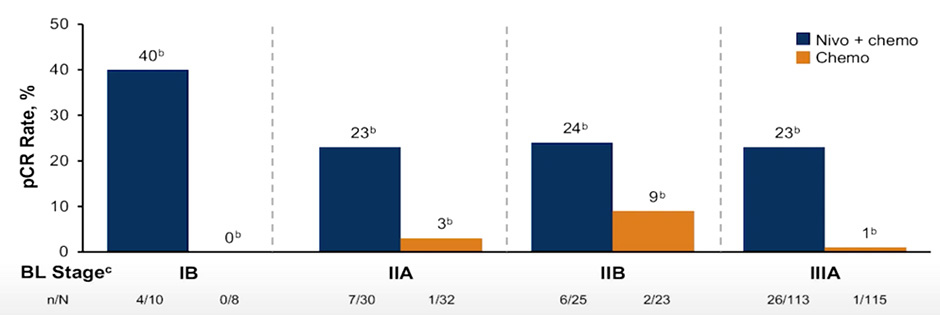
Рисунок 1. Частота полных патоморфологических ответов в зависимости от стадии.
Наибольший выигрыш по частоты pCR наблюдался среди пациентов с ранними стадиями и независимо от экспрессии PD-L1. Все это позволило FDA 4 марта 2022 года зарегистрировать данную комбинацию для неоадъювантного лечения резектабельного НМРЛ [2]. Обновленные в мае 2023 года данные также подтвердили большую эффективность комбинированной терапии с увеличением показателя 3-летней EFS до 57% по сравнению с 43% при проведении только химиотерапии (ОР 0,68) (рис.2).
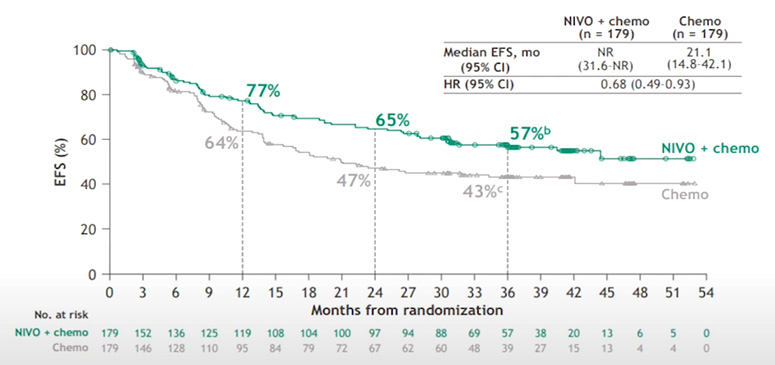
Рисунок 2. Трехлетняя бессобытийная выживаемость при предоперационном введении нволумаба.
Успехи предоперационной терапии ниволумабом не могли остаться незамеченными, что вылилось в разработку и инициацию целого ряда схожих по дизайну работ, главной задачей которых служило улучшение выживаемости пациентов за счет добавления к уже известной формуле адъювантного иммунотерапевтического компонента.
Так, одними из первых в октябре 2023 года были представлены результаты исследования III фазы Keynote-671 [3]. Исследование включало пациентов с II-IIIb ст. (n=397) вне зависимости от наличия у них драйверных мутаций и рандомизировало их либо в группу периоперационного введения пембролизумаба (4 курса по 200 мг 1 раз в 3 недели до операции, 13 курсов по 200 мг 1 раз в 3 недели после операции) с неоадъювантной платиносодержащей ХТ на выбор исследователя, либо в контрольную группу с 4 курсами ХТ и периоперационным введением плацебо. Авторы показали, что проведение 4 курсов неоадъювантной химиоиммунотерапии с адъювантным введением пембролизумаба на протяжении 1 года привело к значимому улучшению 3-летней общей выживаемости (ОВ) до 71,3% против 64% в группе только неоадъювантной химиотерапии (НАХТ) (ОР 0,72; 95% ДИ 0,56-0,93; p=0,005170) и 2-летней бессобытийной выживаемости (EFS) до 62,4% против 40,6% (ОР 0,58; 95% ДИ 0,46-0,72; p<0,0001) (рис.3а,б). Медиана общей и бессобытийной выживаемости в экспериментальной группе за период наблюдения достигнута не была.
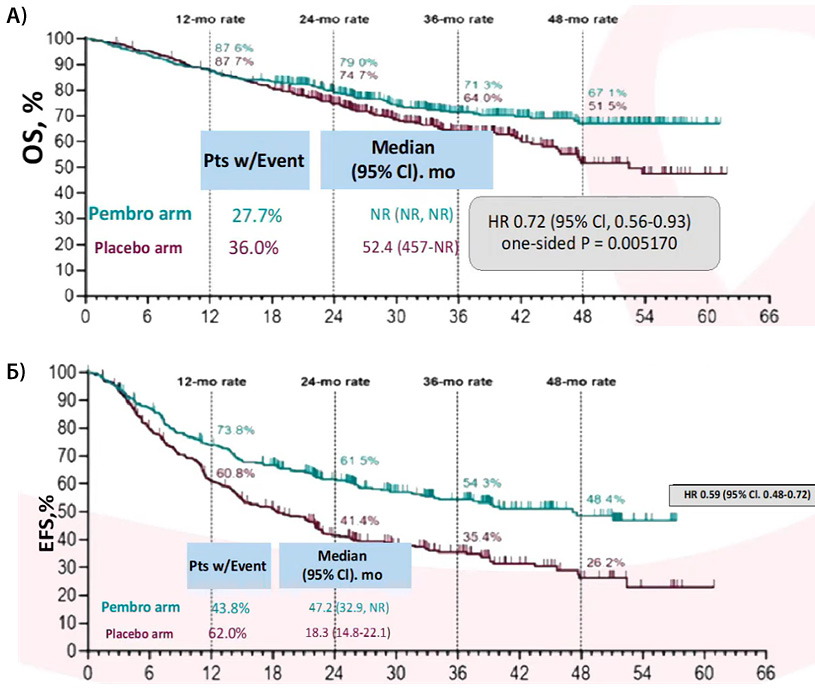
Рисунок 3. Общая (А) и бессобытийная (Б) выживаемость при периоперационном введении пембролизумаба.
Аналогично исследованию CheckMate 816, проведение неоадъювантной химиоиммунотерапии улучшало частоту полных (18,1% против 4%) и больших патоморфологических ответов (30,2% против 11%) (рис.4). Тем не менее, по данным подгруппового анализа, применение данной схемы ассоциировалось с улучшением отдаленных результатов лечения лишь у пациентов c IIIА стадией и уровнем экспрессии PD-L TPS >1%. Также интенсификация терапии приводила к росту частоты нежелательных явлений. Так, НЯ 3-4 ст. были выявлены у 44,9% пациентов в группе периоперационного введения пембролизумаба и у 37,3% пациентов в группе НАХТ (тошнота – 54,5% против 51,4%; нейтропения – 42,7% против 42,1%; анемия – 36,1% против 33,8%). Частота аутоиммунных НЯ любой степени, в свою очередь, достигла в экспериментальной группе 25,3% против 10,5% в группе контроля. На основании полученных данных периоперационное назначение пембролизумаба было одобрено FDA 16 октября 2023 года [4].
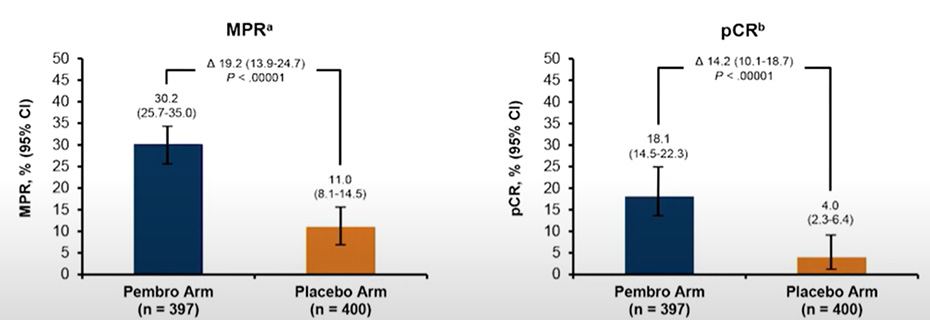
Рисунок 4. Частота mPR и pCR при предоперационном введении пембролизумаба.
Не менее резонансным стало исследование III фазы AEGEAN [5]. Данная работа обладала схожим дизайном и включала пациентов с II-IIIВ ст. (n=786) и отсутствием драйверных мутаций ALK и EGFR. Пациентам в экспериментальной группе предлагалось проведение химиоиммунной терапии дурвалумабом (4 курса по 1500 мг 1 раз в 3 недели до операции, 12 курсов по 1500 мг 1 раз в 4 недели после операции) с неоадъювантной платиносодержащей ХТ на выбор исследователя, а группе контроля – плацебо в сочетании с конвенциональной ХТ. Авторы показали, что подобный подход, как и в Keynote 671, обеспечивает достоверное улучшение бессобытийной выживаемости (в экспериментальной группе медиана не достигнута, в контрольной группе – 25,9 мес., ОР 0,68; 95% ДИ 0,53-0,88; p=0,004) и увеличение частоты pCR (17,2% против 4,2%) и mPR (33,3% против 12,3%) (рис.5).
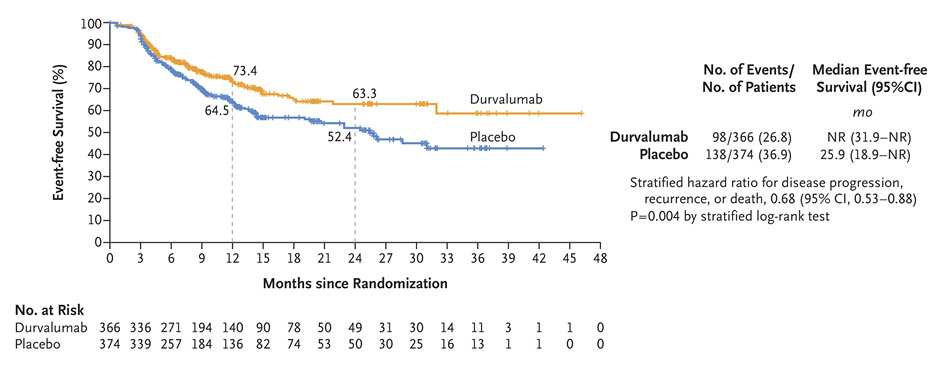
Рисунок 5. Бессобытийная выживаемость при периоперационном введении дурвалумаба.
Интервальный анализ, проведенный на 24 месяце наблюдения, продемонстрировал сохраняющуюся тенденцию к дальнейшему расхождению кривых EFS в общей популяции больных (2-летняя EFS 63,3% в группе дурвалумаба против 52,4% в группе плацебо) (рис.6). Дополнительными факторами высокой эффективности при проведении подгруппового анализа выступили активное курение на момент терапии (ОР 0,48) и наличие IIIА ст. заболевания (ОР 0,57), а экспрессия PD-L1, напротив, не оказала достоверного влияния на исход лечения. Профиль безопасности лечения также оставался удовлетворительным, с частотой НЯ 3-4 ст. и аутоиммунных НЯ любой степени соответственно 42,3% и 23,5% в группе дурвалумаба против 43,4% и 9,8% в группе плацебо. Однако малый период наблюдения и отсутствие доказанного влияние на общую выживаемость на данный момент не позволяют FDA официально зарегистрировать указанную схему.
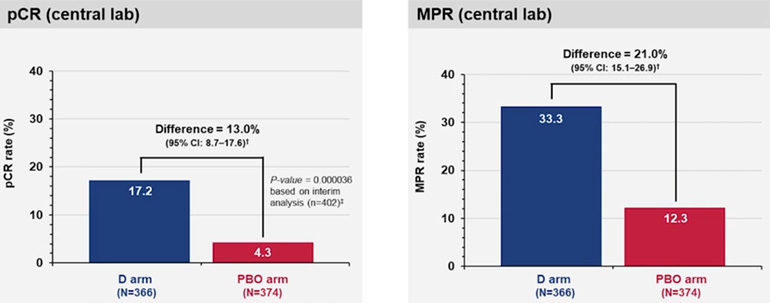
Рисунок 6. Частоты mPR и pCR при предоперационном введении дурвалумаба.
Разумеется, исследователи не обошли стороной и периоперационное введение ниволумаба, опубликовав в конце 2023 года результаты сразу 2 профильных работ NADIM II и CheckMate 77T [4,5]. Авторы продемонстрировали аналогичное Keynote 671 и AEGEAN улучшение EFS, pCR и mPR. Однако больший интерес в данных работах вызывает стремление авторов идентифицировать новые факторы прогноза на фоне проведения периоперационной иммунотерапии. Так, в исследовании NADIM II было показано, что, помимо ожидаемого положительного влияния на эффективность терапии экспрессии PD-L1 TPS >1%, важным негативным предиктором служило наличие на старте лечения циркулирующей опухолевой ДНК (цоДНК) >5%, что также коррелировало с размером первичной опухоли (рис.7).
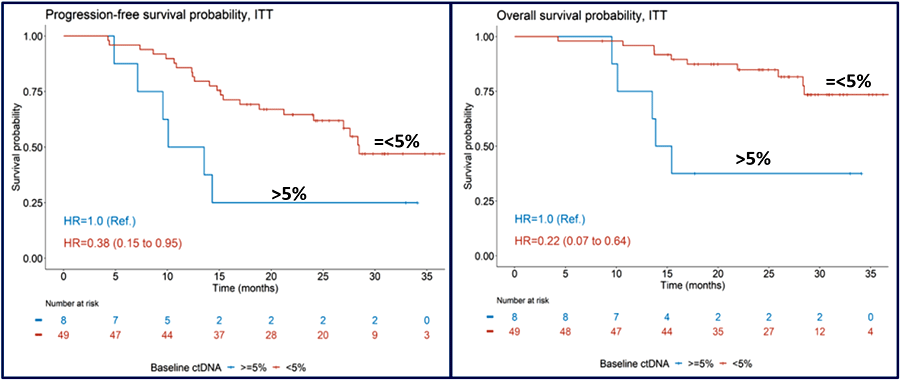
Рисунок 7. Прогностическое значение цоДНК на старте лечения резектабельного НМРЛ.
Проведение противоопухолевой терапии приводило к полной элиминации цоДНК у 67% пациентов (18 из 27) в группе ниволумаба с химиотерапией и у 44% (4 из 9) в группе плацебо с химиотерапией, но вопрос влияния подобного ответа со стороны цоДНК на прогноз заболевания все еще остается открытым и требует дальнейшего изучения [4]. Авторы CheckMate 77T, в свою очередь, изучили влияние pCR и mPR на бессобытийную выживаемость пациентов. Было показано, что реализация pCR и mPR имеет независимое положительное прогностическое значение, при этом наибольшая роль патоморфологического ответа отмечается именно в группе проведения иммунной терапии (рис.8).
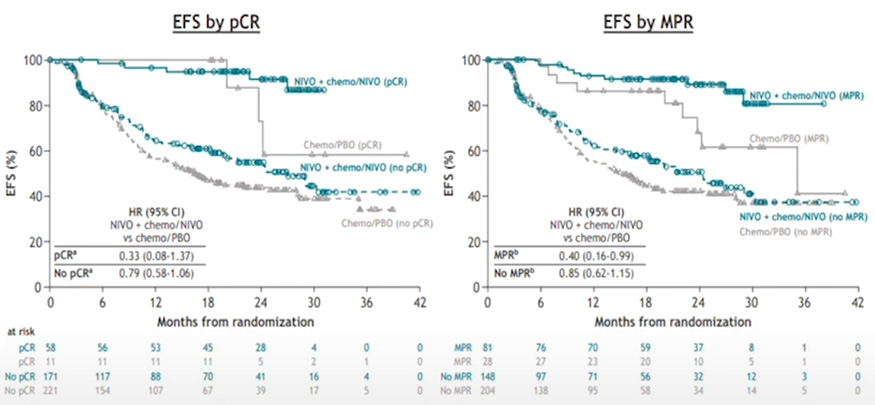
Рисунок 8. Прогностическое значение pCR и mPR.
Все вышеуказанные работы, несмотря на некоторые различия в дизайне и исследуемых препаратах, демонстрируют схожий характер улучшения непосредственных и отдаленных результатов комбинированного лечения, а опубликованные подгрупповые анализы позволяют нам выявить картину среднестатистического больного, имеющего наибольшие шансы на выигрыш от подобной терапии: курильщик, с местнораспространенным опухолевым процессом, соответствующим IIIА cт., и положительной экспрессией PD-L1. Подобные результаты не только упрощают идентификацию «идеального» пациента, но и мотивируют более активное применение методик предоперационного N-стадирования и определение в первичном биопсийном материале экспрессии PD-L1.
Take-home Message:
Источники: