24.01.2024

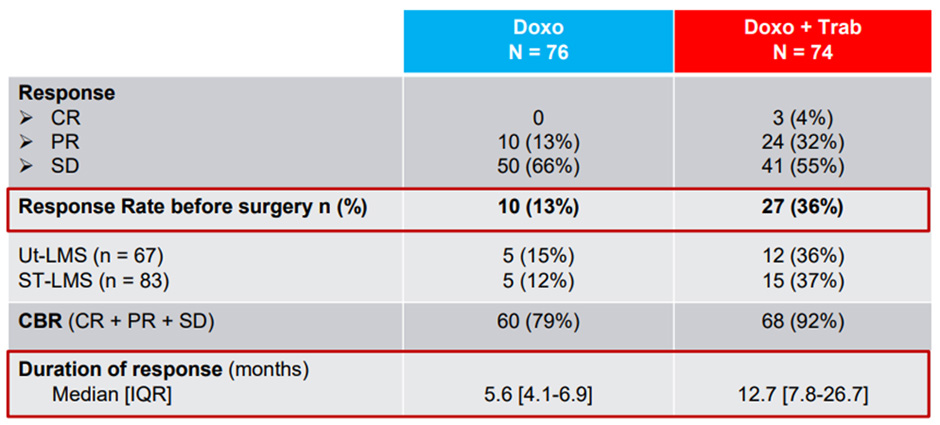
На ESMO 2023 года мы получили окончательные позитивные результаты рандомизированного исследования III фазы по лейомиосаркоме (LMS-04). Еще в 2021 году авторами было продемонстрировано достижение одной из контрольных точек, а именно увеличение выживаемости без прогрессирования (ВБП) в группе трабектедина и доксорубицина по сравнению с монодоксорубицином. Напомним, что тогда эти цифры при среднем наблюдении в 37 мес. достигали 13,5 мес. в группе трабектедина + доксорубицина (95% ДИ 11,3-16,7) и 7,3 мес. в группе контроля (95% ДИ 6,2-8,3), скорректированный HR 0,384 (0,27; 0,55) и p<0,0001. Частота объективных ответов составила 13% (10/76 частичный ответ (ЧО)) в группе контроля и 38% (4/74 полный ответ (ПО) + 24/74 ЧО) во второй группе. Общий контроль над заболеванием (ПО + ЧО + СЗ) в группе контроля ВБП составил 79% и 92% во второй группе. На этот раз при медиане наблюдения в 55 мес. ВБП составила 26,4 мес. в группе трабектедина и доксорубицина и 13,4 мес. в группе контроля, скорректированный HR 0,46 (0,32; 0,65) и p<0,0001. После завершения 6 циклов лечения 8% из группы контроля и 20% из второй группы было выполнено хирургическое лечение. Хотя 38% пациентов в контрольной группе получали трабектедин после прогрессирования, добавление трабектедина к доксорубицину с последующим применением трабектедина в терапии первой линии метастатических лейомиосарком обеспечило клинически значимое улучшение выживаемости (2-летняя частота выживаемости: 49,3% против 68,5%; медиана ОВ: 23,8 мес. против 33,1 мес.; ОР 0,65, 95% ДИ 0,44-0,95). Комбинация трабектедина и доксорубицина показала эффективность как в ВБП, так и ОВ, при этом как при лейомиосаркоме мягких тканей, так и матки. Токсичность комбинации была ожидаемо выше, но управляемой. Покажет ли комбинация доксорубицина и трабектедина свою эффективность по сравнению с другими двухкомпонентными режимами химиотерапии, остается вопросом для будущих исследований. А пока у нас появилась новая комбинация.
Следующее исследование – рандомизированное исследование II фазы по оценке эффективности дурвалумаба и тремелимумаба по сравнению с доксорубицином у пациентов с распространенной или метастатической саркомой мягких тканей (MEDISARC, AIO-STS-0415). Исследование построено на предположении, что двойная блокада контрольных точек ингибитором PD-L1 дурвалумабом (DUR) и ингибитором CTLA-4 тремелимумабом (TREM) улучшит выживаемость у пациентов с первично нелеченными СМТ по сравнению с доксорубицином.
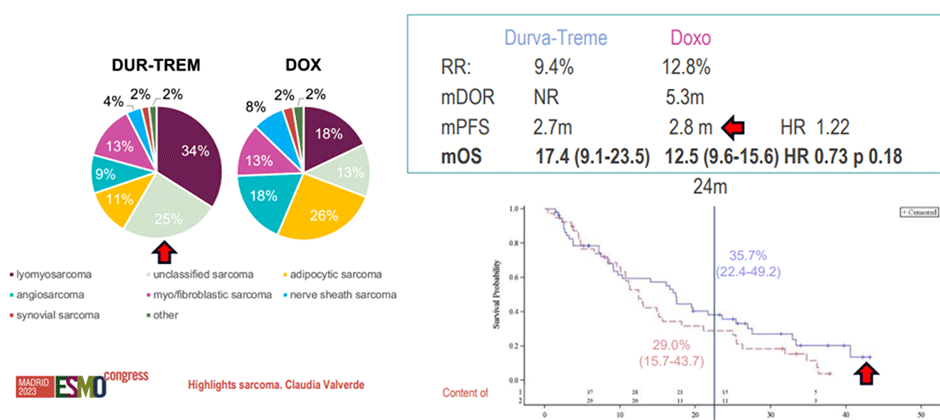
MEDISARC – первое исследование, в котором сравнивалась терапия ингибиторами иммунных контрольных точек (ICI) с доксорубицином у пациентов с саркомой, ранее не получавших лечения. Эффективность и безопасность комбинации дурвалумаб + тремелимумаб были сопоставимы с эффективностью монотерапии доксорубицином: ЧОО 9,4% против 12,8%; медиана ВБП 2,7 против 2,8 мес. (ОР 1,22; 80% ДИ 0,90-1,64); НЯ любой степени: 90,6% против 89,7%. Общая выживаемость имела тенденцию в пользу дурвалумаба + тремелимумаба, но не достигла статистической значимости: медиана ОВ 17,4 против 12,5 мес. (ОР 0,73; 95% ДИ 0,54-0,99). Исследование негативное, но в группе с комбинацией отмечался стойкий эффект в некоторых случаях, интересно узнать, какие именно это были подтипы сарком.
Еще одно исследование, к сожалению, однозначно негативное – MANTRA: глобальное рандомизированное многоцентровое исследование III фазы с ингибитором MDM2 миладеметаном в сравнении с трабектедином у пациентов с дедифференцированными липосаркомами. Ген MDM2 (murine double minute 2) является отрицательным регулятором. Хорошо дифференцированные или дедифференцированные липосаркомы (WD/DDLPS) характеризуются сверхэкспрессией MDM2 посредством амплификации MDM2, а у большинства пациентов наблюдаются опухоли TP53 дикого типа. Предполагается, что ингибирование MDM2 является рациональным терапевтическим подходом для пациентов с WD/DDLPS. Механизм действия миладеметана выглядит следующим образом:
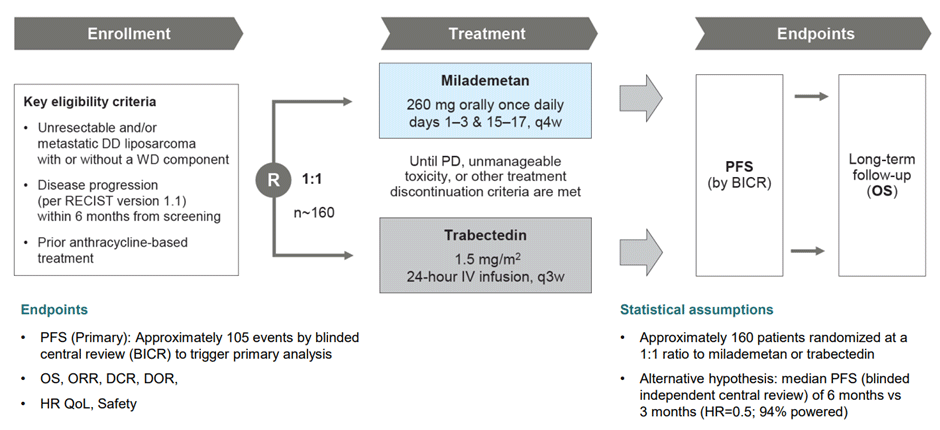
Медиана ВБП по BICR была количественно, но незначительно выше для миладеметана (3,6 против 2,2 мес.; р=0,53; ОР=0,89). Несмотря на небольшой период наблюдения, медиана общей выживаемости была сопоставима в двух группах миладеметана (9,49 против 10,2 мес.; р=0,3; ОР=1,27). Хотя медиана ВБП была выше для миладеметана, разница не была значимой, но дальнейшая оценка препарата оправданна в других группах сарком, которым может помочь ингибирование MDM2. Возможно, необходимо изменить группу сравнения.
Следующие работы касаются тактики ведения пациентов с определенным гистологическим подтипом. Первое – это когортное исследование Французской саркомной группы по саркомам с реаранжировкой PATZ1. Реаранжированные саркомы PATZ1 (PRS) относятся к группе «круглоклеточных сарком со слиянием EWSR1 и не-ETS». Характеризуются слиянием хромосом внутри 22q: EWSR1 (e1:8) MN1 и PATZ1 (e1:5). Поскольку лишь небольшая серия случаев (<10 случаев) сообщает о значительной клинической и гистологической гетерогенности, неопределенном прогнозе и отсутствии стандартов лечения, данная нозология настоятельно требует дальнейшей клинико-молекулярной характеристики. Главный вопрос – лечим как саркому Юинга? Были включены дети и взрослые пациенты из 13 французских центров с диагнозом в период с 2011 по март 2023 года (n=17). Каждый случай был гистологически и молекулярно проверен четырьмя саркомными экспертами-патоморфологами.
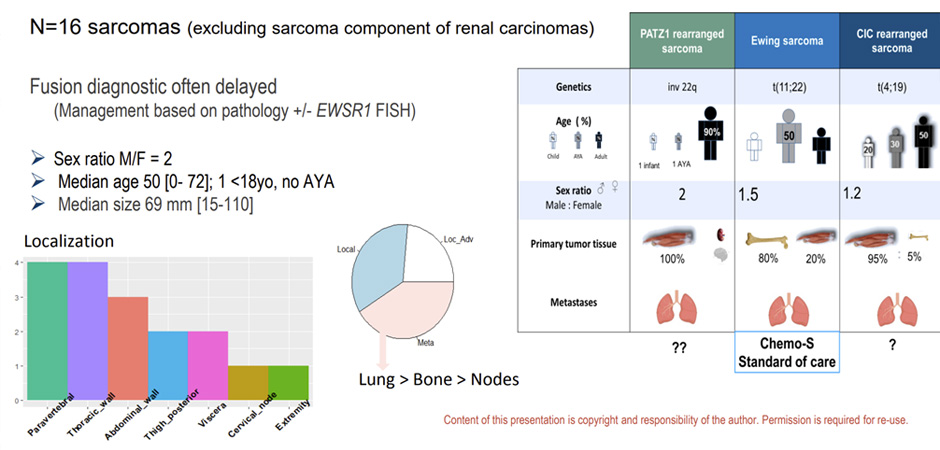
Средняя продолжительность наблюдения составила 44 месяца. Клинические данные были неоднородными с точки зрения исходных клинических характеристик, гистологии, лечения и исходов. В однофакторном анализе возраст, размер опухоли, степень по FNCLCC, адъювантная системная терапия неметастатического заболевания не коррелировали с общей выживаемостью, тогда как стадия, ki67 и некоторые транскриптомные признаки (относительно клеточного цикла) коррелировали. Группа пациентов с метастазами или ki67>30% имела агрессивное клиническое течение и плохой ответ на лечение (будь то режим, подобный Юингу, или другой). Отдельная группа пациентов имела индолентный профиль, и в течение длительного времени не наблюдалось рецидивов (>5 лет) после хирургического вмешательства без адъювантной химио-/лучевой терапии. Т.е. некоторые пациенты могут быть излечены только операцией, в то время как другие даже в комбинации с интенсивной ХТ погибают. Исследование показывает, что естественное течение саркомы с реаранжировкой PATZ1 отличается от саркомы Юинга. Некоторые саркомы с реаранжировкой PATZ1 с хорошим прогнозом излечиваются только хирургическим путем, тогда как другие являются агрессивными. Стадия и ki67 должны помочь идентифицировать этих пациентов, пока ожидаются дальнейшие молекулярные анализы.
Продолжительность лечения сорафенибом при фиброматозе десмоидного типа не установлена. Поиск оптимальной продолжительности для улучшения качества жизни пациентов с ДФ остается важным вопросом. На ESMO 2023 в одногрупповом клиническом исследовании II фазы было изучено течение десмоида после прекращения лечения сорафенибом у пациентов, ответивших на лечение. Это исследование Саймона, вторая фаза которого началась в июле 2021 года и продолжается до сих пор. Пациентам с ДФ конечностей, принимавшим сорафениб и ответившим на лечение, сорафениб был отменен. После прекращения лечения пациенты проходили осмотр каждые 3 месяца и МРТ каждые 6 месяцев. Опросник EORTC QLQ C30 заполнялся каждые 3 месяца в течение 1 года. Для радиологической оценки использовались критерии RECIST 1.1. Первичной конечной точкой была выживаемость без прогрессирования (ВБП) через 1 год. Было 33 пациента со средним возрастом 28,5 лет, соотношение женщин и мужчин составило 1,3. Сорафениб в дозе 200 мг/сут. применялся у 55% пациентов. Средняя продолжительность лечения сорафенибом составила 25 месяцев. На момент включения у одного пациента наблюдался ПО, у 21 (61,7%) – ЧО, а у 12 (35,3%) – СЗ. Средняя продолжительность наблюдения после включения в исследование составила 13 месяцев. 20 пациентов завершили 1 год наблюдения, из 20 пациентов, прошедших 1-летнее наблюдение, у 19 пациентов выявлена СЗ. Изменение размера опухоли через 1 год варьировалось от уменьшения на 21% до увеличения на 32% (медиана изменения 2%). Из 33 пациентов 3 возобновили прием сорафениба: 2 – из-за усиления боли (рентгенологически – СЗ) и 1 – из-за рентгенологического ПЗ. В конце 1 года прекращения приема сорафениба боль по шкале EORTC была значительно сильнее, но разница в общем состоянии здоровья и других параметрах была незначительной. Текущий промежуточный анализ показал многообещающую ВБП более 90% через 1 год после прекращения приема сорафениба. До 40% пациентов остаются полностью свободными от симптомов, связанных с заболеванием, в течение 1 года. Важно отметить, что размер опухоли продолжает регрессировать более чем у половины пациентов даже после отмены сорафениба.
Источники: